几株植物乳杆菌β-葡萄糖苷酶的特性研究
2019-02-14曾子毅丁诗瑶卢向阳王蓉蓉刘成国
曾子毅,丁诗瑶,卢向阳,姚 慧,王蓉蓉,肖 茜,刘成国,周 辉*
(1.湖南农业大学 食品科学技术学院 湖南省食品科学与生物技术重点实验室,湖南 长沙 410128;2.湖南农业大学 生物科学技术学院,湖南 长沙 410128;3.湖南南山牧业有限公司,湖南 城步 422512)
β-葡萄糖苷酶是一类可以催化水解芳香基或烃基与糖基之间糖苷键的酶[1]。β-葡萄糖苷酶最早在苦杏仁汁中被发现,该酶广泛分布于细菌、真菌和植物中。国内有许多学者从不同的生物体内提取、分离和纯化了该酶,并对其酶学特性进行了研究,不同生物体内提取的酶的最适温度与pH都不尽相同,但最适温度大多在20~60℃,最适pH都在3.5~6.0[2-4]。在水果蔬菜中,存在大量的以β-D-葡萄糖苷形式存在的非挥发性风味前体物质,如果采用β-葡萄糖苷酶进行果蔬汁的处理,可提高风味物质含量,从而大大改善产品的风味[5]。如在葡萄酒酿造过程中,葡萄酒或葡萄汁中的芳香化合物通常与糖结合形成非挥发性的糖苷,可被酒酒球菌(Oenococcus oeni)中的β-葡萄糖苷酶进行酶解转化,从而释放一系列萜类等香气化合物[6-7]。刘欢等[8]研究发现,β-葡萄糖苷酶对“双优”山葡萄酒香气成分具有显著的影响;方可等[9]研究发现,β-葡萄糖苷酶可有效提升速溶乌龙茶水溶液的花香、果香及青草香;产β-葡萄糖苷酶的菌株有酿酒酵母(Saccharomyces cerevisiae)[10]、液化沙雷菌属[11]、乳酸菌[12]等。β-葡萄糖苷酶还被广泛应用于水解大豆异黄酮苷,大豆异黄酮苷具有许多有益的生物活性,其结构与雌激素相似,摄入体内后能与雌激素受体结合,调节人体内雌激素水平[13]。摄入足够量的大豆异黄酮可以有效降低患骨质疏松症、妇女更年期综合症、高胆固醇症、以及心血管疾病和癌症的风险[14]。
乳酸菌是自然发酵果蔬中的优势微生物,对发酵果蔬品质和风味的形成具有重要的作用。其中植物乳杆菌(Lactobacillus plantarum)是发酵果蔬中最常见的乳酸菌,除了具有复杂的抵御不良环境的反应机制外,如耐酸、耐盐、耐氧化等反应机制,植物乳杆菌基因组中还具有大量编码碳水化合物利用的酶系基因,如β-葡萄糖苷酶、淀粉酶、单宁酶等[15]。关于植物乳杆菌中β-葡萄糖苷酶的研究已有报道,根据菌株的来源不同,其酶的分泌位置及酶活大小存在较大的差异性[16-20]。本研究以从自然发酵剁辣椒中分离出的4株植物乳杆菌为研究对象[20],以植物乳杆菌1.3919作为对照,采用分光光度法比较了这5株植物乳杆菌产β-葡萄糖苷酶的特性,试验结果为进一步阐明植物乳杆菌在发酵果蔬品质形成中的作用机制,同时为积极开发利用产β-葡萄糖苷酶的植物乳杆菌奠定一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
植物乳杆菌(Lactobacillus plantarum)1.3919、W-4、Y-12、Y-20、Y-22:均为实验室保存菌种。
1.1.2 化学试剂
对硝基苯-β-D-葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,p-NPG)(纯度98%)、对硝基苯酚(p-nitrophenol,p-NP)(纯度99.5%):美国AMRESCO公司;其他化学试剂均为国产分析纯。
1.1.3 培养基
MRS培养基:蛋白胨10.0 g/L,牛肉浸粉5.0 g/L,酵母浸粉4.0 g/L,葡萄糖20.0 g/L,磷酸氢二钾2.0 g/L,柠檬酸三铵2.0 g/L,醋酸钠5.0 g/L,硫酸镁0.2 g/L,硫酸锰0.05 g/L,吐温80 1.0 g/L,蒸馏水1 000 mL,121℃灭菌20 min。
1.2 仪器与设备
DNP-9272BS-Ⅲ型生化培养箱:上海新苗医疗器械制造有限公司;UV1750紫外分光光度计:上海元析仪器有限公司;普光HH-8数显恒温水浴锅:上海浦东物理光学仪器厂;LDZX-50FBS立式压力蒸汽灭菌器:上海申安医疗器械厂;雷磁pHs-3C pH计:上海精科仪器有限公司;1510型全波长酶标仪:赛默飞世尔科技有限公司;Avanti J-26XP型高速离心机:美国贝克曼库尔特公司;Scientz-IID超声波细胞破碎仪:宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 菌株活化及种子液的制备
将保存的植物乳杆菌以2%(V/V)的接种量接种于MRS液体培养基中,37℃静置培养24 h,备用。将活化后的植物乳杆菌菌液以2%(V/V)的接种量接种于MRS液体培养基中,37℃静置培养24 h,作为种子液。
1.3.2 胞内、胞外粗酶液的制备
将种子液以1%(V/V)的接种量接种于装液量为50 mL/200 mL MRS液体培养基中静置培养12 h,取培养液于4℃、5 000 r/min条件下离心10 min后,上清用于测定胞外β-葡萄糖苷酶活力。菌体沉淀用生理盐水洗涤2次之后,悬浮于2 mL、pH=5的乙酸-乙酸钠缓冲液中,再于超声波细胞粉碎机中,冰浴条件下进行超声破碎,超声功率130 W,破碎总时间设定为15 min,间隔时间2 s。先破碎完的细胞破碎液暂时放置于冰箱中冷藏保存,防止酶活力大量丧失。待全部破碎完后,于4℃、12 000 r/min的速度离心10 min。取上清液,用于测定胞内β-葡萄糖苷酶活力;再取细胞破碎液的离心沉淀,用pH=5.0的乙酸-乙酸钠缓冲液洗涤2次后,悬浮于1 mL、pH=5.0的缓冲液中,之后吸取100μL悬浮液于试管中,用于测定细胞膜上β-葡萄糖苷酶活力。
1.3.3 胞内β-葡萄糖苷酶活力的测定
(1)标准曲线的绘制
准确称取69.5 mg对硝基苯酚,加热水充分溶解后,冷却至室温,定容于500 mL容量瓶中,准确吸取该溶液0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL于6个10 mL容量瓶中,用1 mol/L碳酸钠溶液定容后,以1 mol/L碳酸钠溶液作为空白对照,于400 nm波长条件下测定紫外吸光度值。以p-NP质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制对硝基苯酚(p-NP)标准曲线。
(2)样品中胞内β-葡萄糖苷酶活力的测定
取100μL胞内粗酶液于干净试管中,加入1.8 mL、pH=5.0的乙酸-乙酸钠缓冲液,以加入100μL缓冲液代替粗酶液的试管作为空白对照,两组处理于37℃恒温水浴箱中恒温水浴5 min,然后加入100μL,20 mmol/L的反应底物对硝基苯-β-D-葡萄糖苷,反应10 min后加入1 mL、1 mol/L的碳酸钠溶液终止反应,待冷却至室温后,将反应液于400 nm条件下测定其吸光度值。按照标准曲线回归方程计算样品中胞内β-葡萄糖苷酶活力。
β-葡萄糖苷酶活力单位定义:在37℃,pH 5.0条件下,每分钟催化生成1 nmol的对硝基苯酚所需的酶量为一个酶活单位(U)。
1.3.4 胞外β-葡萄糖苷酶活力的测定
将1.3.2中的菌液离心上清液作为粗酶液,空白对照为加热使酶失活的离心上清液,按照1.3.3中方法测定β-葡萄糖苷酶活力,反应时间改为4 h。胞外酶的酶活力单位定义为37℃,pH 5.0条件下,每小时催化生成1 nmol/L的对硝基苯酚所需的酶量为一个酶活单位(U)。
1.3.5 菌体干质量测定
准确称量空离心管的质量,然后分别准确吸取一定体积的植物乳杆菌培养液于离心管中,4℃、5 000 r/min条件下离心10 min,去上清后,将离心管置于恒温干燥箱中烘干至恒质量,测定离心管的质量,离心管前后质量之差即为该菌一定体积菌液的干质量。
1.3.6 胞内β-葡萄糖苷酶特性
(1)最适反应温度
分别设定酶解反应温度为25℃、30℃、37℃、44℃、51℃、58℃,其余条件同1.3.3,终止反应待冷却至室温后,于波长400 nm条件下测定其吸光度值,计算得到比酶活,计算公式如下:

(2)最适反应pH
分别配制pH为4.0、4.5、5.0、5.5、6.0的乙酸-乙酸钠缓冲液,于试管中加入100μL各菌的粗酶液,以加入100μL缓冲液代替粗酶液作为空白对照,并在各试管中分别加入不同pH的缓冲液1.8 mL,其余条件同1.3.3,终止反应待冷却至室温后,于波长400 nm条件下测定其吸光度值。
(3)不同含量氯化钠对胞内β-葡萄糖苷酶活性的影响
取100μL粗酶液于试管中,加入1.8 mL、氯化钠含量分别为0、5%、10%的乙酸-乙酸钠缓冲液,以加入100μL含对应浓度氯化钠的缓冲液代替粗酶液作为空白对照,其余条件同1.3.3,终止反应待冷却至室温后,于波长400 nm条件下测定其吸光度值,计算β-葡萄糖苷酶的活力。未添加氯化钠缓冲液的测定结果为U o,含5%或10%氯化钠缓冲液的测定结果为U i,其抑制率计算公式如下:
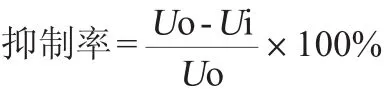
(4)不同含量乙醇对胞内β-葡萄糖苷酶活性的影响
取100μL粗酶液于试管中,加入1.8mL、乙醇体积分数分别为0、5%、10%、15%的乙酸-乙酸钠缓冲液,以加入100μL缓冲液代替粗酶液作为空白对照,其余条件同1.3.3,终止反应待冷却至室温后,于波长400 nm条件下测定其吸光度值,计算β-葡萄糖苷酶的活力。未添加乙醇缓冲液的吸光度值为U o,含5%、10%、15%乙醇缓冲液的吸光度值为U i,β-葡萄糖苷酶抑制率计算公式如下:

2 结果与分析
2.1 p-NP标准曲线
以β-葡萄糖苷酶酶解产物p-NP质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制的标准曲线见图1。
由图1可知,对硝基苯酚标准曲线的回归方程为y=0.180 7x+0.035 6,相关系数R2=0.999 7,表明二者具有良好的相关性,该标准曲线可用于后续酶活力的测定。

图1 对硝基苯酚的标准曲线Fig.1 Standard curve of p-nitrophenol
2.2 胞内β-葡萄糖苷酶活力测定结果
β-葡萄糖苷酶在5株植物乳杆菌胞内不同部位的酶活测定结果见表1。
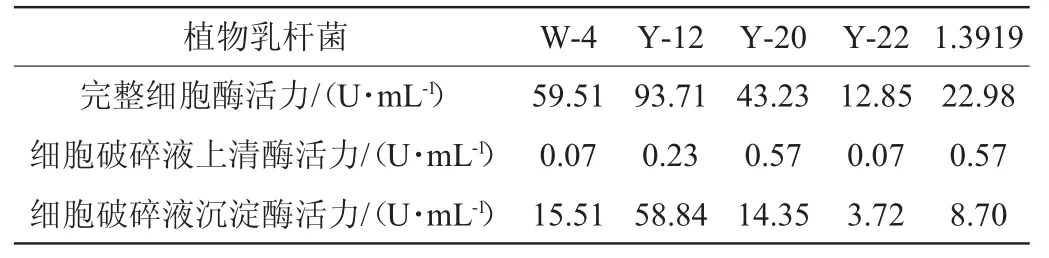
表1 5株植物乳杆菌胞内不同部位的β-葡萄糖苷酶的测定结果Table 1 Determination results ofβ-glucosidase from different parts in cells of 5 L actobacillus plantarum strains
由表1可知,完整细胞的酶活力最高(12.85~93.71 U/mL),其次是细胞破碎液的沉淀(3.72~58.84 U/mL),而细胞破碎液的上清中酶的活性最低(0.07~0.57 U/mL),由此可知,5株植物乳杆菌的β-葡萄糖苷酶均主要位于细胞膜上,原生质体中几乎无该酶存在,目前发现多数植物乳杆菌的胞内β-葡萄糖苷酶位于细胞膜上[3]。但是相比于完整的细胞,尽管实验过程中已经尽力去保证酶活力不丧失,其酶活力仍然普遍大幅降低,可能的原因是脱离了细胞的有机环境之后,某些细胞中含有的对酶催化作用有重要的作用的辅基等物质就缺失了,另外超声波破碎对于本质是蛋白质的β-葡萄糖苷酶具有损伤作用,所以导致酶活力的下降。
2.3 胞外β-葡萄糖苷酶活力测定结果
5株菌产胞外β-葡萄糖糖苷酶活力测定结果见图2。
由图2可知,5株植物乳杆菌中,菌株W-4和1.3919的胞外酶活力(>16 U/mL)相对较高,其余3株菌胞外酶活力(<7.5 U/mL)较低,由于本试验中5株植物乳杆菌的培养时间相同,并未对其进行细胞数或干质量的测定,因此试验结果只能简单分析这5株植物乳杆菌的胞外酶活力。相对于胞内酶,胞外β-葡萄糖苷酶的活性要低很多。

图2 植物乳杆菌的胞外β-葡萄糖苷酶活力Fig.2 Extracellularβ-glycosidase activity of Lactobacillus plantarum
2.4 胞内β-葡萄糖苷酶的最适反应温度
5株植物乳杆菌粗酶液在不同温度条件下β-葡萄糖苷酶活力测定结果见图3。

图3 不同温度条件下的β-葡萄糖苷酶活力Fig.3β-glycosidase activities under different temperature conditions
由图3可知,菌株W-4、Y-12所产的β-葡萄糖苷酶最适反应温度在37℃,菌株Y-20、Y-22和菌株1.3919所产的β-葡萄糖苷酶最适温度在30℃,试验结果与目前广泛认为该酶的最适温度大多在20~60℃的结论相符合。
2.5 胞内β-葡萄糖苷酶的最适反应pH
5株植物乳杆菌粗酶液在不同pH条件下β-葡萄糖苷酶活力测定结果见图4。

图4 不同pH条件下的β-葡萄糖苷酶活力Fig.4β-glycosidase activities under different pH conditions
由图4可知,菌株W-4和菌株Y-12所产的β-葡萄糖苷酶最适pH为4.5,菌株Y-20和1.3919所产的β-葡萄糖苷酶最适pH均为5.5,菌株Y-22所产的β-葡萄糖苷酶最适pH为5.0。也与目前普遍认为该酶的最适pH在3.5~6.0,属于酸性蛋白质的结论相符合[5]。
2.6 不同含量氯化钠对β-葡萄糖苷酶活性的影响
不同含量氯化钠对5株植物乳杆菌β-葡萄糖苷酶活力的影响见图5。

图5 不同含量氯化钠对β-葡萄糖苷酶活力的影响Fig.5 Effect of different NaCl concentrations onβ-glycosidase activity
由图5可知,氯化钠对酶活力具有明显的抑制作用,且氯化钠含量越高,对酶活力的抑制作用越强。其中5%氯化钠对菌株Y-22β-葡萄糖苷酶活力的抑制率是44%,而10%氯化钠的抑制率则>60%。植物乳杆菌作为腌制发酵果蔬中常见的发酵菌种,常常要耐受一定含量的氯化钠。氯化钠不仅抑制微生物的生长,同时还对β-葡萄糖苷酶的活力有一定的抑制作用。因此,果蔬腌制发酵时,较高浓度的氯化钠可能会通过抑制β-葡萄糖苷酶活力来降低香气物质的转化和释放。因此,低盐浓度的腌制有助于微生物的生长代谢,有利于果蔬中香气物质的释放。
2.7 不同含量乙醇对β-葡萄糖苷酶活性的影响
不同体积分数乙醇对5株植物乳杆菌β-葡萄糖苷酶活力的影响见图6。

图6 不同含量乙醇对β-葡萄糖苷酶活力的影响Fig.6 Effects of different ethanol concentrations onβ-glycosidase activity
由图6可知,乙醇对β-葡萄糖苷酶酶活力具有明显的抑制作用,并且乙醇含量越高,抑制作用越强。其中乙醇对菌株W-4、Y-12、Y-22和1.3919的抑制率较高,达到50%左右,而对菌株Y-20的抑制率较低(<25%)。乙醇是发酵果酒中重要的微生物代谢产物,植物乳杆菌可参与葡萄酒酿造过程中的苹乳发酵阶段,促进葡萄汁中香气成分的转化和释放,因而对葡萄酒的品质形成具有重要的作用[6]。因此耐受一定乙醇的β-葡萄糖苷酶对于完成苹乳发酵,促进葡萄酒香气的形成具有潜在的应用价值。因此,选育能产耐乙醇β-葡萄糖苷酶的微生物菌株有利于增加葡萄酒等果酒的香气,提高产品的品质。
3 结论
本试验中使用的5株植物乳杆菌均具有β-葡萄糖苷酶活性,不同菌株间活力存在差异,条件最适时,比酶活由高到低顺序为菌株W-4(14.168 U/g)>菌株Y-12(13.015 U/g)>菌株Y-20(11.359 U/g)>菌株1.3919(7.029 U/g)>菌株Y-22(4.630 U/g)。菌株W-4和1.3919具有相对较高的胞外酶活力,但是胞外酶活力要远低于其胞内酶活力。从胞内酶定位的结果来看,5株菌的β-葡萄糖苷酶均位于细胞膜上,原生质体内几乎无酶存在。5株植物乳杆菌的最适温度均在30~37 ℃,pH=4.0~5.5。
在实际发酵生产过程中,氯化钠和乙醇常存在于乳酸菌的生存环境中。通过本次实验的结果可以看出,氯化钠和乙醇对乳酸菌产出的β-葡萄糖苷酶活力具有明显的抑制作用,且抑制作用的强度随浓度提高而增强。因此,未来在选育果蔬发酵剂菌株时,应考虑菌株产β-葡萄糖苷酶的耐氯化钠和乙醇能力,β-葡萄糖苷酶耐受能力强的菌株更有助于果蔬中香气前体物质的转化,提高产品品质。
本研究证实了β-葡萄糖苷酶在植物乳杆菌中普遍存在,但该酶在细胞中的存在部位以及酶活力大小存在菌株特异性,同时也看出,植物乳杆菌β-葡萄糖苷酶的最适反应pH非常适宜果蔬的酸性环境。对5株植物乳杆菌β-葡萄糖苷酶研究的基础上,还需要结合体外香气前体物质的转化研究来进一步考察植物乳杆菌在果蔬发酵中的潜力,为开发果蔬发酵剂奠定基础。
