一株采油用嗜热特基拉芽孢杆菌厌氧生长代谢研究
2019-02-13林军章谭晓明汪卫东李希明
林军章,冯 云,谭晓明,王 静,汪卫东,李希明
(中国石油化工股份有限公司胜利油田分公司 石油工程技术研究院,山东 东营 257000)
引 言
微生物采油分为内源微生物采油和外源微生物采油,后者是指将具有采油功能的微生物在地面发酵后注入到油藏中进行驱油的技术,该技术主要针对内源微生物匮乏的油藏,具有目标功能菌明确的优势[1-6],外源微生物油藏适应性是其能否在油藏内发挥作用的关键。油藏作为厌氧环境,微生物厌氧生长代谢能力决定其油藏适应性和驱油性能。前期多数外源菌采油相关性能研究都是在好氧条件下开展[7-10],而严格厌氧条件下的外源菌生长代谢以及调控方法研究较少,本文以一株嗜热特基拉芽孢杆菌为对象,对其在厌氧条件下的生长代谢及调控方法进行研究,为该类菌株在采油中的应用提供理论依据。
1 材料与方法
1.1 菌种及来源
实验用菌株分离自胜利油田60 °C油藏产出液中,现保存于中石化微生物采油重点实验室的菌种保藏中心。菌株经16SDNA测序鉴定为嗜热特基拉芽孢杆菌(Bacillustequilensis)。
1.2 培养基
基础培养基:葡萄糖4 g/L,酵母粉1 g/L,蛋白胨 1 g/L,磷酸氢二钾3 g/L。
优化培养基:添加硝酸钠作为电子受体,在上述基础培养基中分别添加0 g/L,1 g/L,3 g/L,6 g/L的硝酸钠。
1.3 方法
1.3.1 菌株厌氧培养方法
采用亨盖特微生物厌氧操作平台进行微生物厌氧培养基制备和培养,实验步骤为:①在250 mL厌氧培养瓶中装入100 mL培养基;②厌氧瓶中用高纯氮气除氧,分装后密闭120 °C灭菌;③灭菌后培养基中接种5 mL菌株种子液,60 °C培养,不同时间取样分析。
1.3.2 微生物生长曲线测定
不同培养时间取培养液离心,菌体重悬后利用紫外分光光度计在600 nm下测试光密度(OD)值。
1.3.3 微生物乳化能力评价
微生物乳化能力利用乳化指数方法评价,即在25 mL定量管中将微生物培养液样品与柴油按照1∶1混合,振荡器均匀振荡3 min后静止5 min测定乳化层高度(H1)和未乳化层高度(H2),柴油乳化指数(R)。R=H1/(H1+H2)×100%。
1.3.4 微生物产气量分析
先用压力表检测厌氧瓶上部顶空的气体压力p,然后通过公式n=pV/RT(n为气体摩尔数,p为气体压力,V为顶空气体体积,T为绝对温度,R为气体常数)计算微生物厌氧培养体系产气量。
1.3.5 生物乳化剂提取方法
60 ℃培养48 h后,培养液于4 ℃、8 000 r/min 离心20 min 除去菌体后,过0.22 μm膜,上清液中加入3倍体积 4 ℃预冷的酒精,用玻璃棒搅拌均匀,置于-20 ℃ 4 h。8 000 r/min 离心2 min,沉淀用ddH2O 重悬透析后冷冻干燥,得乳化剂粗提物,20 ℃ 保存。
1.3.6 生物乳化剂种类鉴定分析
生物乳化剂粗提物分别进行糖和蛋白质定量分析,方法如下:
总糖含量测定:采用蒽酮—硫酸法[11]。
蛋白含量测定:采用考马斯亮蓝法[12]。
蛋白质电泳:采用SDS-PAGE蛋白质电泳操作方法[13]。
1.3.7 生物乳化剂结构红外光谱分析
将溴化钾和生物乳化剂(粗品)在研钵中磨碎,制作压片,然后对其进行红外光谱分析。
1.3.8 挥发性脂肪酸分析
挥发性脂肪酸分析进样量50 μL,进样温度300 ℃,检测器(FID) 温度300 ℃,升温程序:100 ℃(3 min)—10 ℃/min—240 ℃ (20 min),载气为恒流1 mL/ min 的氮气。
1.3.9 物理模拟驱油
利用室内物理模拟实验,考察菌株厌氧激活条件下的驱油效率。实验模拟胜利油田沾3区块油藏条件,实验过程为填装石英砂岩心,渗透率1 000×10-3μm2左右,抽真空、饱和实验区块的地层水,计算岩心的孔隙体积,饱和实验区块的脱水脱气原油,计算岩心的原始含油量,静置老化7 d。岩心一次水驱3倍空隙体积(PV),一次水驱至岩心产出液含水率与实验区块油井平均含水率一致。注入0.3 PV菌株和营养剂,其中菌株培养液占10%,营养剂为葡萄糖4 g/L,酵母粉1 g/L,蛋白胨 1 g/L,磷酸氢二钾3 g/L,硝酸钠3 g/L,在60 ℃下恒温培养15 d。注地层水开展二次水驱,待岩心出口含水率与区块油井平均含水率一致时停止水驱,计算驱油效率,同时进行3根岩心管平行实验。
2 结果与讨论
2.1 菌株在不同条件下的生长曲线
该株嗜热特基拉芽孢杆菌为兼性微生物,在好氧和厌氧条件下均可以生长(如图1所示),但从生长曲线对比发现,好氧生长速率远高于厌氧生长速率,好氧12 h达到峰值,而厌氧需要124 h达到峰值,且好氧生长菌体量明显高于厌氧生长的菌体量,好氧菌体OD600达到0.37,而厌氧OD600仅为0.088。厌氧生长代谢明显弱于好氧生长代谢的原因主要是该菌株前期筛选和培养都是在好氧条件下进行,当从好氧生长环境转移到厌氧生长环境后,菌株需要更长的时间适应厌氧环境。当把该菌株在厌氧环境中反复培养传代5次以上,菌株在厌氧条件下的生长速率明显提高,48 h就达到生长的最大值,比初始缩短了76 h,而且生物量也明显提升(如图2所示)。该研究结果表明通过好氧发酵方式生产的外源菌注入油藏后适应性弱,需要同时配注空气来提高其油藏适应性,或者通过厌氧发酵方式生产外源菌来提高菌株的油藏适应性。

图1 特基拉芽孢杆菌厌氧和好氧生长曲线Fig.1 Growth curves of Bacillus tequilensis under anaerobic and aerobic conditions respectively

图2 特基拉芽孢杆菌厌氧培养传代后生长曲线Fig.2 Growth curves of Bacillus tequilensis before and after subcultivation acclimation under anaerobic condition
2.2 菌株厌氧乳化特性
原油的生物乳化是重要的微生物驱油机理,而微生物对原油的厌氧乳化能力研究相对较少,本文通过对菌株的厌氧代谢乳化能力进行评价以认识其驱油潜力。研究发现,调整硝酸盐浓度对菌株厌氧生长代谢产乳化剂方面有明显影响,当硝酸钠的质量浓度提高到1 g/L以上时乳化指数能达到100%,但当硝酸钠质量浓度达到6 g/L时乳化指数反而降低,只有73%(表1)。上述实验结果表明添加适当比例电子受体对该菌株厌氧生长代谢产乳化剂具有促进作用,但硝酸盐浓度过高后乳化指数反而降低,这主要因为高浓度电子受体盐度过高导致微生物代谢活性下降,该菌株合成乳化剂效率随之降低。

表1 硝酸钠对特基拉芽孢杆菌厌氧乳化指数的影响Tab.1 Effect of sodium acid on emulsification index of Bacillus tequilensis under anaerobic condition
2.3 菌株厌氧代谢乳化剂产物分析
该菌株厌氧培养液提取出的乳化剂粗提物产量约为0.75 g/L,其中总糖占生物乳化剂总量的35.1%;蛋白质占生物乳化剂总量的16.0%,由此可知该生物乳化剂主要是糖和蛋白质的聚合物。该乳化剂粗提物经蛋白酶K处理后,乳化指数变为0,说明蛋白组成部分是该类乳化剂的主要活性组分。
红外分析发现该生物乳化剂在3 423.37 cm-1处的吸收峰为N—H的伸缩振动的强吸收峰;2 925.84 cm-1、1 311.84 cm-1和1 241.88 cm-13处的吸收峰是C—H的伸缩振动峰;1 653.52 cm-1处的吸收峰是C==O的伸缩振动引起的;1 154~1 030 cm-1范围内存在低波数1 039.78 cm-1的强吸收,为O—H的伸缩振动的特征吸收;由红外光谱可以看出(图3),该乳化剂中含有较多的—OH和RCO—NHR基团,这些基团为糖和蛋白的特征官能团。由此进一步推测糖和蛋白质为该乳化剂的主要化学组分。
通过蛋白质电泳图(图4)可以看出,26.0 kDa的蛋白质的条带颜色较亮,说明组成的蛋白中存在含量较多的26.0 kDa的蛋白质。研究最多的生物乳化剂是Emulsan,其主要结构为脂多糖类[14],另一类研究较多的生物乳化剂是Alasan,它是高分子聚糖和蛋白质的复合物,其乳化活性物质也主要是蛋白质,其中45 kDa的外膜蛋白A(OmpA)类似物前体(AlnA)是其乳化能力最强的部分[14-15]。由此推测本文菌株所产乳化剂结构与Alasan更为接近。

图3 生物乳化剂红外光谱图Fig.3 Infrared spectrogram of bioemulsifier that Bacillus tequilensis produced

图4 生物乳化剂蛋白质电泳图Fig.4 Electrophoresis graph of protein from bioemulsifier
2.4 厌氧代谢产气特性
微生物产气是微生物驱油的另一个重要机理,通过产生生物气溶解于原油可以降低原油黏度,同时提高储层压力,从而提高驱油效率。该菌株在厌氧环境下能够产生生物气,气体组分分析发现所产生物气为二氧化碳(表2),而且二氧化碳含量随着硝酸钠质量浓度的升高而升高, 当硝酸钠质量浓度为6 g/L时,二氧化碳产量达到7.3 mmol,说明电子受体提高了微生物的厌氧代谢活性,促进了菌株厌氧代谢产气能力。

表2 菌株厌氧代谢产气量和气体组分分析Tab.2 Anaerobic metabolism gas production of strains and gas components
2.5 挥发性脂肪酸分析
乙酸、丙酸和丁酸等挥发性脂肪酸是微生物厌氧代谢重要的中间代谢产物,通常会作为油藏微生物代谢活跃程度的一个重要指标被监测。该菌株在厌氧代谢过程中也会产生挥发性脂肪酸,随着培养时间的延长其浓度不断提高,但硝酸钠浓度增加,所产挥发性脂肪酸的浓度反而降低,未添加硝酸钠的样品中脂肪酸浓度达到876 mg/L,而添加质量浓度为6 g/L硝酸钠的样品脂肪酸质量浓度仅为277 mg/L(表3)。这主要是由于硝酸钠的添加促进了该菌株厌氧代谢产气,根据物质守恒定律,在总的底物碳源不变的条件下,产气多的样品挥发性脂肪酸的产量就会减少。

表3 硝酸盐对菌株厌氧代谢挥发性脂肪酸影响Tab.3 Effect of nitrate on volatile fatty acids of strains in anaerobic metabolism
2.6 菌株物模驱油效率评价
模拟胜利油田沾3区块油藏条件,开展菌株厌氧激活驱油效率评价(图5)。该菌株在一次水驱含水率达到95%的基础上,采出程度从40.7%提高到46.8%,驱油效果显著,含水率下降显著,由95%下降到87.3%,且产出液中原油存在明显乳化现象。以上结果说明,该菌株在油藏条件下能通过乳化和产气等综合作用提高水驱效率,表现出良好的应用潜力。
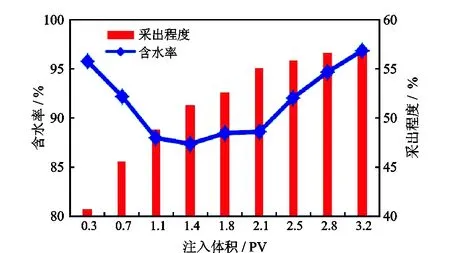
图5 菌株物模驱油过程含水率和采出程度Fig.5 Variation of water cut and recovery percent with injection volume in physical simulation oil recovery of strain
3 结 论
本文研究表明特基拉芽孢杆菌作为兼性菌在好氧和厌氧条件下均可以生长代谢,厌氧条件下该菌株具有乳化、产气和驱油能力,展现出良好的油藏适应性和采油潜力;以硝酸钠作为电子受体的激活剂体系可以显著提高菌株厌氧代谢活性,这为提高外源微生物在油藏厌氧环境的驱油功能提供了理论指导。
