火驱尾气中H2S与O2化学反应热力学研究
2019-02-13梁建军王苏雯王寿喜王勇
梁建军,王苏雯,陈 龙,王寿喜,3,王勇,3
(1.中国石油新疆油田公司 工程技术研究院,新疆 克拉玛依 834000; 2.西安石油大学 石油工程学院,陕西 西安 710065;3.西安石油大学 陕西省油气田特种增产技术重点实验室,陕西 西安 710065)
引 言
火驱尾气是指火驱开采稠油过程中由于油层不断燃烧,从生产井排出的大量以N2和CO2为主的尾气。我国稠油资源丰富,预计总量约为2.26×1010t,但利用程度低。火驱技术被认为是解决该问题的一种有效手段。该技术属于稠油热力开采范围,具有适应性强、能有效改善开发效果等优点,应用前景广阔。到目前为止,在国内不同油田9个区块70个井组开展了先导试验,效果明显[1]。由于火驱技术可以应用于多种油藏类型和不同采油手段,预计后期该技术应用范围将不断扩大,成为稠油油田首选的开发方式。
但是,火驱技术的发展也受到很多约束,主要原因在于火驱机理较为复杂、项目风险高,而且尾气性质不明,尾气处理工艺有待提高。迄今为止,国内外关于火驱尾气的相关研究没有突破性进展,尾气处理技术仍以尾气焚烧、硫回收、CO2捕集、酸气回注等传统工艺为主。其中尾气焚烧技术可应用于采气量较少的火驱开采初期,但由于排放标准等相关政策,应与其他工艺相结合;火驱尾气中如果S含量较高,可考虑采用硫回收工艺提高工艺经济效益;同样,尾气中如有大量的CO2组分,使用CO2捕集系统后再回注于附近油田可提高油田产量;而酸气回注技术可将火驱尾气注回地层,不仅降低了开采尾气对环境的影响,还维持了地层压力,可以作为火驱尾气处理工艺的重点研究方向[2]。但是,以上研究侧重于尾气处理工艺,而从火驱尾气自身出发的处理方案研究还处于起步阶段,尾气组分间是否反应、反应条件等基础问题还没有得到解决,与现场工况变化结合的研究资料更是少之又少。
本文针对新疆油田红浅1井火驱先导试验站尾气,进行了尾气中H2S和O2组分的热力学反应研究。根据实际现场运行压力、温度和组分浓度波动范围,分析火驱尾气中H2S与O2的反应方向,明确关键因素对反应过程的影响,考虑反应边界条件及火驱尾气爆炸极限范围等问题,为火驱开采技术的应用提供充分依据。
1 火驱尾气组分分析
本试验中回注气源为红浅1井火驱先导试验站火驱尾气,目前的产气量为标准状态下6×104m3/d,最大气量14.0×104m3/d。为了减少H2S、CO2等酸性气体排放同时提高稠油采收率,拟开展火驱尾气回注试验,设计的回注气量为标准状态下10×104m3/d,并留有30%~100%的操作弹性。现场回注尾气参数见表1,回注温度、压力变化如图1所示。

表1 火驱尾气组分的摩尔分数Tab.1 Component mole fraction of in-situ combustion exhaust %

图1 回注工艺压力、温度变化曲线Fig.1 Pressure-temperature profile in reinjection of in-situ combustion exhaust
由表1可知,火驱尾气组分复杂,主要由N2、CO2等组分构成,含有少量的酸性物质H2S、烃类及助燃物O2。如图1所示,现场回注工艺条件下,温度变化区间为5~150 ℃,压力从0.5 MPa增压至20 MPa,温度、压力变化显著。因此,考虑H2S与O2的具体热力学反应过程,结合现场数据分析两者反应的H2S最低浓度并进一步分析爆炸可能性,是火驱尾气回注工艺研究的基本要求。
2 H2S与O2反应热力学分析
2.1 反应方向分析


表2 H2S与O2反应的标准焓变和吉布斯自由能Tab.2 Change of standard enthalpy and Gibbs free energy in the reaction of H2S and O2
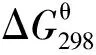

表3 随O2与H2S含量变化执行反应Tab.3 Reactions between them under different ratio of O2 to H2S
由表3可知,在氧气充足时,H2S与O2发生反应Ⅰ,若氧气不足或温度较低时,转变为反应Ⅱ。已知火驱尾气中相应组分摩尔分数比为x(O2) ∶x(H2S)=10∶1,所以H2S与O2在规定温度、压力下反应理论产物主要为SO2和H2O。但是现场回注工艺时温度在5~150 ℃、压力在0.5~20 MPa之间变化,则反应的自发程度、热力学反应过程将随现场工艺条件的变化而变化,需要进一步分析证明。
2.2 不同温度下反应热力学参数计算
在已知H2S与O2的反应方向及反应产物的前提下,进一步对不同温度条件下两者反应热力学过程进行分析。在依据热力学模型推导反应判据表达式的基础上,结合现场温度波动范围,计算吉布斯自由能变(ΔG)与焓变(ΔH)以及平衡常数(K)的变化趋势,研究不同工况下H2S与O2热力学状态,明确反应产物。
根据范特霍夫(Van′t Hoff)等压方程[4]变形可得温度对平衡常数的影响:
(1)

(2)

(3)

(4)
式中:ΔH0为积分常数。将式(4)代入式(1)可得Kθ随温度的变化关系式:
(5)
再将式(5)代入标准平衡常数与吉布斯自由能[7]关系式
(6)

(y=-y')。
(7)

式(4)、式(5)和式(7)即为不同温度条件下H2S与O2化学反应热力学判据计算公式。运用上式求解值可以分析现场温度变化对反应过程的影响,结合图1回注温度数据以10K为区间考察H2S与O2反应热力学过程,结果如图2和图3所示。
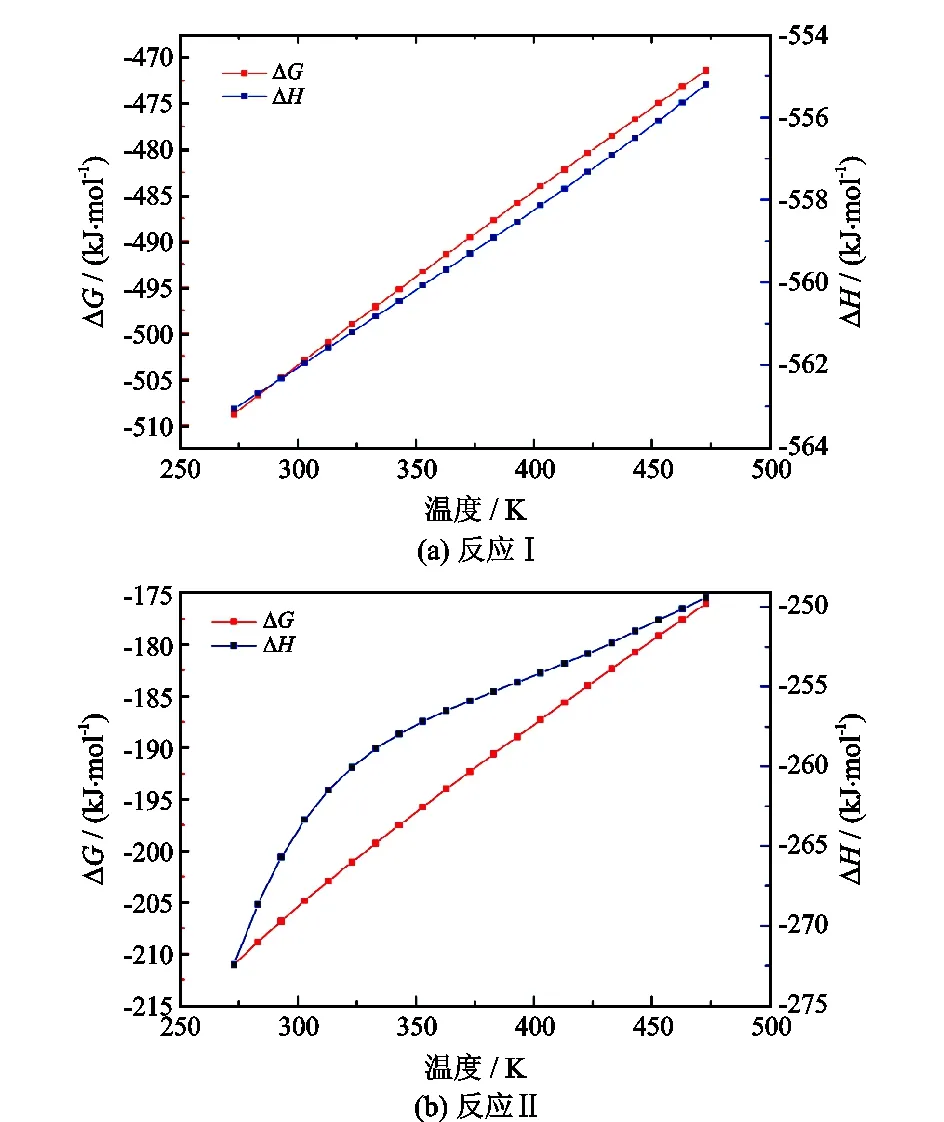
图2 ΔH与ΔG随温度变化趋势图Fig.2 Variation trend of ΔH and ΔG with temperature

图3 反应Ⅰ、Ⅱ平衡常数随温度变化趋势图Fig.3 Variation curves of equilibrium constants of reaction Ⅰ and reaction Ⅱ with temperature
由图2(a)可知,当H2S与O2在发生反应Ⅰ时,ΔG与ΔH在预测温度变化范围内均为负值且随温度增加呈线性增大趋势;由图2(b)可知,当H2S与O2发生反应Ⅱ时,随温度上升ΔG与ΔH变化情况与反应Ⅰ时大致相同,仅在ΔH随温度变化呈非线性变化这一点上有所区别。由此可知,H2S和O2反应自发进行,但随着温度的增加,ΔrGm绝对值变小,反应自发程度逐渐降低。
由图3可知,反应Ⅰ、Ⅱ的平衡常数随温度增加逐渐减小,表明反应进行程度变小,与上述自发程度降低结论一致。此外,由于反应Ⅰ平衡常数整体大于反应Ⅱ,所以反应Ⅰ更易进行,反应产物主要是SO2和H2O。
2.3 火驱尾气H2S与O2反应的最低浓度
通过上述分析,进一步研究反应边界条件,确定发生反应的最低浓度,完善反应体系,为回注过程化学反应分析建立更深层支撑。
通过理想气体状态方程及对平衡常数计算公式变形可知H2S最低反应摩尔分数表达式:
(8)
式中:x1(H2S)、x2(H2S)分别为反应Ⅰ、Ⅱ在不同温度下的H2S最低反应摩尔分数,%;K1、K2分别为反应Ⅰ、Ⅱ在不同温度下的平衡常数;xO2为反应Ⅰ、Ⅱ中与H2S反应的O2摩尔分数,%。通过式(8)实现温度变化范围在273~473 K之间且O2摩尔分数在0.5%~3%波动时对应的H2S反应临界浓度的计算。结果如图4所示。

图4 氧气预测浓度范围内H2S最低浓度变化趋势Fig.4 Variation of critical concentration of H2S in oxygen concentration range
如图4所示,发生反应Ⅰ、Ⅱ时在O2波动范围内H2S最低浓度变化趋势相同,即当温度一定时,H2S反应最低含量均随O2浓度增加略微减小;当O2浓度一定时,H2S反应最低含量随温度上升而增大,计算现场温度变化时与O2反应的H2S临界摩尔分数为2.08×10-19%,而火驱尾气中H2S组分摩尔分数为0.1%,因此尾气中H2S和O2必然会发生反应。
3 H2S与O2爆炸极限分析
3.1 H2S爆炸浓度分析
若H2S和O2反应必然进行,就必须考虑两者反应程度从而判断是否会发生爆炸。已知H2S与空气混合时,爆炸极限对应的气体体积分数为4.3%~45.5%以及大气中氧气体积分数约为21%,可得H2S与O2在常温常压下发生爆炸反应时两者比例:
(9)
通过式(9)计算H2S的爆炸极限对应的H2S与O2的体积比范围应为0.21~3.97。已知现场火驱尾气中H2S与O2的体积比为0.1,理论上可得出二者接触不会发生爆炸反应,但是由于现场温度波动幅度大,可燃气体的爆炸极限范围会随系统温度的升高而变大[8],所以需要进一步分析温度对于其爆炸特性的影响。
爆炸下限随温度变化可根据经验公式[9]
Lt=[1-0.000 721(t-25)]×L25
(10)
计算得到。式中:Lt为t℃时对应的爆炸下限,%;t为指定温度,℃;L25为25 ℃时对应的爆炸下限。
依据式(10)可求解不同温度下H2S爆炸下限数据,如图5所示。

图5 H2S在不同介质中爆炸下限随温度变化趋势Fig.5 Variation of lower limit of H2S explosion concentration with temperature in different media
由图5可知,在现场温度波动范围内,H2S组分的实际体积分数均小于其在空气中及氧气中相应温度下的爆炸下限,因此,H2S与O2在现场工艺条件下不会发生爆炸反应,只发生缓慢的氧化反应。
3.2 火驱尾气整体爆炸分析
关于火驱尾气整体的爆炸反应,除了判断现场H2S浓度是否安全,还需要对O2的临界含量进行探讨。已知可燃性气体体积分数处于爆炸下限时,理论临界含氧量可由化学反应式[10]
(11)
求出。式中:n、m、λ、f分别对应碳、氢、氧、硫元素原子数;L为可燃性气体爆炸下限,可通过经验公式[11]
(12)
计算。其中:Lm为混合气体中可燃部分爆炸上限或者下限;φ1、φ2…φi为混合气体中各组分的体积分数,%;x1、x2…xi为混合气体中各组分的爆炸极限,%。除去火驱尾气中不反应气体N2及CO2,对其余组分归一化后求得火驱尾气中可燃气体部分爆炸区间对应的体积分数为3.98%~15.29%。
计算临界含氧量,首先除去N2、CO2与O2,剩余组分含量做归一化处理,计算相应的可燃气混合物n=1.082,m=1.378,λ=1.386,f=0.005。由式(11)得知爆炸下限对应临界含氧体积分数为2.93%,实际火驱尾气氧气组分体积分数波动范围为0~3%,表明可燃气体与氧气可能发生爆炸反应。但是现场气体中实际存在惰性气体N2,任韶然、李海奎在对惰性及可燃气体对甲烷爆炸影响实验分析[12]中,探究出N2含量增加可以缩小可燃气体爆炸范围,同时临界氧含量上升的结论。尾气中N2体积分数高达78.76%,可认为大大减小了火驱尾气爆炸风险。综合上述分析,该体系下火驱尾气不会发生爆炸反应。
4 结 论
(1)根据化学热力学计算方法,得出在现场回注工艺条件下,火驱尾气中的H2S和O2组分发生反应的产物主要为SO2和H2O。但随着温度升高,反应自发程度逐渐降低。
(2)现场条件下火驱尾气中H2S与O2组分及火驱尾气整体均不会发生爆炸反应。
