脂多糖应答分子LRG参与内毒素预处理诱导脑缺血耐受机制的研究
2019-02-13徐广民
王 瑜,徐广民,曾 思,张 鹏,雷 迁
(四川省医学科学院·四川省人民医院麻醉科,四川 成都 610072)
脑缺血预处理可诱导脑细胞及神经元对持续性缺血的耐受,可能会预防和保护缺血再灌后的脑损伤[1,2]。有研究证实了脑缺血预处理(IPC)诱导耐受现象的器官普遍性[3]。研究发现部分内源性物质,也可以诱导类似脑缺血耐受的发生,例如脂多糖(LPS)预处理可以诱导大鼠脑缺血耐受,显示有部分神经保护作用,但其作用机制尚不清楚[4~6]。2016年9月至2018年9月我院开展研究,探讨脂多糖应答分子LRG参与内毒素预处理诱导的脑缺血耐受的作用机制,为临床治疗脑缺血性疾病提供可行性理论支持。
1 材料与方法
1.1 材料①实验动物:健康8周龄C57雄性小鼠80只,清洁级,体重(22±3)g,购自四川省人民医院实验动物研究所。②实验试剂:MTT、LPS、DMSO(Escherichia coli,O111:B4)均购自于美国Sigma公司;0.25%Trypsin-0.02%EDTA、DMEM/F12、抗生素均购自于赛默飞公司;胎牛血清购自四季青公司;小鼠TNF-α、IL-6、TNF-1β ELISA试剂盒均购自深圳达科为生物技术有限公司。③实验仪器:带针缝合线(中国强生医疗器械有限公司);AL104电子天平(上海民桥精密科学仪器有限公司公司);SZM45体视显微镜(深圳博宇); R4100酶联免疫检测仪(Dynateeh,美国);超声细胞破碎仪(Sonics&Meterials公司);MicroCL 21R 离心机(Thermo Scientific,德国);power PAC 2000电泳仪(Biorad公司)。
1.2 方法
1.2.1小鼠脑皮质原代细胞神经元的分离培养 取新生健康小鼠(<24 h),75%冰乙醇浸泡10 min,在无菌环境下断头处死,快速取出大脑组织,置于冷的D-PBS中。将0.25%胰蛋白酶加入到彻底剪碎的脑组织中充分消化后,用DMEM-F12(含10%FBS)培养制成单细胞悬液。再将其接种在培养瓶中(密度1×106个/ml),并置于培养箱中培养。4 h后,将种植液换成神经元基础培养基,继续维持培养,隔3天以半量神经元基础培养基换液(实验方法参照文献[7])。
1.2.2LPS预处理后检测神经元细胞中LRG分子的蛋白水平 分离出纯化的神经元细胞,在6孔板上以1×106/孔的密度做细胞培养,并分为control组、LPS直接刺激组、LPS预刺激组。其中预刺激组先用0.01 μg/ml脂多糖预刺激18 h,然后用1 μg/ml脂多糖再刺激6、24、48 h。将RIPA裂解液加入收集细胞,4 ℃裂解30分钟,12000 ×g 4 ℃离心,上清即为蛋白液。BCA试剂盒测样品蛋白浓度,调浓度均一化。上样同等量蛋白样电泳,80 v恒压电泳2 h后,进行电转膜,17 V恒压转膜30 分钟,封闭液封闭4 h,后加入特异性脂多糖应答分子一抗,4 ℃孵育过夜,1×TBST洗3次,每次5分钟,然后加入对应的二抗,重复上述的孵育和清洗过程,洗去未结合的二抗,最后X射线胶片曝光分析,利用Image J软件分析灰度值。
1.2.3体外神经元缺血再灌注模型的建立 将LRG表达下降的神经元细胞,野生型神经元细胞放入密闭恒温装置,细胞培养液换为不含糖的人工脑脊液(NaCl 123 mmol/L,KCl 3.75 mmol/L,KH2PO41.25 mmol/L,NaHCO326 mmol/L,MgCl21 mmol/L,CaCl22 mmol/L,pH 7.4)。温度为(30±2)℃,混合气体组成为5%CO2、94%N2和1% O2,10 min后培养液更换为有10 mmol/L葡萄糖的人工脑脊液,将细胞置于培养箱中,于37 ℃培养1小时构建出缺血再灌注模型。
1.2.4神经元细胞细胞活性的检测 取96孔板,将3组细胞接种于板子上(密度8×103),每孔100 μl。均设置3个复孔,每个孔再加入20 μl MTT溶液(5 g/L MTT溶于PBS中),37 ℃孵育4 h(避光),丢弃上清,每个孔再加入100 μl DMSO,振荡10 min,待蓝紫色结晶充分溶解后,用酶标仪在490 nm波长处测定其吸光度,以检测各组神经元的活细胞数量。
1.2.5检测LPS预处理后小鼠脑缺血再灌注模型中LRG的变化 ①小鼠脑缺血再灌注模型的建立:随机数字表法将30只C57雄性小鼠分为3组,LPS预处理+脑缺血再灌注(MCAO)模型组10只小鼠,建立模型前3天,腹腔注射200 μl 0.2 mg/kg LPS(E.coli 0111:B4,L-2630,Sigma);脑缺血再灌注(MCAO)模型组10只小鼠,注射200 μl无菌生理盐水;上述两组小鼠,均术前12 h禁食,采用大脑中动脉线栓法(MCAO)[7],小鼠大脑中动脉缺血1 h后,恢复血流,建立再灌注24 h模型。假手术对照组10只小鼠,术前12 h禁食,仅分离颈总动脉,不做缺血处理,其余操作均同手术组。②Western Blot检测脑组织中LRG蛋白水平的变化:再灌后24 h,麻醉小鼠,取小鼠大脑组织用PBS(pH 7.4)灌流,清洗干净后,充分剪碎并加入裂解液裂解1 h,组织匀浆后12000×g 4 ℃,再离心10分钟,上清即为蛋白液。BCA蛋白定量试剂盒测定LRG蛋白浓度,统一浓度为5 μg/μl。上样同等量蛋白样品电泳,80 V恒压电泳2 h后,进行电转膜,17 V恒压转膜30分钟,封闭液封闭2-4小时,后加入特异性脂多糖应答分子一抗,4 ℃孵育过夜,1×TBST洗3 次,每次5分钟,然后加入对应的二抗,重复上述的孵育和清洗过程,洗去未结合的二抗,最后X射线胶片曝光分析,利用Image J软件分析灰度值。
1.2.6检测LRG基因沉默型小鼠脑缺血再灌注损伤 ①尾静脉注射LRG RNAi慢病毒载体,构建针对LRG基因沉默型小鼠8只,野生型C57雄性小鼠8只,采用前述方法建立MCAO模型。假手术组C57雄性小鼠8只,不做缺血处理。②神经功能评分。手术完毕,待小鼠自然苏醒后,重新放回鼠笼,给予自由饮食。达到24小时后,根据Garcia评分法[8]评价并记录分数。③Western Blot检测脑组织中LRG蛋白水平的变化。采用1.2.5中的方法,检测各组之间神经系统中脑组织脂多糖应答分子的蛋白表达水平。④ELISA试剂盒检测血清中炎性因子IL-1β,IL-6,TNF-α的水平。再灌注24 h后,摘眼球取血于1.5 ml EP管中。室温静置2 h后,3000 rpm,4 ℃离心10分钟,上清液即为血清,转移到1.5 mL离心管中备用。采用ELISA试剂依次检测血清中IL-6,IL-1β,TNF-α的含量。
1.3 统计学方法采用SPSS 22.0软件处理数据。计量资料以均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析及q检验。P< 0.05为差异有统计学意义。
2 结果
2.1 LPS预处理后不同时间点刺激神经元表达LRG的水平Western Blot检测各组神经元表达LRG的水平,结果显示,与control组比较,LPS直接刺激组神经元细胞表达LRG水平显著增加(P< 0.05);与LPS直接刺激组比较,LPS预处理组LRG表达水平下调(P< 0.05)。LPS预处理后再刺激6、24、48 h神经元表达LRG水平均降低(P< 0.05),但随着时间的增加,LRG表达水平增加,呈时间依赖性,见图1。

图1 LPS预处理后对神经元细胞表达LRG的蛋白水平
2.2 LRG表达下降型神经元在体外缺血再灌模型中的细胞活力利用MTT法检测不同组在体外缺血再灌后神经细胞活性发生的变化。结果表明,与假手术对照组(101.6±3.7)比较,神经元细胞在脑缺血再灌注(MCAO)模型组(39.7±6.4)中,细胞活力下降(P< 0.01)。与脑缺血再灌注(MCAO)模型组比较,LRS预处理+脑缺血再灌注(MCAO)模型组(53.3±4.2%)中神经元细胞活力较好,差异有统计学意义(P< 0.05)。
2.3 LPS预处理小鼠脑缺血再灌注模型中LRG的表达水平Western Blot检测小鼠脑缺血再灌模型组脑组织的LRG蛋白表达水平。与假手术对照组比较,MCAO模型组LRG蛋白表达水平显著增加(P< 0.05)。与MCAO模型组比较,LPS预处理+MCAO模型组LRG蛋白表达水平下调(P<0.05)。见图2。
2.4 LRG基因沉默型小鼠神经功能的影响脑缺血再灌注24 h后,假手术组中行为学结果显示,神经功能评分0分,没有神经功能缺损症状。MCAO模型组中小鼠神经功能缺损(2.89±0.39),行为异常,差异显著(P< 0.01)。与MCAO模型组比较,LRG基因沉默型小鼠+MCAO模型组小鼠神经功能评分较低(1.77±0.61),差异有统计学意义(P< 0.05)。
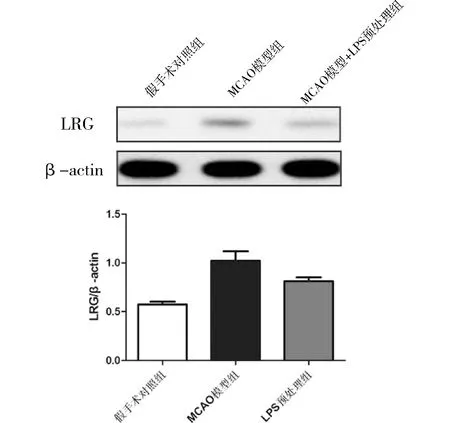
图2 不同组中脑组织表达LRG的水平
2.5 LRG基因沉默型对脑缺血再灌模型小鼠中LRG蛋白水平的影响脑缺血再灌注24 h后,Western Blot检测脑组织中LRG的表达水平。结果显示,与假手术对照组比较,MCAO模型组中LRG表达水平显著上调。与MCAO模型组比较,LRG基因沉默型小鼠模型组LRG表达水平下调,差异有统计学意义(P<0.05)。见图3。
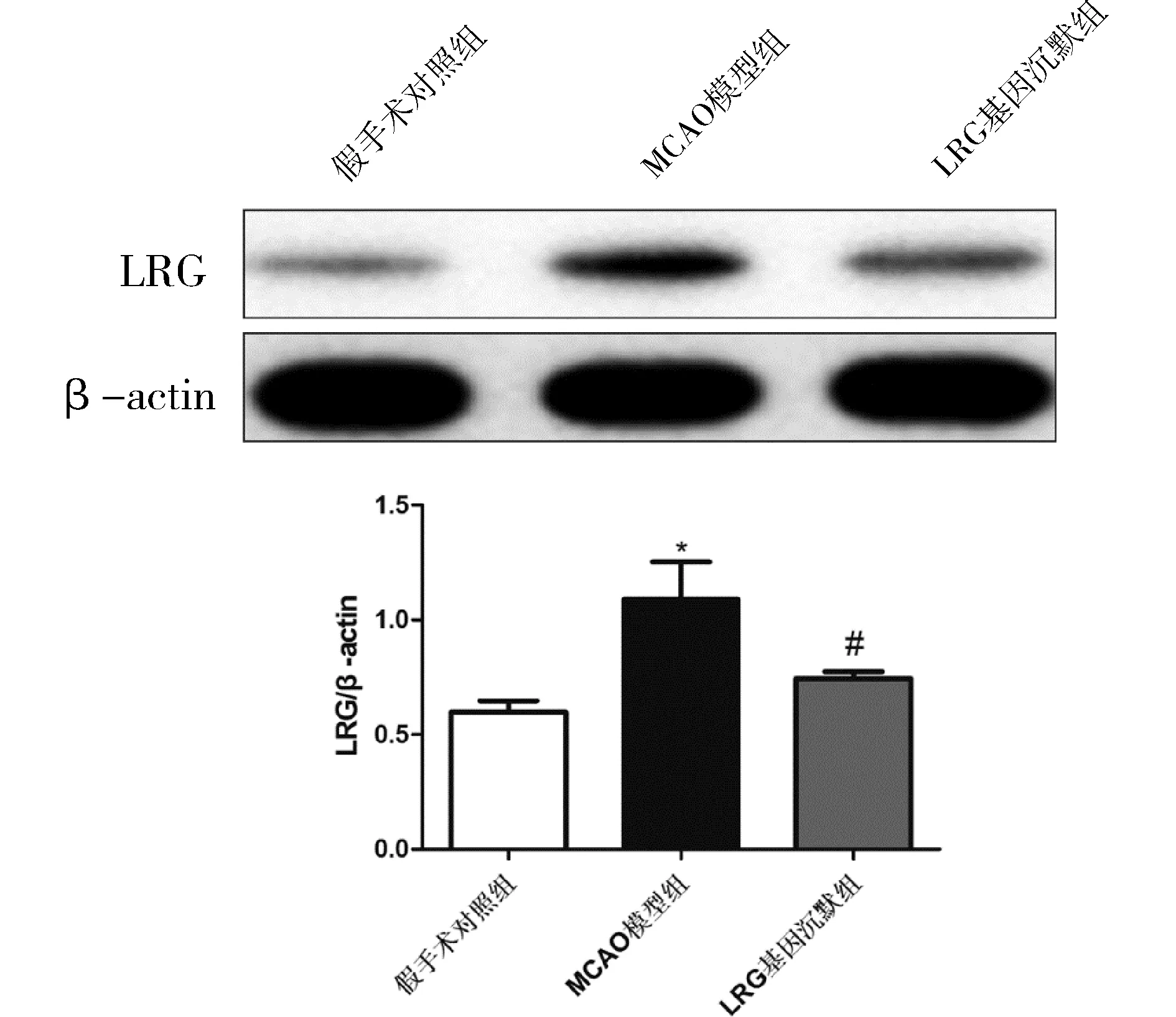
图3 不同组中脑组织表达LRG的水平比较
2.6 LRG基因沉默型小鼠脑缺血再灌组血清中其炎性因子IL-1β,TNF-α和IL-6变化利用ELSIA试剂盒检测血清中其炎性因子IL-1β,TNF-α和IL-6的含量。结果显示,与假手术对照组作比较,MCAO模型组中IL-1β、TNF-α、IL-6均显著增加(P<0.05)。与MCAO模型组比较,LRG基因沉默型+MCAO模型组中IL-1β、TNF-α、IL-6均显著下调(P<0.05)。见表1。

表1 LRG基因沉默型小鼠脑缺血再灌注后血清IL-1β,TNF-α和IL-6的变化
*与假手术对照组比较,P< 0.01;与MCAO模型组比较,#P< 0.05,##P< 0.01
3 讨论
脑缺血再灌注损伤是一类脑血流供应受阻,缺血所致脑组织缺血缺氧引起的脑组织损伤引发的神经元凋亡及炎症反应,最终影响机体神经功能的一类复杂脑血管性疾病。脑缺血再灌注是脑受损,神经功能缺失的主要原因。脑缺血/再灌注损伤的发生率、死亡率呈上升趋势,形势不容乐观。非缺血性预处理是当前研究热点之一,内毒素LPS预处理对脑缺血损伤耐受的交叉诱导和保护作用具有较好疗效,但确切机制的研究没有突破性进展,同时LPS预处理存在毒性和副作用,在临床上应用存在困难[9,10]。
脑缺血再灌注过程中伴随有炎症反应的发生,炎症级联反应的发生是神经元功能性损伤的关键原因。再灌注发生时,脑血管内皮破损,氧自由基爆发,加重氧化应激的反应,激活炎症细胞,促使大量炎性因子释放入血[11~13]。其中炎性因子TNF-α能够激活中性粒细胞,使之与白细胞粘附,募集,促进白细胞分泌大量粘附分子,加速炎症反应的发生,导致脑组织持续损伤。IL-1β的爆发性释放可以使内皮细胞激活,表达分泌粘附分子ICAM-1等,进一步募集大量炎症细胞到缺血组织区,加重脑组织缺血损伤[14,15]。
作为炎症反应发生的重要分子LPS,其在脑组织缺血再灌注中刺激炎症反应发生的作用机制尚不明确。LPS预处理可以调节炎症反应,增强机体缺血耐受。既然LPS预处理在临床上不易实现,本研究探讨了脂多糖应答分子LRG在脑缺血再灌中的作用机制。结果显示,LRG基因沉默在脑缺血发生时,LRG表达下调,可以减缓脑缺血再灌损伤。同时血清中炎性因子含量减少,炎症反应减少,表明LRG基因沉默可以调节炎症反应,增强机体脑缺血耐受,保护脑组织。但是LRG调节炎症反应的作用机制通路仍有待深入研究,只有完全明确LRG在调节炎症反应,增强缺血耐受发挥脑保护作用,才能在临床上探索替代LPS预处理的治疗脑缺血再灌注的策略。
