超高效液相色谱串联质谱测定蔬菜中23种植物生长调节剂残留
2019-02-13张维一高晴盈谢拾冰梁秀美
张维一,张 井,高晴盈,谢拾冰,王 亮,梁秀美
(温州市农业科学研究院,农业部农产品质量安全风险评估实验站,浙江温州 325006)
植物生长调节剂是一类具有植物激素活性,可影响植物生长发育的小分子化合物。这类化合物在增强植物抗逆性、促进植物细胞分裂与生长、提高产量以及改善品质等方面具有重要的作用,因而作为高产优质高效农业的一项重要技术措施,已在国内外得到广泛应用[1-6]。
但在植物生长调节剂残留的检测方法上,蔬菜中检测标准覆盖面不全,相关文献报道较少, 而一些检测响应较为理想的方法又存在费用高、处理复杂的问题。国内外农药残留的检测技术主要有酶联免疫法(ELISA) 、气相色谱法(GC) 、气相色谱一质谱法(GC-MS) 、高效液相色谱法(HPLC)、液相色谱串联质谱法(LC-MS)和离子色谱法(IC) 等[5-10]。其中串联质谱因其优异的定性与定量性能越来越得到广泛应用。而在蔬菜中农药残留前处理方法上,近年来QuEChERS方法因其简单、快速而得到广泛应用。目前,国内外虽然已有一些采用QuEChERS方法和液相串联质谱测定植物生长调节剂残留的报道[1-6,11],但是对于同时测定多种性质差异较大的植物生长调节剂的通用方法报道较少。本研究以液相串联质谱技术为基础,通过优化QuEChERS方法以及仪器条件,为同时测定多种性质不同的植物生长调节剂提供相应的简单、快速、可靠、灵敏的检测方法。
1 材料与方法
1.1 仪器与试剂
XEVO TQS超高效液相色谱质谱联用仪购自美国WATERS公司,Milli-Q Direct 8 超纯水仪购自美国Millipore公司,SK3300HP超声波清洗器购自上海科导超声仪器有限公司,MS7610-33 漩涡振荡器购自美国Thermo Fisher公司, TG16-WS离心机购自上海卢湘仪离心机仪器有限公司,ROTINA 380离心机购自德国海蒂诗公司,分散匀浆机购自德国IKA集团,AR1502CN电子天平购自奥豪斯仪器有限公司,氮吹仪购自美国Organomation公司。
溶液农药标准品购自农业部环境保护科研监测所, 固体农药标准品购自德国Dr.Ehrenstorfer公司,C18购自德国CNW公司,弗罗里硅土购自美国WZ.der.Floridin公司,石墨化炭黑购自德国CNW公司,545硅藻土购自德国CNW公司,60~200 μm超纯硅胶购自加拿大SILICYCLE公司,酸性氧化铝购自德国CNW公司,碱性氧化铝购自德国CNW公司,PSA购自德国CNW公司,无水硫酸镁(分析纯)购自西陇化工股份有限公司,乙腈(色谱纯)购自德国默克公司,甲醇(色谱纯)购自德国默克公司,甲酸(色谱纯)购自德国默克公司, 0.22 μm滤膜购自上海安谱实验科技股份有限公司,实验室用水为超纯水。
1.2 样品前处理方法
准确称取10.0 g样品于离心管中,加入2.5 g无水硫酸镁,加入φ=1%甲酸-乙腈 10.0 mL,涡旋1 min后6 000 r·min-1离心5 min。取1.0 mL上清液于1.5 mL离心管,加入100 mg 无水硫酸镁、20 mg硅藻土、50 mg C18,涡旋30 s后10 000 r·min-1离心10 min,0.22 μm滤膜过滤,待LC-MS/MS测定。
1.3 液相串联质谱条件
超高效液相色谱条件:色谱柱使用HSS T3柱(2.1 mm×100 mm,1.8 μm; 美国WATERS公司); 流动相A为φ=0.1%甲酸-乙腈溶液,流动相B为φ=0.1%甲酸-水溶液(内含0.1 g·L-1甲酸铵); 梯度洗脱程序为:0~1 min,5% A;1~2 min,10% A;2~3 min,50% A;3~4 min,90% A;4~5 min,90% A;5~8 min,5% A。流速为0.4 mL·min-1,柱温40 ℃,样品进样量5 μL。
质谱条件:电喷雾离子源(ESI),正负离子切换扫描;脱溶剂气流 800 L·h-1脱溶剂温度为300 ℃,锥孔气流为150 ℃,鞘气压力(氮气)为7.0 Bar;正离子扫描下毛细管电压3.90 kV,锥孔电压25 V;负离子扫描下毛细管电压1.50 kV,锥孔电压25 V;数据采集采用多反应监测模式(MRM)。
2 结果与分析
2.1 样品前处理方法的优化
2.1.1 提 取 选择常见蔬菜大白菜为试验对象,通过添加回收试验,考察不同试剂的提取效果。具体过程如下:称取10 g匀浆样品3份,添加植物生长调节剂标物,30 min后加入提取试剂,涡漩1 min,6 000 r·min-1离心5 min,取上清,0.22 μm滤膜过滤,液质检测,通过计算23种植物生长调节剂的回收率来考察提取效果。首先考察甲醇、乙腈、乙酸乙酯、水、φ=50%的甲醇水溶液、φ=50%的乙腈水溶液6种试剂的提取能力,具体结果见表1前半部分。试验结果显示,水的存在会造成部分疏水性较强的植物生长调节剂回收率极低。进一步选取甲醇乙腈两种有机溶剂进行考察[12-14],并加入2.5 g无水硫酸镁去除蔬菜中水分,同时考察加入甲酸对于提取效率的影响,结果见表1后半部分。试验表明,去除水分能明显改善有机溶剂对目标物的总体提取效果,而乙腈提取的最低回收优于甲醇,因此选择乙腈作为提取溶剂;且乙腈中加与不加甲酸对结果影响极小,酸性环境下不会降低回收,考虑到样品本身的复杂性(不局限于大白菜)可能会对回收造成影响,选择加入甲酸适用性会更广,因此确定提取试剂为φ=1%甲酸-乙腈,并加入2.5 g无水硫酸镁。

表1 不同提取剂对23种植物生长调节剂总体回收情况Table 1 Recovery of 23 plant growth regulators with different extraction solvents
2.1.2 净化 考察C18、PSA、GCB等常见的固相萃取柱填料对于待测目标物含量的影响。过程如下:取3份待净化大白菜提取液,添加植物生长调节剂标物,加入100 mg无水硫酸镁,加入净化剂涡旋30 s,10 000 r·min-1离心10 min,取上清液,0.22 μm滤膜过滤,液质检测,计算23种植物生长调节剂的回收率来考察净化剂对目标物的吸附情况(表2)。8种净化剂(20 mg)对目标物回收率的中位数较理想,但除C18和硅藻土外,其他净化剂均存在对少数几种植物生长调节剂吸附较强导致最低回收率偏低的情况。进一步考查C18和硅藻土的组合使用量对目标物的吸附情况,分别对20 mg、50 mg的C18、硅藻土以及相应的组合进行添加回收试验。结果(表2)表明:除50 mg C18+50 mg 硅藻土的净化剂组合的最低回收小于80%外,其余净化方案对回收影响均可以接受,且回收情况差异不大;因此选择50 mg C18+20 mg 硅藻土作为净化剂。
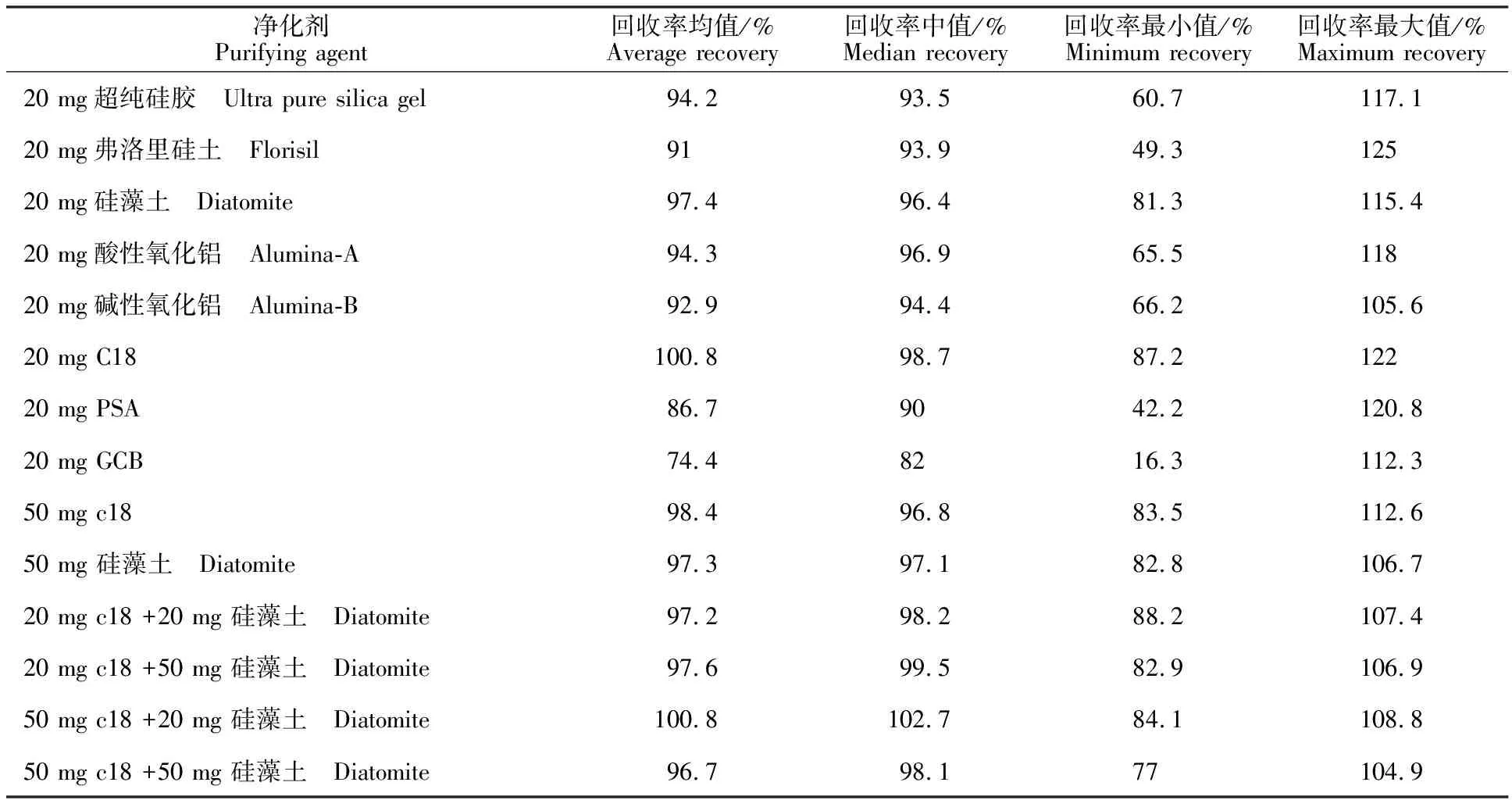
表2 不同净化剂净化后的植物生长调节剂总体回收情况Table 2 Recovery of 23 plant growth regulators with different purifying agents
2.2 仪器条件的优化
2.2.1 液相色谱条件 比较3种色谱柱C18柱、T 3柱和Hillc柱(美国Thermo Fisher公司)对23种植物生长调节剂的保留情况。结果显示,C18柱对于部分极性较强的植物生长调节剂保留不理想,Hillc柱对于多数非极性植物生长调节剂保留能力差,T 3柱对于这23种不同性质的植物生长调节剂均有较好的保留,因此选用T 3柱。在此基础上,比较流动相有机相甲醇与乙腈对于分离的影响,发现选用乙腈作为流动相整体分离效果略好。进一步比较流动相加不加酸对于质谱端响应的影响,发现加酸能显著增强部分采用ESI+模式扫描的植物生长调节剂响应,且并未对ESI-模式扫描的这部分植物生长调节剂造成大的响应减值;因此流动相有机相确定为φ=0.1%甲酸-乙腈溶液,水相为φ=0.1%甲酸-水溶液(内含0.1 g·L-1甲酸铵)。
2.2.2 质谱条件 优化锥孔气流、毛细管电压等仪器条件设置、筛选高响应特异离子对等质谱条件,采用正负离子切换扫描多反应监测的方式一针进样完成对所有目标植物生长调节剂的检测。具体结果见表3。
2.3 方法评价
2.3.1 线性范围、检出限、定量限 空白样品中添加一系列浓度的标准物质,每个质量浓度6次重复,计算线性范围,并以目标物质量浓度为纵坐标(y,单位为 μg·L-1),质谱定量离子的峰面积为横坐标(x)来绘制标准曲线,具体结果见表4。试验结果表明,各目标物线性关系良好,线性范围较宽。
根据信噪比(S/N=3)确定方法检出限,根据信噪比(S/N=10)以及线性范围确定方法定量限(表4)。试验结果表明,检出限范围为0.007 1~4.3 μg·kg-1,定量限范围为0.024~14 μg·kg-1,多数植物生长调节剂检出限和定量限在1.0 μg·kg-1以下,该方法对23种植物生长调节剂的检测灵敏度较高。

表3 23种植物生长调节剂的质谱参数Table 3 Mass spectrometric conditions for 23 kinds of plant growth regulators
2.3.2 基质效应 采用相对响应值法对此进行评价(基质效应=空白基质标准响应值/纯溶剂标准响应值),基质效应大于1为基质增强效应,反之则为基质抑制效应[15];对41种蔬菜进行基质效应评价,试验结果表明,23种植物生长调节剂在这41种蔬菜中平均基质效应为0.49,其中92%的情况为基质抑制,基质效益为0.007 5~2.0,基质效应对这一系列植物生长调节剂的质谱响应影响较大,因此必须通过使用基质配置标准溶液或添加同位素内标的方式来消除基质效应影响。
2.3.3 方法的准确度与精密度 对大白菜等蔬菜样品进行低质量浓度加标回收试验以考察方法的准确度,同时计算6次重复的相对标准偏差来考察该方法在目标物低质量浓度条件下的精密度,具体结果见表5。
试验结果表明,在10倍定量限的加标水平下,23种植物生长调节剂平均回收率为73.1%~121.3%,在70%~130%内,且大部分平均回收率为80%~100%,总体情况良好,准确度符合试验要求。相对标准偏差多数小于5%,方法精密度较为理想;但甲哌啶等4种植物生长调节剂相对相对标准偏差大于10%,虽符合15%的试验基本要求,也提示这几种植物生长调节剂在试验过程中可能存在结果不稳定的情况。

表4 23种植物生长调节剂的标准曲线、相关系数、检出限和定量限Table 4 Linearity,LOD and LOQ of 23 plant growth regulators

表5 23种植物生长调节剂的加标平均回收率及相对标准偏差Table 5 Average recovery and relative standard deviation of 23 plant growth regulators
2.4 实际样品分析
使用本研究的试验方法对市场和基地抽检的15个芹菜、25个丝瓜、30个茭白共计70个样品进行检测验证。总体上,脱落酸的检出率为40%,在3种蔬菜中检出率均极高,但质量浓度较低,几乎都在10 μg·kg-1以下,考虑来源为蔬菜内源激素。其中芹菜中检出较高的有矮壮素(13.3%)和赤霉素(6.7%),丝瓜中检出较高的为氯吡脲(32%)和5-硝基愈创木酚钠(16%),茭白中检出较高的主要有矮壮素(36.67%),检出的农药类型及含量情况基本与这几种蔬菜的生产用药情况相符,说明该方法准确可靠。
3 结论与讨论
选取性质相差较大的23种植物生长调节剂为目标,通过优化QuEChERS提取及净化方法,得到对这23种植物生长调节剂进行同时提取较为合适的前处理方法,但具体到单个植物生长调节剂并非最佳方法,而是一种通用性较好的前处理方式;同时在净化上对一些QuEChERS不常用的材料进行尝试,找到一组较为理想的净化试剂组合;通过对色谱柱、流动相等液相端及离子对等质谱端条件的优化,进一步使该方法能同时满足一次性检测性质相差较大目标物。此外,通过基质加标回收等方法验证得到令人满意的方法评价参数。相对于传统方法,本方法简单、快速、有效,能够同时测定蔬菜中性质相差较大的23种植物生长调节剂,极大节约分析时间和成本。
