大花杓兰根际与非根际土壤真菌多样性的高通量测序分析
2019-02-13付亚娟张江丽侯晓强
付亚娟,张江丽,侯晓强
(1.廊坊师范学院 生命科学学院,河北廊坊 065000;2.河北省高校食药用菌应用技术研发中心,河北廊坊 065000)
大花杓兰(CypripediummacranthumSw.)为兰科杓兰属,是兼具观赏价值和药用价值的多年生草本植物[1]。近年来,商业性过度采挖及生存环境的破坏,大花杓兰野生种群快速缩小,已被列为国家Ⅰ级濒危保护植物。大花杓兰也是典型菌根真菌植物,其种子萌发、植株生长发育都与菌根真菌密切相关[2],但关于大花杓兰菌根真菌的研究报道较少。张毓等[3]从野生大花杓兰须根中分离到1株瘤菌根属(Epulorhiza)真菌,并证实该真菌对大花杓兰种子萌发有促进作用。Shimura等[4]对从大花杓兰成株、幼苗及原球茎分离的瘤菌根真菌进行促萌发试验,发现来自成株的菌根真菌较幼苗及原球茎,具有更高的促萌发率。张亚平[5]研究发现,鸡油菌目(Cantharellales)真菌能显著地促进大花杓兰原球茎的生长和发育。目前,由于大花杓兰菌根真菌在实验室培养条件下不易分离培养、加上大花杓兰组培技术瓶颈尚未完全突破,很大程度上制约了大花杓兰的保育进程。
根际土壤真菌是土壤-植物生态系统的重要组成部分,真菌群落的组成及丰度与植物生长发育、土传病害的发生发展密切相关[6]。因而植物根际土壤真菌群落多样性及生态功能已成为微生物分子生态学研究的热点。相对于传统培养方法,克隆文库技术可以避免非培养微生物所带来的误差,但仍有一定的局限性,它仅能反映出样品中少数优势菌群信息。近年来,随着测序技术的迅猛发展,高通量测序技术能够对环境微生物进行高覆盖率、高深度测序,深入挖掘样本中的信息。最新研究表明,兰科菌根真菌主要分布在宿主植物成株周围土壤,且菌根真菌相对丰度随距兰科植物地理距离增加而递减[7-8]。大花杓兰作为兰科濒危药用植物,其根际土壤真菌多样性的研究目前尚未见报道。因此,本研究采用Illumina Miseq高通量测序技术,对大花杓兰根际、非根际土壤真菌群落组成的多态性进行对比分析,旨在为将来分离筛选大花杓兰共生菌根真菌及开展大花杓兰保育研究提供理论依据。
1 材料与方法
1.1 样品采集
土壤样品于2016年6月采自北京百花山国家级自然保护区(东经115°25′~115°42′,北纬39°48′~40°05′)海拔约1 700 m的高山草甸。该地属于温带大陆性季风气候,全年平均气温在6~7 ℃,最热月是7月份,平均温度22 ℃;最冷月是1月份,平均温度-5.7 ℃。年降水量在450~720 mm,全年降水量的74%多集中在6、7、8三个月。
本研究采集的大花杓兰根际与非根际土壤样本为亚高山草甸土,土壤pH 6.8,主要植被为大花杓兰、手参、铃兰、藜芦及各种野生花卉等。大花杓兰为国家Ⅰ级濒危保护植物,主要分布于百花山草甸,其总数目约100余株,多数以2~5株成丛分布,少数为单株,极少数为5~10株丛生。大花杓兰具1花,花色为紫色,花期6~7月,果期8~9月。基于对大花杓兰的保护,本研究将采自大花杓兰须根系表面0~1 cm范围内5~15 cm土层的土壤视为根际土壤,而非根际土壤样品为距离大花杓兰须根系表面5~10 cm范围内5~15 cm土层的土壤。随机选取3个样点,多点采集的根际土和非根际土充分混合后,置于无菌自封袋中,命名为XF1(根际土)和XF2(非根际土)。当天将土壤样本带回实验室,过2 mm筛后,置于-80 ℃冰箱中保存,备用。
1.2 土壤宏基因组DNA的提取
采用土壤DNA提取试剂盒(FastDNA SPIN Kit for Soil,USA)分离土壤总DNA,其操作按照试剂盒说明书进行。采用7 g/L琼脂糖凝胶电泳对土壤DNA的完整性进行检测,Nanodrop 2000对DNA的浓度及纯度进行检测。
1.3 土壤真菌ITS序列的PCR扩增
采用真菌通用引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)对根际与非根际土壤真菌核糖体基因ITS1-ITS2间隔区进行PCR扩增。PCR反应体系(50 μL):土壤基因组DNA 2 μL,引物对ITS1F和ITS2R(10 μmol/L)各1.5 μL,Q5 High-Fidelity DNA Polymerase 1 μL,High GC Enhancer 10 μL,5X Q5 Reaction Buffer 10 μL,dNTPs(10 mmol/L)1 μL,无菌ddH2O补足至50 μL。PCR扩增程序如下:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃最后延伸7 min。每个样品做3次重复PCR,18 g/L琼脂糖凝胶电泳检测后,将同一样品3次PCR产物进行混合并通过磁珠法DNA凝胶回收试剂盒(上海生工)对目标条带进行割胶回收。纯化后的PCR产物送北京百迈克生物科技有限公司进行Illumina Miseq高通量测序。
1.4 优质序列的获取
采用FLASH软件[9]对原始测序数据进行拼接,而后用Trimmomatic软件[10]对拼接序列进行质量过滤,最后使用UCHIME[11]程序去除嵌合体序列。
1.5 数据分析
采用UCLUST[12]德尔方法,在相似性≥97%的水平上对优质序列进行操作分类单元(operation taxonomic units,OTUs)聚类分析,并过滤OTUs(0.005%作为阈值),筛选出OTUs的代表性序列;基于UNITE数据库,对OTUs代表序列进行物种注释分析(置信度阈值为0.8),获得每个OTU的分类学信息并构建稀释性曲线。利用QIIME软件[13]计算Alpha多样性指数,包括丰富度指数Chao1、多样性指数Shannon、Simpson指数和ACE指数。利用R语言绘制大花杓兰根际与非根际土壤真菌OTU-Venn图。
2 结果与分析
2.1 测序结果质量分析
通过对大花杓兰根际与非根际2个土壤样品进行高通量测序,共获得179 996对Reads,双端Reads拼接及过滤后得到111 874条Clean tags,其中大花杓兰根际土壤63 780条Clean tags,非根际土壤48 094条Clean tags。基于≥97%的相似度水平,通过聚类共获得1 223个用于物种分类的OTUs,根际和非根际土壤真菌OTUs数量分别为1 004和945。稀释性曲线(Rarefaction curve)可以用来说明样本的测序数据量是否合理,也可以用来比较测序数据量不同的样本中物种的丰富度。大花杓兰根际与非根际土壤真菌群落稀释性曲线如图1所示,测序数据量达到20 000时,两样本真菌OTUs数量均趋向平坦,表明样本的测序深度基本合理,能够比较真实、全面地反映自然条件下土壤样本真菌群落结构的组成。
2.2 根际与非根际土壤样本中真菌多样性及相关性分析
Alpha多样性是指一个特定区域或生态系统内的多样性。多样性指数是反映丰富度和均匀度的综合指标。两土壤样本的群落丰富度指数Chao1、ACE和群落多样性的指数Shannon和Simpson见表1。如表1所示,Chao1和ACE指数在大花杓兰根际土壤中的平均值分别为1 036.00和1 024.04,而非根际土壤样本中的平均值分别为972.72和957.07,说明根际土壤中真菌群落的丰富度较高。根际土壤样本的Shannon指数(5.27)高于非根际土壤Shannon指数(4.82),而根际土壤样本Simpson指数(0.023)低于非根际土壤(0.042),说明根际土壤真菌群落多样性高于非根际土壤。因此,综合OTU数量及α多样性指数结果,发现大花杓兰根际土壤真菌群落在丰富度和多样性上均高于其非根际土壤。另外,OTUs-Venn图可以直观反映样本间相同和各自独特的OTUs。大花杓兰根际土壤(XF1)与非根际土壤(XF2)真菌OTUs-Venn图如图2所示,2个土壤样本XF1和XF2共获得1 223个OTU,它们之间共有的OTU数量为726,XF1特有OTU数量为278,XF2特有OTU数量219。因此,综合α多样性指数及OTUs-Venn图,发现大花杓兰根际与非根际土壤真菌组成均较为丰富,但它们在真菌组成、结构及相对丰度上存在一定的差异。
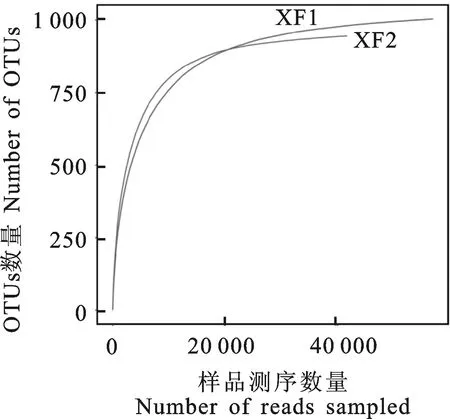
XF1.大花杓兰根际土壤样本 XF1 represents rhizospheric soil sample ofC.macranthum;XF2.大花杓兰非根际土壤样本 XF2 represents non-rhizospheric soil sample ofC.macranthum

图1 根际与非根际土壤样品稀释曲线(相似度水平为97%)Fig.1 Rarefaction curves of rhizospheric and non-rhizospheric soil samples at cutoff level of 3%
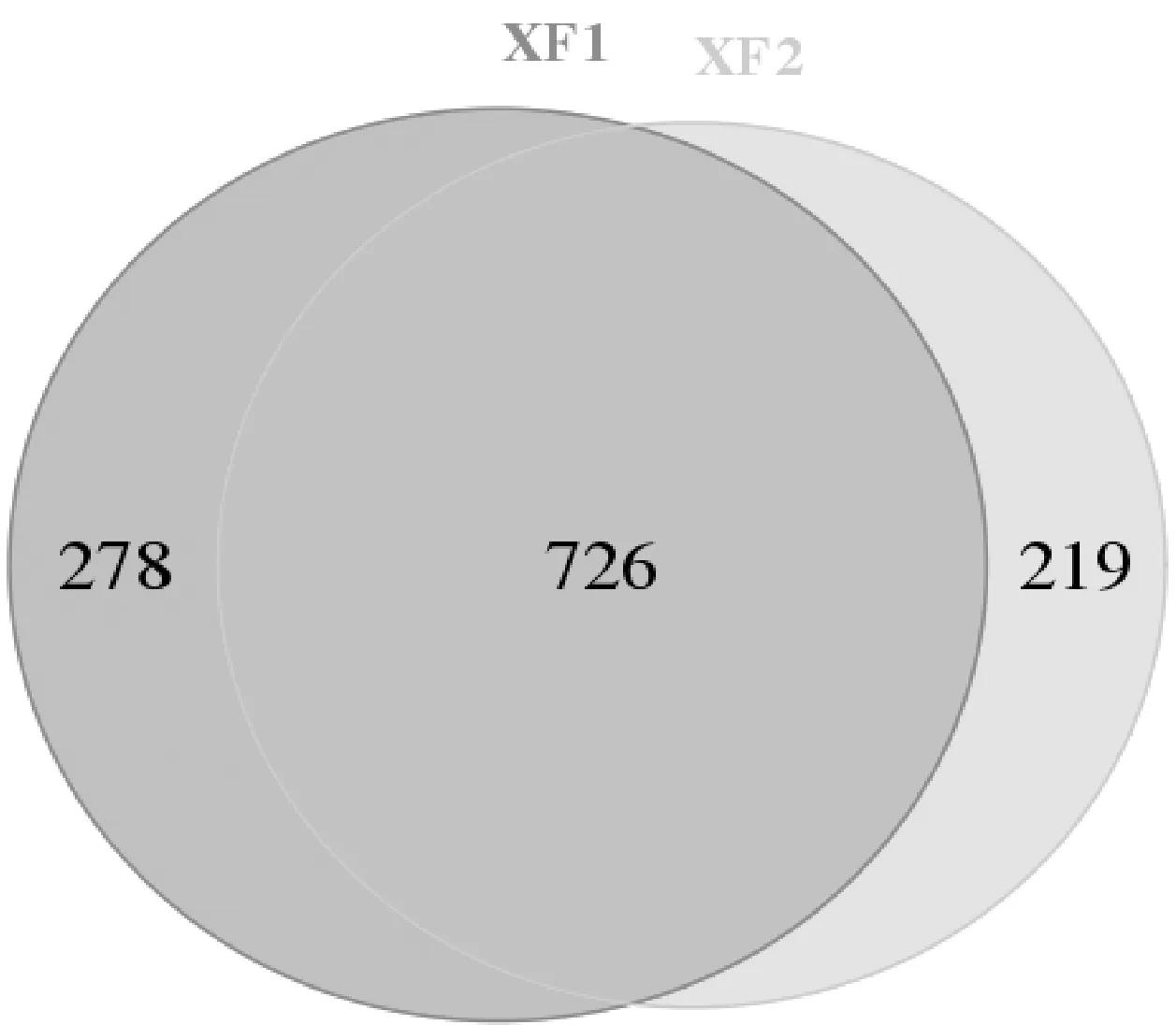
图2 大花杓兰根际与非根际土壤真菌OTUs分布Venn图Fig.2 OTUs-Venn graph of rhizospheric and non-rhizospheric soil samples
2.3 大花杓兰根际与非根际土壤真菌组成分析
通过Illumina Miseq高通量测序发现,大花杓兰根际与非根际2个土壤样本中共检测到的真菌涉及5个门,分别是子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)和球囊菌门(Glomeromycota),各个真菌门所占比例见表2。从表2可知,大花杓兰根际与非根际土壤真菌的优势类群均为子囊菌门,其次是接合菌门。根际土壤担子菌门真菌数量占18.72%,高于非根际土壤2.43倍。另外,根际与非根际土壤真菌类群中,壶菌门和球囊菌门真菌的相对丰度均较低,而未知真菌也占很大的比例(约16%~24%)。
从纲、目、科、属水平上进行分析,发现大花杓兰根际与非根际土壤样本真菌在群落组成和丰度上存在差异(图3)。对于大花杓兰根际土壤,在Ascomycota门真菌中,Dothideomycetes是第一大纲,占该门的12.82%,其次是Sordariomycetes纲,占10.30%,再次是Leotiomycetes纲,占5.05%。在Basidiomycota门中,优势类群为Agaricomycetes纲,占16.12%,其次Tremellomycetes纲,占2.27%。Dothideomycetes纲主要包括Pleosporales和Capnodiales 2个目,分别占该纲的6.85%和4.83%。在Agaricomycetes纲中,Agaricales目和Cantharellales目分别占该纲的14%和1.27%。从“科”这一分类层面来看,Mycenaceae科为优势类群,相对丰度为7.04%,远远高于非根际土壤的相对丰度(0.1%),其次是Hygrophoraceae科、Chaetomiaceae科和Lasiosphaeriaceae科等,相对丰度分别为5.46%、3.44%和2.88%等。另外,Ceratobasidiaceae科占1.12%,高于非根际土壤11.2倍。在根际土壤中Tulasnellaceae科丰度较低,仅为0.03%,但在非根际土壤未发现胶膜菌科真菌。从属的水平进行分析,发现大花杓兰根际土壤中丰度显著增加的真菌群落主要为Mycena属、Hygrocybe属、Humicola属、Cryptococcus属、Antarctomyces属、Davidiella属和Apodus属,其中Mycena属的平均比率为7.04%,高于非根际土壤Mycena的70.4倍。另外,根际土壤测序分析发现4个兰科菌根真菌Ceratobasidium属,Rhizoctonia属,Epulorhiza属和Thanatephorus属丰度较低,均小于1.0%,但Ceratobasidium属在测序总数中占的比率超过非根际土壤的17.27倍,Thanatephorus属真菌高于非根际土壤2.71倍,而Rhizoctonia属和Epulorhiza属在非根际土壤中未发现。

表2 两土壤样本真菌群落在门分类水平上的组成及相对丰度Table 2 Relative abundances and composition of fungi taxa at the phylum level between two soil samples %
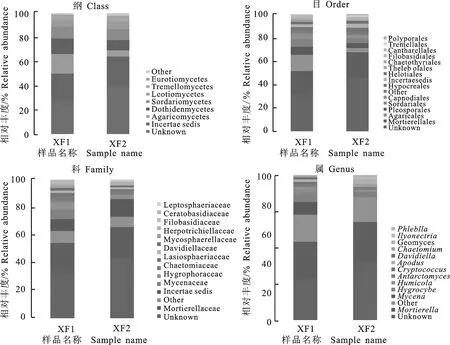
XFI.大花杓兰根际土壤真菌 XFI represents rhizospheric soil fungi taxa;XF2.大花杓兰非根际土壤真菌 XF2 represents non-rhizospheric soil fungi taxa
图3两土壤样本真菌群落的相对丰度
Fig.3Relativeabundancesoffungitaxafromtwosoilsamplesanalyzedwithhighthroughtputsequencing
非根际土壤的Ascomycota门真菌中,其优势类群为Sordariomycetes纲,占9.39%,其次为Dothideomycetes纲,占8.18%,再次是Leotiomycetes纲,占6.17%。在Basidiomycota门中,Agaricomycetes是第一大纲,占该门的5.35%;其次为Tremellomycetes纲,占1.89%。Sordariomycetes纲主要包括Sordariales目和Hypocreales目,分别占该纲的3.98%和3.47%。在Agaricomycetes纲中,Agaricales目占该纲的3.61%,比根际土壤低3.87倍;Cantharellales目占0.46%,低于根际土壤的2.76倍;Polyporales目占1.13%,而在根际土壤未发现此目真菌。从“科”这一分类层面来看,平均丰度大于1%的科有Hygrophoraceae科(3.11%)、Chaetomiaceae科(2.96%)、Herpotrichiellaceae科(2.10%)、Davidiellaceae科(1.53%)、Mycosphaerellaceae科(1.24%)和Leptosphaeriaceae科(1.21%)。从“属”的水平进行分析,发现大花杓兰非根际土壤中丰度显著增加的真菌群落主要为Geomyces属(2.53%)、Chaetomium属(1.92%),Phlebiella属(1.13%)、Ilyonectria属(1.06%)。其中Phlebiella属在根际土壤中未检测到。
3 讨 论
根际微生物对植物种子萌发、生长发育和抑制土传病害具有较好的正效应[14],研究濒危兰科药用植物大花杓兰根际微生物群落的组成及多样性对于大花杓兰的保育具有重要意义。本研究采用Illumina Miseq高通量测序技术对大花杓兰根际与非根际土壤的真菌群落多样性进行对比分析,其结果为大花杓兰菌根真菌的研究奠定理论基础。基于97%相似度水平,根际与非根际2个土壤样本通过聚类分别被划分为1 004和945个OTUs。大花杓兰根际土壤样本的Chao1和Shannon指数值均大于非根际土壤样本,表明根际土壤真菌群落在丰富度和多样性上均高于其非根际土壤。从门水平上来看,大花杓兰根际与非根际土壤中真菌优势菌群依次为子囊菌、接合菌和担子菌,其中子囊菌在2个土壤样本中均占绝对优势,平均比率为43.6%和44.40%。徐红梅等[15]对杭白芍、李倩等[16]对黄花蒿、李越鲲等[17]对枸杞根际土壤真菌优势菌群的研究中也得到了相似的结果。为什么子囊菌在很多植物根际中所占比例最大?其原因可能是自然界中许多子囊菌无性繁殖能力很强,能产生大量的分生孢子,快速增长,使其在数量上明显占有优势[18]。
Oja等[19]对二叶舌唇兰(Platantherachlorantha)、四裂红门兰(Orchismilitaris)及它们周围土壤中的兰科菌根真菌进行研究,发现蜡壳耳目Sebacinales、胶膜菌科Tulasnellaceae和角单菌科Ceratobasidiaceae,也同样存在于兰科植物的根中,只是相对丰度不同。Waud等[8]研究发现,与兰科植物共生的菌根真菌广泛分布于土壤中,但菌根真菌群落组成的变化与近端宿主植物密切相关。Voyron等[20]的研究结果表明,兰科植物Ophryssphegodes和Anacamptismoriog根中某些菌根真菌优势类群在土壤呈零星分布或未被检测到。与非根际土壤相比,本研究发现大花杓兰根际土壤丰度显著增加的真菌类群为担子菌门、伞菌纲、伞菌目和鸡油菌目、小菇科和角担菌科、小菇属和角担菌属。除了占优势地位小菇属和角担菌属真菌外,大花杓兰根际土壤还发现了Epulorhiza属,Rhizoctonia属,Thanatephorus属真菌类群的存在,但相对丰度均较低。其中Thanatephorus属真菌占0.13%,高于非根际土壤2.71倍;而Rhizoctonia属和Epulorhiza属真菌平均比率为0.03%,但在非根际土壤中均未发现。尽管这些真菌都是已报道的不同兰科植物的菌根真菌[3-5, 21],但它们是否为大花杓兰的菌根真菌,还需进一步分离培养这些真菌并对其生态功能进行验证。
此外,被孢霉属真菌在大花杓兰根际与非根际土壤均占有绝对优势,其占比平均值分别为20.30%和22.31%,这与一些已有研究结果相一致[22-23]。被孢霉属真菌是土壤中较为常见真菌,具有一定的生态功能,能促进植物根系吸收矿质元素、抑制病原菌等[24],但被孢霉属真菌对大花杓兰生长发育的作用尚未知,有待研究。在根际与非根际土壤真菌类群中,Unclassified真菌均占有较大的比例,这表明大花杓兰根际与非根际土壤中存在大量的真菌新类群,有待于进一步发掘。
4 结 论
本研究采用Illumina Miseq高通量测序技术对濒危兰科植物大花杓兰根际与非根际土壤真菌群落组成进行对比分析,发现大花杓兰根际与非根际土壤真菌组成均较为丰富,但真菌组成结构及相对丰度存在一定的差异。与非根际土壤相比,在门、纲、目、科和属分类水平上丰度显著增加的根际土壤真菌类群分别为担子菌门Basidiomycota、伞菌纲Agaricomycetes、伞菌目Agaricales和鸡油菌目Cantharellales、小菇科Mycenaceae和角担菌科Ceratobasidiaceae、小菇属Mycena和角担菌属Ceratobasidium。
