结肠肝样腺癌误诊为原发性肝癌一例并文献回顾
2019-02-13胥子玮朱春燕封益飞王勇傅赞孙跃明
胥子玮 朱春燕 封益飞 王勇 傅赞 孙跃明
作者单位:210029 江苏,南京医科大学第一附属医院结直肠外科
胥子玮, 朱春燕, 封益飞, 等. 结肠肝样腺癌误诊为原发性肝癌一例并文献回顾[J/CD].中华结直肠疾病电子杂志,2019, 8(1): 80-84.
肝样腺癌(hepatoid adenocarcinoma,HAC)是临床上少见的一种发生在肝外的具有明显肝样分化特征的恶性消化道癌。文献报道多见于胃、胰腺及胆囊等脏器,而发生在结肠的肝样腺癌罕见。由于肝样腺癌和原发性肝细胞癌有许多相似特征,有时两者鉴别比较困难。本文报道一例男性患者因甲胎蛋白升高就诊最终诊断为结肠肝样腺癌的病例。并结合本例肝样腺癌诊疗过程,对其发病特点、诊疗方案以及预后等问题进行分析讨论。
一、临床资料
患者男性,54岁,因甲胎蛋白增高3月余入院。患者3个月前因发现甲胎蛋白增高就诊于南京医科大学第一附属医院。住院期间查甲胎蛋白(alpha fetopmtein,AFP)大于1 210 ng/mL,上腹部CT(图1)示肝S6段占位,血管瘤可能,结合临床AFP检查,肝癌待排,建议MR增强扫描。腹部MRI(图2)示肝S6段结节影,考虑血管瘤可能。肝外科行手术探查,术中见:肝右叶S6段表面可及直径1 cm左右肿块,质软;腹膜后肠系膜根部近十二指肠水平部可及一直径约3 cm圆形肿块,术中肠系膜根部肿块快速病理示转移性肿瘤,术中考虑肝脏原发性占位侵及小肠系膜,遂行肝脏肿块切除+后腹膜肿块切除术。术后病理示:(肝脏S6段、Ⅱa段)海绵状血管瘤,肿块大小1.2 cm×1.2 cm×0.3 cm。另见肝组织示肝细胞中度脂肪变性,汇管区淋巴细胞浸润。肠系膜根部肿物(图3):淋巴结内低分化腺癌。肠系膜根部免疫组化标记示(图4):AFP,Glypican3,CK-pan,CD10,Villin,Syn,Ki-67( + ),TTF-1,CEA,Hep-1,CK20,CD56,CK7,CgA,SALL4,Oct3/4(-);结合苏木精-伊红染色(HE)切片,考虑淋巴结转移性低分化腺癌伴AFP表达,首先考虑为肝细胞源性或肝样肿瘤可能。
术后行PET-CT提示结肠肝曲不规则增厚,管腔狭窄,FDG代谢异常增高,遂查结肠镜(图5)示:肝曲可见一不规则新生物,病理示腺癌。结合既往病史,考虑为结肠肝样腺癌伴淋巴结转移,遂行腔镜下右半结肠全系膜切除术(complete mesocolic excision,CME),术中探查见:肝6段见术后创面,肿瘤位于结肠肝曲,结肠系膜根部、末端回肠根部可及数枚肿大淋巴结。
二、术后病理
大体:距回盲瓣约8.5 cm结肠肠腔内见一溃疡型肿块,大小2 cm×1.8 cm×0.7 cm,肉眼肌层剖面灰白实性,质中(图6)。常规病理示右半结肠切除标本:(结肠)腺癌,溃疡型,肿块大小2 cm×1.8 cm×0.7 cm,癌组织侵犯肠壁固有肌层外纤维脂肪结缔组织。上、下切缘及另送(吻合圈)均未见癌残留;(肠周)淋巴结可见癌转移(4/18);慢性阑尾炎(图7)。免疫组化示(结肠)肿瘤细胞:AFP,CEA,Hep-1,Glypican-3,CK7,CK8/18,CK19,CK20,CK-L,CD34,CDX-2,CgA,Syn,Villin,Muc-1,Muc-2,AAT(+),CD10,CD56,Sall4(-),Ki-67约70%(图8)。
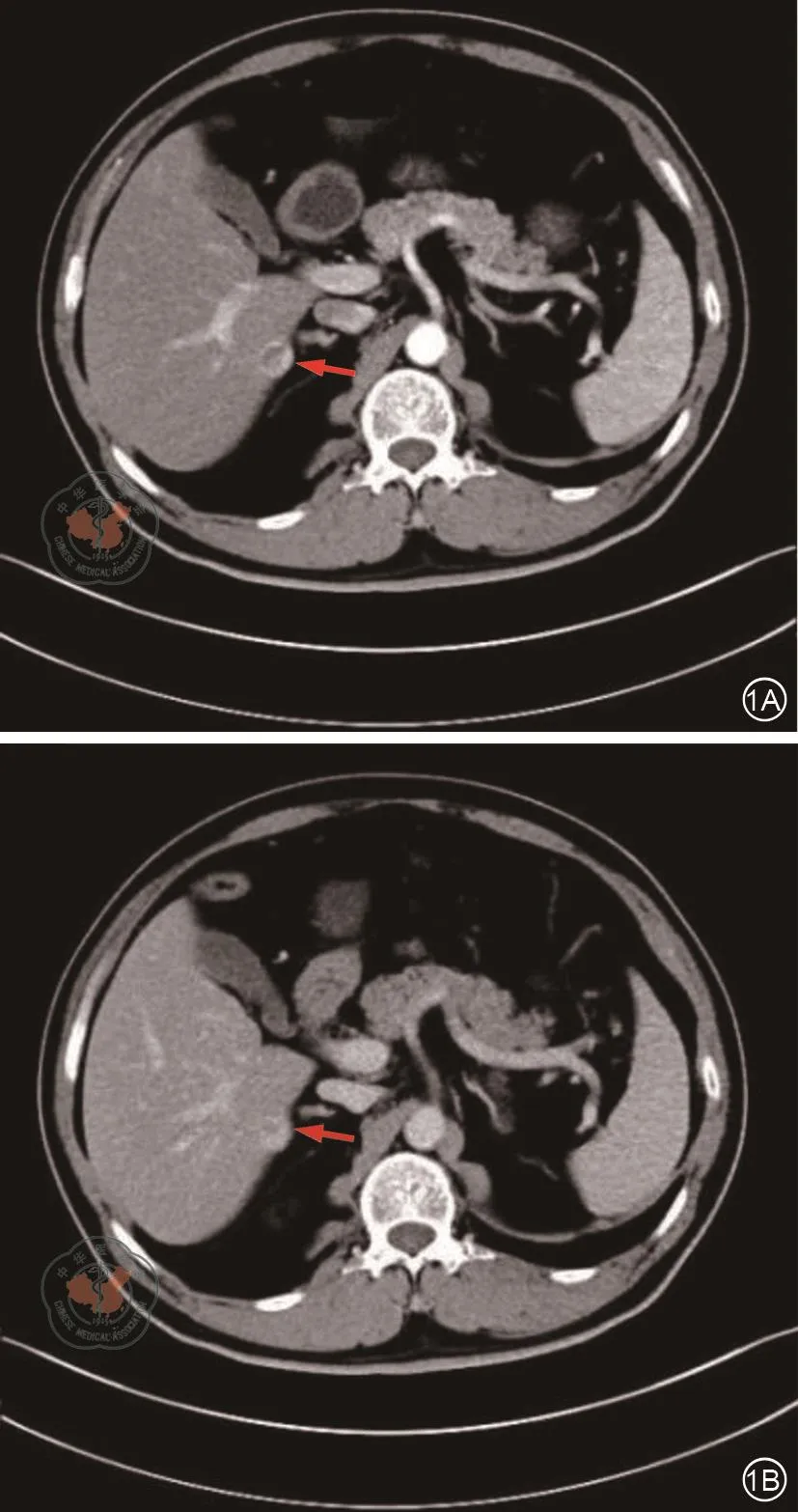
图1 上腹部CT检查。1A图 箭头处示肝S6段类圆形结节,直径约1.6 cm,局部向外隆起,动脉期可见边缘强化;1B图箭头处示静脉期病灶进一步向中心强化,考虑肝S6段占位,血管瘤可能。结合AFP检查,肝癌待排
病理诊断:右半结肠肝样腺癌(pT3N2M0,ⅢC期)。
三、术后AFP变化
图9中可以看到术前AFP明显升高(大于1 000 ng/mL),AFP在第一次术后迅速下降,经过两次手术后AFP回归到正常水平。
四、讨论
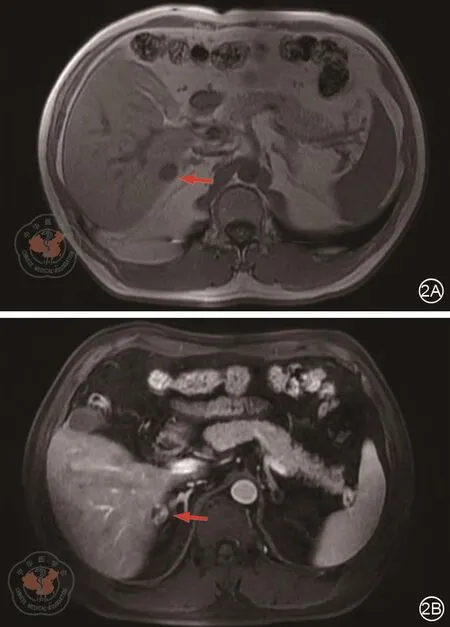
图2 上腹部MR检查。肝S6段见类圆形长T1(2A图箭头处)长T2(2B图箭头处)信号,边界清,大小约1.6 cm×1.4 cm,考虑血管瘤可能
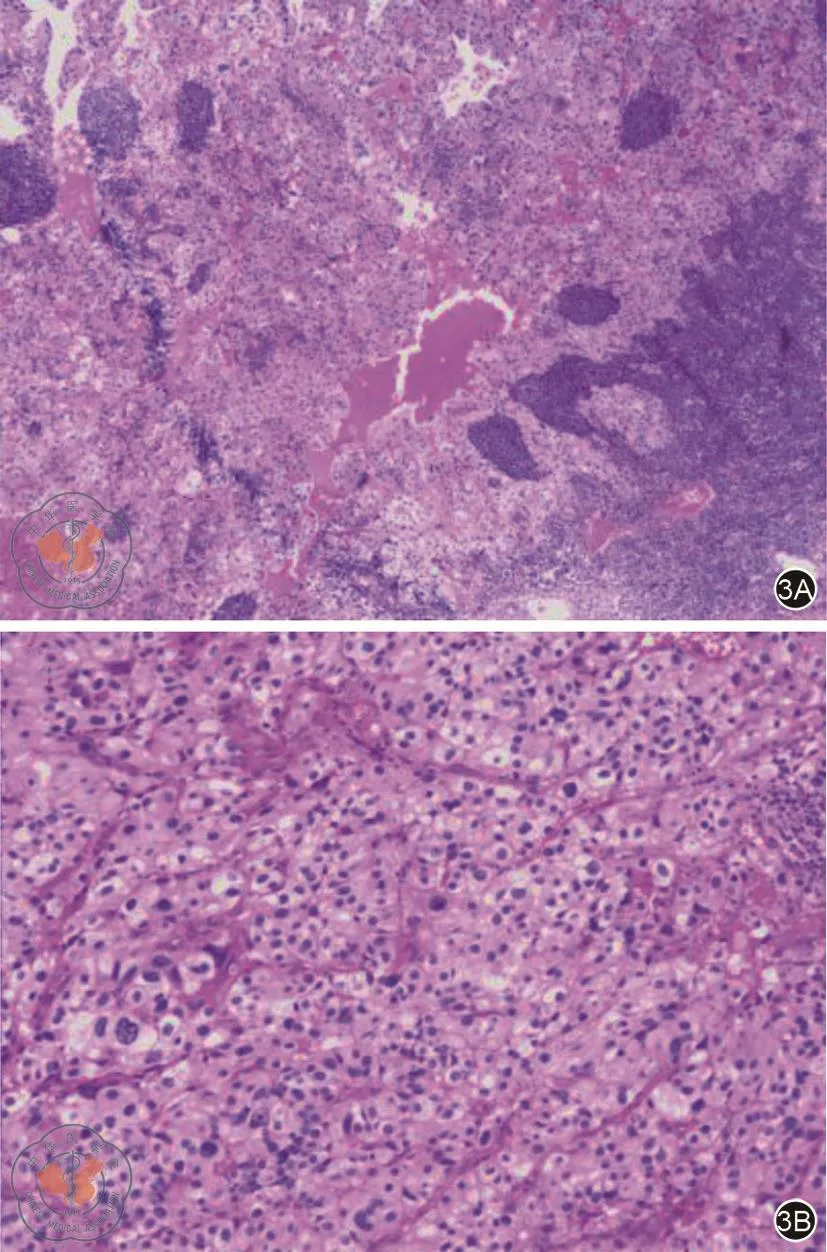
图3 肠系膜根部肿物苏木精-伊红染色。3A可见肿瘤组织呈实性生长(×40);3B可见肝样分化区域,肿瘤细胞排列成梁索状,细胞胞质丰富,核大深染,核分裂多见(×100)

图4 肠系膜根部肿物免疫组化。4A可见肿瘤细胞AFP弥漫阳性(×100);4B可见肝样分化区Glypican3胞质阳性表达(×100);4C可见肝样分化区CD10微管状阳性表达(×200);4D可见Ki-67(+)(×100)

图5 结肠镜检查。肠镜检查示肝曲可见一不规则新生物,表面高低不平伴溃疡,活检质地脆易出血

图6 标本展示。6A图为右半结肠大体照片;6B图肠腔内可见肠腔有一溃疡型肿块(箭头处),大小约2 cm×2 cm。
肝样腺癌是临床上少见的一种消化道癌,它同时具有腺癌和肝细胞癌样分化特征,血清甲胎蛋白(AFP)升高是其一个常见表现。Bourreille等[1]首次报道1例伴有血清AFP升高和肝脏转移的胃腺癌患者,将其命名为“产生AFP的胃癌”,后来陆续出现了胆囊、食管、胰腺、肺、肾上腺、卵巢等脏器的报道,结肠或直肠的HAC罕见[2]。HAC以老年男性多发,男性约占70.0%,男女比例2.3:1,平均发病年龄63.5岁[3]。目前HAC的发病机制尚不清楚。有报道认为这类细胞更接近于全能细胞,使肿瘤早期有血管内增殖,这可能解释了其不良预后[4-5]。
虽然AFP升高程度在HAC的诊断中有重要意义,然而,仍有小部分HAC患者血清AFP水平并不升高。Inagawa等[3]报道,70%~80% HAC患者血清AFP升高,认为其高低与肿瘤的分化程度有关,部分患者血清AFP在正常水平,说明肿瘤分化程度比较低。因此,血清AFP的水平高低并不能作为确诊依据,不论其是否产生AFP,凡病理学检查出现肝样分化区,即可诊断为HAC。免疫组化染色时,85%~95%病例可表现为AFP(+),30%~83.3%有Hepatocyte(+)[6]。本例患者以体检时血清AFP升高(大于1 000 ng/mL)入院,术后免疫组化可见肝样分化区域,血窦丰富,肿瘤细胞排列成条索状,AFP在术后迅速回归到正常水平(图9)。
由于肝样腺癌和原发性肝细胞癌(primary liver cancer,PLC)均有血清AFP的升高,有时以肝转移为首发症状,由于活检的局限性,两者鉴别有时比较困难。 鉴别要点如下:(1)PLC多伴有肝硬化,以单发结节为主,HAC的肝转移常为多发结节,在肝脏浆膜面形成凹陷;(2)PLC一般无腺癌成分;(3)免疫组化标志物在HAC、PLC中的表达不同。HAC中glypican-3、AFP、CK19的阳性率高,PLC中glypican-3、hepatocyte的阳性率高。两者鉴别仍需结合临床病史、影像学检查、内镜检查和免疫组化检查结果进行综合判断。
结肠肝样腺癌以外科手术切除为主,术后配合放疗和化疗。目前文献[2,5]报道的结肠肝样腺癌多采用FOLFOX方案作为辅助治疗,但效果并不明确。肝样腺癌的预后比普通腺癌差,同肝细胞癌的预后相近。有关胃肝样腺癌的研究发现, AFP阳性的肝样腺癌易发生肝转移,且滴度越高,肝转移率越高。Nagai等[7]报道胃肝样腺癌无论有无AFP表达,预后均明显比普通胃癌差。总结文献报道发现,结肠肝样腺癌预后不良,2/3患者在1年内死亡[8]。
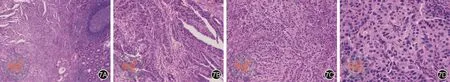
图7 右半结肠苏木精-伊红染色。7A可见肿瘤细胞侵犯右半结肠(×40);7B可见腺样区及乳头状区(×100);7C可见肝样分化区域,血窦丰富,肿瘤细胞排列成条索状(×100);7D可见肿瘤细胞胞质丰富,核大深染,核分裂多见(×200)

图8 右半结肠免疫组化。8A可见肿瘤细胞AFP灶状阳性(×100);8B可见肝样分化区Hep-1阳性表达(×100);8C可见肝样分化区Glypican3胞质阳性表达(×100);8D可见Ki-67约70%(×100);8E可见肝样分化区CD34阳性表达(×100);8F可见肝样分化区CK19阳性表达(×200)
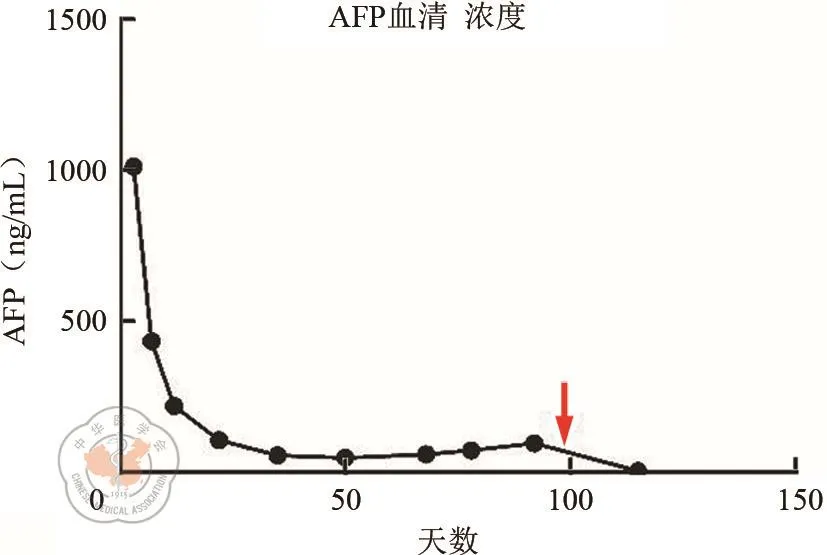
图9 AFP变化水平示意图。横坐标为第一次术后天数,纵坐标为AFP血清浓度,三角箭头表示右半结肠全系膜切除术的手术时间
由于HAC早期症状缺乏特异性,恶性程度高,术前诊断困难,往往患者就诊时已是中晚期,HAC侵袭性强,文献报道显示其发生肝转移、淋巴结转移的比例较高[9]。本例患者术后病理证实已发生淋巴结转移。HAC患者的预后较差,文献报道其平均生存期为10~18个月[10-11],而血清AFP水平对于检测HAC预后有重要作用,可以用于监测HAC的复发与转移,若术后患者AFP不降反升,或者正常后再次升高,应考虑肿瘤复发或转移[12]。对于HAC患者应密切随诊,内容应包括影像学检测、血清AFP测定等。
总之,HAC是一种少见的特殊类型肿瘤,容易发生血管淋巴管浸润,淋巴结以及肝脏转移多见,预后较差。由于其临床表现缺乏特异性、临床医生对其认识不足等多方面原因,往往难以诊断及治疗,导致发现时多已是晚期,临床医师应当提高对HAC的认识,由于大多数HAC具有产生AFP的能力,在早期即可出现AFP水平升高,对于血清AFP显著升高患者要考虑到HAC的可能性。
