卵泡膜细胞瘤-纤维瘤组肿瘤的MRI表现
2019-02-13朱丽丽邱丽芹
田 颖,朱丽丽,邱丽芹
(铁法煤业集团总医院放射科,辽宁 铁岭 112700)
卵泡膜细胞瘤-纤维瘤组肿瘤是一种起源于卵巢原始性腺性索间质组织的卵巢功能性肿瘤,占全部卵巢肿瘤的4%,多为良性,恶性罕见。该病影像缺乏特异性,术前易与其他良性病变混淆。MRI组织分辨力良好,能在一定程度上反映病变组织学特性。现回顾性分析我院2012年1月至2018年4月经手术病理证实的13例卵泡膜细胞瘤-纤维瘤组肿瘤的临床资料及MRI特征性表现,皆在提高该病的诊断准确率。
1 资料与方法
1.1 一般资料 13例,年龄35~72岁,中位年龄49岁,其中绝经后11例,下腹肿块、腹痛、腹胀3例,绝经后阴道出血3例,经期不规律2例,合并子宫内膜增生4例,子宫肌瘤2例,雌激素水平升高7例,合并少量腹水8例。CA125水平轻度升高1例。5例无明显临床症状,体检偶然发现。
1.2 仪器与方法 13例术前均行MRI平扫和增强扫描。使用GE Signa 3.0 T MRI扫描仪,8通道腹部相控阵线圈。平扫包括横轴位FSE T1WI TR 460ms,TE最 小 ,NEX 1;FSE T2WI TR 2 600 ms,TE 85 ms,NEX 2;T2WI 抑 脂 序 列 TR 4 700 ms,TE 100 ms,NEX 2,矩阵 320×320;横轴位 SE-EPI DWI序列 b值为 1 000 s/mm2,TR 4 000 ms,TE 最小,NEX 4,矩阵128×160,矢状位T2WI抑脂序列,冠状位T2WI(扫描参数同横轴位)。增强扫描对比剂使用Gd-DTPA,剂量0.2 mmol/kg体质量,注射流率2~2.5 mL/s,横轴位扫描序列采用三维梯度回波肝脏加速容积采集(LAVA)序列 TR 4.5 ms,TE 2.6 ms,矩阵 260×192,根据需要补充扫描T1WI冠状位、矢状位。病灶信号参照同层面肌肉组织信号进行分析。
1.3 病理检查 肿瘤大体观,包括大小、质地、包膜及周围有无浸润等。标本HE染色,显微镜下观察肿瘤组织的病理特点。
1.4 图像分析 所有图像均在AW4.4工作站上用FUNCTOOL软件处理DWI图像获得ADC图,取病灶最大层面避开囊变坏死区及对侧卵巢分别设置ROI,测量ADC值,测量3次取平均值。TIC由FUNCTOOL软件后处理获得。由2名以上有经验的影像医师共同阅读,观察病灶大小、形态、部位、病灶信号特点及强化方式,如意见分歧,经讨论达成一致。
2 结果
2.1 MRI表现 13例均为单发实性肿块,右侧8例,左侧5例,直径3.5~15.7 cm,肿块边界清楚,对周围组织无侵犯,可见完整包膜,腹膜后及盆腔未见肿大淋巴结。肿块类圆形、卵圆形9例,不规则分叶状4例。13例T1WI呈等或低信号,T2WI 4例呈低信号,3例呈低信号夹杂斑片状稍高信号,6例呈高信号,DWI呈稍高-高信号,ADC 值(1.27±0.36)×10-3mm2/s,较对侧卵巢降低。增强扫描10例病灶呈不均匀轻度强化,3例强化不明显,随时间推移,肿瘤增强扫描后期均表现为持续强化方式,13例动态增强扫描TIC均呈缓升型,但强化程度低于子宫肌层(图 1)。
2.2 病理改变 大体观肿瘤呈圆形、椭圆形或分叶状实性肿块,13例均有完整包膜,病灶内可见大小不等坏死囊变区,肿瘤切面呈灰白或淡黄色,质地硬。光镜下,瘤细胞以梭形或短梭形为主,交织成漩涡状或编织状排列,部分可见玻璃样变。
3 讨论
3.1 病理分型 根据卵泡膜细胞和纤维母细胞含量的不同病理分为3个亚型:①卵泡膜细胞瘤,几乎均由卵泡膜细胞构成。②卵泡膜纤维瘤,由卵泡膜细胞和纤维母细胞按不同比例构成。③纤维瘤,几乎均由纤维母细胞构成。该肿瘤组织学分化特点有多向重叠,病理学也很难精确分类,WHO建议将其称为卵泡膜细胞瘤-纤维瘤组肿瘤[1]。
3.2 临床特点 卵泡膜细胞瘤-纤维瘤组肿瘤是由卵巢性索间质特殊间胚叶组织向卵泡膜细胞分化而形成的卵巢功能性肿瘤[2],占全部卵巢肿瘤的4%,多数为良性,恶性罕见,仅占 1%~5%[3],本组 13例均为良性。该病好发于中老年妇女,以绝经后妇女多见[4],本组绝经后11例,与文献报道相符。患者临床表现无特异性,可无临床症状体检偶然发现,或出现肿瘤压迫症状以腹痛、腹胀、下腹肿块就诊,本组表现为下腹肿块、腹痛、腹胀3例;部分患者雌激素水平升高,月经紊乱、子宫内膜增生、绝经后阴道不规则流血,或为子宫内膜癌,本组绝经后阴道出血3例,经期不规律2例,子宫内膜增生4例,8例合并少量腹水,与文献[5]报道相近,未见合并子宫内膜癌患者。肿瘤黄素化时出现男性化体征[6],本组未见相关病例。另有文献[7-8]报道,卵泡膜细胞瘤-纤维瘤组肿瘤患者可有CA125指标升高,且与腹水量呈正比,但明显低于卵巢癌患者,本组1例CA125指标轻度升高,手术是该病的首选治疗方案,预后良好。
3.2 MRI特点 MRI软组织分辨力高,既可提供肿瘤的形态、大小与周围组织关系,又能反映组织生物学特性。结合本组及相关文献,总结卵泡膜细胞瘤-纤维瘤组肿瘤特点如下:①肿瘤平扫常表现为盆腔附件区边界清楚的实性肿块,病灶形态呈圆形、卵圆形或分叶状,单发多见,少数双侧发病,包膜完整,部分有纤维包膜是其较特征表现,T2WI抑脂序列包膜可清楚显示。与肌层相比,T1WI病灶多呈稍低信号,少数呈等信号,T2WI肿瘤实性部分呈低信号为特征性改变[9],也可呈稍高或等信号,本组 4例病灶T2WI呈低信号,3例呈低信号夹杂斑片状稍高信号,6例呈高信号。有学者[10-11]认为,肿瘤含卵泡膜细胞成分越多,T2WI信号越高,含纤维母细胞成分越多,则T2WI信号越低。肿瘤可伴不同程度囊变坏死,表现为肿瘤内出现条片状或结节状长 T1、T2信号,T2WI抑脂序列高信号更明显,与病理示肿瘤内出现囊变及黏液样变相符合。Kato等[12]认为,周围型囊变也是卵泡膜细胞瘤-纤维瘤组肿瘤的常见影像学表现,本组未见此征象。②DWI病灶实性部分表现为高或稍高信号,部分病灶内可见结节状及条片状稍低信号,ADC图多数呈稍高信号,少数呈稍低信号,有学者[13]认为卵泡膜成分多的肿瘤ADC值较高,纤维成分多的肿瘤ADC值低,本组ADC值(1.27±0.36)×10-3mm2/s,较对侧正常卵巢 ADC 值(1.65±0.28)×10-3mm2/s降低,说明肿瘤内细胞密度高,水分子运动受限。③增强扫描病灶呈持续强化为其特征性表现,强化程度低于子宫肌层,肿瘤强化程度与瘤内含卵泡膜细胞成分呈正相关。另有文献[14]报道肿瘤动态增强TIC多数为Ⅰ型(缓升型),即病灶持续强化未见明显峰值;少数为Ⅱ型(平台型),即病灶强化早期达到峰值此后信号强度变化不超过10%;无Ⅲ型曲线(流出型),即病灶强化早期达到峰值此后信号强度快速减退;本组13例TIC均呈缓升型,进一步证实了上述观点。若肿瘤出现坏死囊变,强化则不均匀。
3.3 鉴别诊断 卵泡膜细胞瘤-纤维瘤组肿瘤需与以下疾病鉴别:①浆膜下子宫肌瘤或阔韧带肌瘤,平扫信号相似,但前者肿瘤与子宫关系密切,DWI呈稍低信号,增强扫描强化方式与子宫肌层相似,强化程度比卵泡膜细胞瘤-纤维瘤组肿瘤明显。②卵巢颗粒细胞瘤,两者雌激素水平均可增高,卵巢颗粒细胞瘤为卵巢性索间质来源的卵巢恶性肿瘤,多表现为囊实性,增强扫描实性部分强化较卵泡膜细胞瘤-纤维瘤组肿瘤明显。③畸胎瘤,信号混杂,增强扫描呈不均匀强化,瘤内见脂肪成分为其特征性表现。④硬化性间质瘤,发病年龄轻,好发于30岁以下,临床表现月经不规律,肿瘤强化呈富血供特点。⑤卵巢癌,多表现为不规则囊实性肿块,边界不清,无纤维包膜,增强扫描囊壁及实性部分明显强化,常伴腹腔、腹膜转移,可见大量腹水。
综上所述,卵泡膜细胞瘤-纤维瘤组肿瘤的影像表现符合良性肿瘤的影像特点,多序列MRI成像在卵泡膜细胞瘤的表现上有一定特征性,结合发病年龄及雌激素水平升高等内分泌功能异常特点,有助于提高其术前正确诊断率。
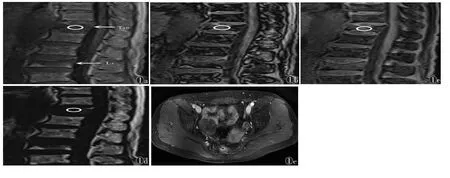
图1 女,49岁,右侧卵巢卵泡膜细胞瘤-纤维瘤组肿瘤,无明显临床症状 图1a 横轴位T2WI抑脂序列示肿瘤呈欠均匀高信号,边缘可见完整的低信号包膜 图1b 横轴位T1WI示肿瘤呈边界清楚的欠均匀等信号 图1c 横轴位DWI示肿瘤呈边界清楚的欠均匀高信号,其内可见小斑片状稍低信号
图1d动态增强扫描早期病灶呈轻度不均匀强化 图1e 动态增强扫描晚期病灶呈持续强化,强化程度低于子宫肌层
