胰腺浆液性微囊型囊腺瘤的影像学及病理对照分析
2019-02-13吴梦龙
吴梦龙
(南华大学附属第一医院放射科,湖南 衡阳 421001)
胰腺浆液性微囊型囊腺瘤(serous microcystic cystadenomas,SMCA)是胰腺少见的外分泌良性肿瘤,约占胰腺肿瘤的1%,但其术前正确诊断率不高,易误诊和漏诊[1-2]。回顾性分析我院2016年1月至2018年1月收治的11例SMCA的影像及病理表现,结合文献,探讨、总结其影像学特征,以提高该病诊断准确性,帮助临床确定治疗方案。
1 资料与方法
1.1 一般资料 本组11例,男1例,女10例;年龄33~67岁,平均53岁。主要临床症状表现:9例(81.8%)腹痛,1 例(9.1%)饱胀感,1 例(9.1%)无症状。术前3例(27.3%)诊断为胰腺囊腺瘤。
1.2 仪器与方法 11例均行CT平扫及增强扫描,2例加行MRI平扫及增强扫描。CT检查采用Siemens 64排双源螺旋CT扫描仪,对比剂为优维显(非离子型对比剂,100 mL),通过高压注射器经肘静脉注入,流率 3 mL/s,分别在 25~30、45、120 s行动脉期、门脉期、延迟期扫描。MRI检查采用Achieva 3.0 T超导MRI扫描仪及体部相控阵表面线圈。扫描序列包括常规轴面和冠状面序列:①常规T2WI TSE序列,T1WI FFE列;②脂肪抑制THRIVE序列;③T1WI(FFE-SPIR)平扫和动态增强扫描,对比剂为Gd-DTPA 12 mL,通过高压注射器经肘静脉注入,流率2.5 mL/s。层厚5 mm,层距 1 mm,矩阵 256×256。MRCP:采用呼吸触发,TR 2 521 ms,TE 760 ms,矩阵 300×225,层数87层,原始图像行MIP。
1.3 影像学分析 由2名经验丰富的影像诊断医师共同分析CT及MRI图像,评价并记录、分析影像学特征。
1.4 病理检查 组织标本经甲醛液固定、常规脱水、石蜡包埋、4 μm切片、HE染色后光镜观察,免疫组织化学染色采用SP或Envision两步法。
2 结果
2.1 基本情况 11例共11个病灶,均为单发;位于胰头4个,胰体尾7个。影像学显示肿瘤长径14~50 mm,平均40 mm;11例病灶与周围胰腺组织分界均清楚。临床病理诊断均为SMCA;长径14~50 mm,平均35 mm;与手术病理对照,术前影像诊断符合率为 27.3%(3/11)。
2.2 影像学表现
2.2.1 CT检查 SMCA均呈类圆形或分叶状,边界清楚,平扫呈水样密度,其内为大小不等多发微小囊状结构,囊腔直径数毫米至20 mm不等,囊壁及纤维分隔呈等密度(图1a)。增强扫描纤维分隔及囊壁中度强化,门脉期持续强化,囊壁边界清楚,囊内容物未见强化。9例病灶见纤维分隔,其中5例可见中央瘢痕(图1b);1例病灶边缘囊壁可见粗大钙化(图2)。本组未见壁结节。
2.2.2 MRI检查 病灶边界清楚,内见大小不等的囊腔,囊腔直径多<2 cm,囊腔内呈均匀长T1长T2信号,囊腔内见等或略低T1WI、T2WI信号的纤维分隔(图3),未见明显壁结节影,纤维分隔中度强化。T2WI及MRCP显示瘤体内囊腔较CT更清楚。
2.3 病理结果 MSCN肉眼观察边界清楚,切面灰白、湿润,见清亮液体流出;光镜下切面呈海绵状,由许多大小不等的微小囊构成(图1c),直径0.5~5.0 mm,囊内为水样液体,瘤体内纤维组织丰富,并常见纤维瘢痕,纤维组织中可见玻璃样变及小血管增生。囊壁由扁平或立方上皮细胞组成,细胞大小较一致,胞质透明、红染,细胞核无异型,呈圆形、卵圆形。
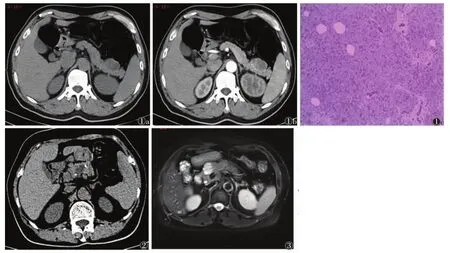
图1 男,59岁,浆液性微囊型囊腺瘤(胰尾)图1a CT轴位显示胰尾囊性肿块 图1b 增强扫描动脉期,病灶呈低密度(箭头),内见中央瘢痕强化 图1c 镜下病理见多个小囊及囊腔之间较厚的纤维分隔(HE×40) 图2 女,67岁,浆液性微囊型囊腺瘤(胰头),CT平扫示胰头肿块,瘤体边缘见粗粒状钙化 图3 女,54岁,浆液性微囊型囊腺瘤(胰头),T2压脂序列示肿块呈分叶状,多发小囊腔,可见纤维分隔
3 讨论
3.1 临床与病理特点 SMCA是胰腺少见的外分泌肿瘤[3],约占胰腺肿瘤的1%,在胰腺囊性肿瘤(pancreatic cystic neoplasms,PCN)中较常见,相较于其他恶变前或恶性PCN,SMCA常为良性,恶性浆液性囊腺癌很少见[1,4]。 迄今为止,仅约 30例浆液性囊腺癌在文献[5]中报道,发病率约占浆液性囊性肿瘤的1%~3%。
SMCA起源于导管细胞,大多数学者[6]认为其为良性肿瘤。PCN术前模糊诊断常见、误诊率高,术前精确到亚型的正确诊断率仅33.0%,尤以SMCA最低(13.7%)[7]。一般认为术前诊断可能是决定手术方式的重要因素,因此,正确诊断可避免不必要的手术干预并排除其他恶性肿瘤[1]。
SMCA缺乏典型的临床症状,当肿瘤生长较大、压迫邻近组织及器官时,可出现上腹部不适和疼痛,本组9例因腹痛、腹胀入院,1例无临床症状于体检中发现。该病好发于中老年女性,发病率是男性的3倍,平均发病年龄 53 岁[1,7],本组也以女性患者为主,且平均发病年龄与文献报道一致。
本组11例SMCA均为单发,与周围组织分界清楚。均为多房,显微镜下囊壁由扁平或立方上皮细胞组成,囊壁间及分隔纤维组织丰富,可见玻璃样变及小血管增生。本组病理切面呈海绵状,由许多直径0.5~5.0 mm的微小囊构成,囊内为清亮水样液体,部分见纤维瘢痕。
3.2 SMCA的CT、MRI表现 MRI与MSCT均能准确诊断胰腺囊性病变[8]。CT图像上SMCA边界清楚,其内多发大小不等小囊呈蜂窝状,囊腔直径多<20 mm[9],部分囊腔分隔纤薄在影像上未能显示,影像上测得的囊腔直径较病理增大。增强扫描纤维间质分隔结构中度强化,强化程度低于胰腺组织,囊液无强化,在囊液衬托下分隔结构显示更加清晰,但低于胰腺组织。10%~30%的SMCA中心可见星芒状瘢痕,是其特征性表现[10]。本组5例可见中央纤维瘢痕。
SMCA的MRI典型表现为边界清楚肿块,呈长T1长T2信号,囊液、纤维分隔的信号及含量不同,信号可不均匀。纤维瘢痕及分隔在T1WI、T2WI上为等或稍低信号,中度强化。MRI较CT更能清楚显示纤维分隔和微囊结构,以增强扫描更佳[11]。SMCA病变较大可压迫胰管,引起胰管扩张。
典型SMCA由众多的小囊及纤维间质分隔构成,囊壁内衬扁平或立方上皮细胞,在影像上表现为多房囊性肿块;因囊腔大小及肿块边缘生长速度不同,SMCA常呈分叶状。SMCA为良性肿瘤,呈膨胀性生长,对周围组织及器官产生推挤,而不会侵犯,其边界清楚。SMCA内含纤维分隔,部分见中央瘢痕,纤维分隔及中央瘢痕内镜下可见增生小血管和小囊腔,丰富增生的小血管是其CT、MRI强化的基础,增强扫描纤维组织中度强化,门脉期及延迟期可见持续强化,低于正常胰腺组织;增生的小血管有完整的血管内皮细胞,所以SMCA出血少见。中央瘢痕是较为密集的纤维组织,SMCA囊壁由扁平或立方上皮细胞组成,部分增强扫描可表现为瘤体边缘薄壁强化,囊内未见明显分隔,这与病理显示瘤内纤维组织成分较少相吻合,部分囊壁下纤维组织增生,囊壁亦可见强化。
3.3 鉴别诊断 SMCA与胰腺其他囊性病变的鉴别:①黏液性囊腺瘤,多房性黏液性囊腺瘤的囊腔数量少,囊腔较大,囊壁较厚,分隔粗细不均,囊内可见壁结节[12]。②导管内乳头状黏液性腺瘤,呈单房或多房性囊性,主胰管或分支胰管不同程度扩张,囊内常见条索状分隔、乳头样壁结节,分隔及壁结节可见强化[13]。③实性假乳头状瘤,好发于年轻女性,通常表现为囊实性混合性肿块,多有完整包膜,囊内可见斑片状实性成分,也可表现为囊实性,囊壁可见壁结节、乳头状突起;出血较常见,增强扫描实性部分呈渐进性强化[14-16]。
综上所述,SMCA多表现为多囊分叶状低密度结节或肿物,边界清楚,具有多发囊腔,囊腔之间可见分隔,增强扫描纤维分隔可见强化,低于胰腺组织,常见纤维瘢痕,分析其影像学特征,可提高诊断准确率。
