二十二碳六烯酸对早产儿主要并发症的预防价值的研究
2019-02-10饶红萍周玉祥
饶红萍 周玉祥
【摘要】 目的:评价早产儿补充二十二碳六烯酸(DHA)对支气管肺发育不良(BPD)、新生儿坏死性小肠结肠炎(NEC)和新生儿败血症发生率的影响。方法:选取胎龄≤32周的早产儿106例,按随机数字表法分成试验组(n=52)和对照组(n=54)。在第一次肠内喂养后,试验组提供60 mg/(kg·d)的DHA,对照组提供相同剂量饮用水,均到纠正胎龄36周或治愈出院时。比较两组的BPD、NEC、新生儿败血症发生率、死亡率及相关临床资料。结果:试验组BPD、NEC及新生儿败血症的发生率、住院、总机械通气及氧疗时间均少于对照组(P<0.05);两组死亡率比较,差异无统计学意义(P>0.05)。结论:早产儿补充DHA可降低BPD、NEC及新生儿败血症的发生率,但不能降低病死率。
【关键词】 二十二碳六烯酸 早产儿 支气管肺发育不良 新生儿坏死性小肠结肠炎 新生儿败血症
[Abstract] Objective: To evaluate the effect of docosahexaenoic acid (DHA) supplementation on the incidence of bronchopulmonary dysplasia (BPD), necrotizing enterocolitis (NEC) and neonatal sepsis in preterm infants. Method: A total of 106 premature infants with gestational age ≤32 weeks were selected and divided into experimental group (n=52) and control group (n=54) according to the random number table method. After the first enteral feeding, the experimental group was given DHA of 60 mg/(kg·d), the control group was given the same amount of drinking water until the postmenstrual age 36 weeks or the time of discharge was cured from the hospital. The incidence of BPD, NEC, neonatal sepsis, mortality and relevant clinical data were compared between the two groups. Result: The incidence of BPD, NEC and neonatal sepsis, hospitalization, total mechanical ventilation and oxygen therapy duration in the experimental group were all lower than those in the control group (P<0.05). There was no significant difference in mortality between the two groups (P>0.05). Conclusion: DHA supplementation in premature infants may reduce the incidence of BPD, NEC and neonatal sepsis, but not reduce the mortality rate.
随着新生儿救治技术水平的提高,危重早产儿尤其是极低出生体重儿(VLBW)和超低出生体重儿(ELBW)存活率明显升高,但多伴随并发症,胎龄≤32周且出生体重低于1 500 g的早产儿约四分之一合并BPD,NEC威胁着5%~10% VLBW的生命和长期健康,新生儿败血症也有显著的发生率及病死率[1]。如何降低早产儿的这些并发症,提高生存质量,成了一项重要的工作。DHA是一种n-3长链多不饱和脂肪酸(LCPUFAs),是正常生长、视力、神经发育和整体健康所必需的[2]。既往的研究多侧重DHA促进婴幼儿视觉功能及脑发育方面,但DHA某些代谢产物也有生物活性,可保护机体免受氧化损伤,具有调节免疫反应及心血管功能、抗氧化、抗炎、抗肿瘤等多种功能[3-6]。理论上,早产儿特别是胎龄≤32周早产儿加入适量的DHA可抑制炎症反应,国外越来越多的研究证明LCPUFA,包括DHA对BPD、新生儿败血症、NEC有防治作用,但目前国内同类的研究非常少[2,7-8]。本研究就是为了证实早产儿加入适量的DHA可降低BPD、新生儿败血症、NEC的发生率,现报道如下。
1 资料与方法
1.1 一般资料 选取2017年9月-2018年9月本院新生儿重症病区收治的早产儿106例。纳入标准:胎龄≤32周;出生体重<1 500 g;生后24 h内入院。排除标准:出生即有先天性疾病、染色体疾病、遗传性疾病、消化道畸形等者。按随机数字表法分成试验组(n=52)和对照组(n=54)。所有家属均知情同意并签署知情同意书,本研究已经医院伦理委员会批准。
1.2 方法 在第一次肠内喂养后,试验组提供60 mg/(kg·d)的DHA,對照组提供相同剂量的饮用水,均直到纠正胎龄(PMA)36周或治愈出院时。当因各种原因需要禁食时,同时停止提供DHA或饮用水。营养方案按照2013年发表的中国新生儿营养支持临床应用指南执行[9]。其余治疗均按早产儿常规综合治疗。
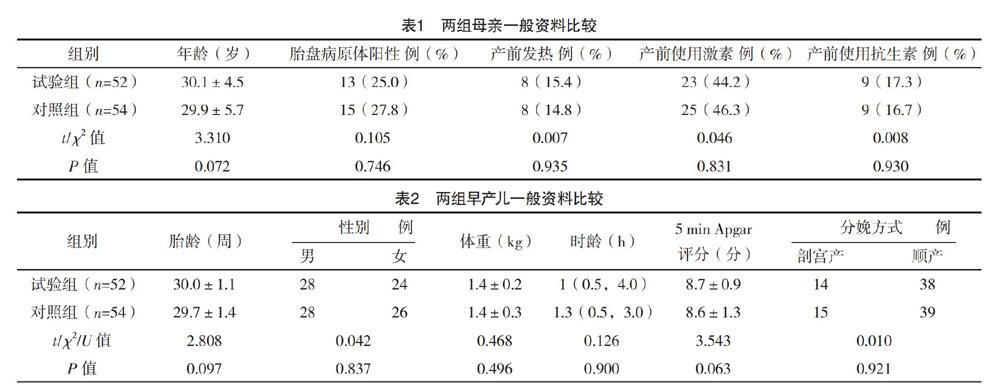
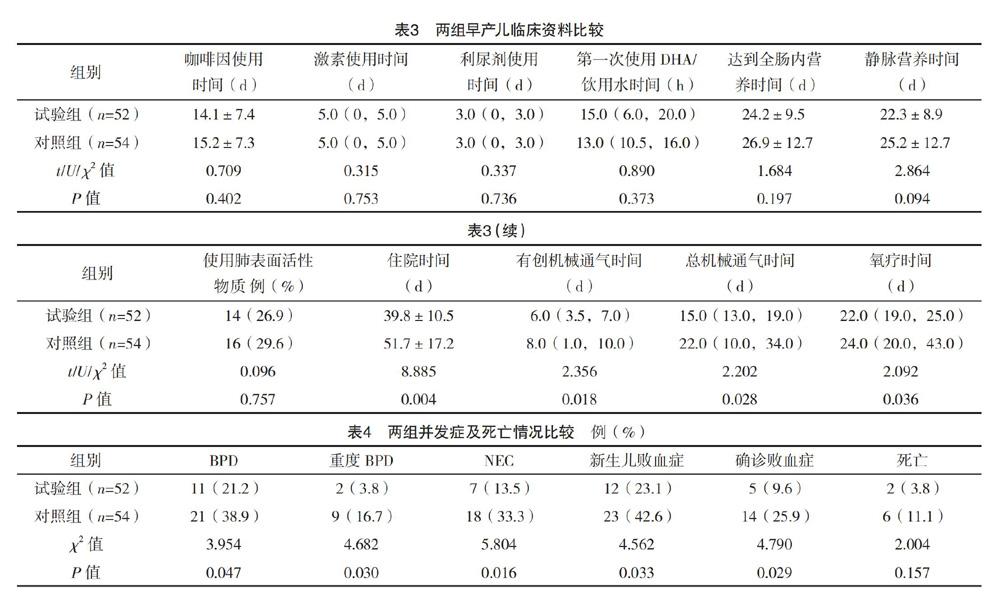
1.3 观察指标 (1)入院后收集两组一般资料,母亲包括年龄、胎盘病理、产前发热情况、产前使用激素、产前使用抗生素情况。早产儿包括胎龄、性别、体重、时龄、分娩方式及5 min Apgar评分。(2)在PMA 36周或治愈出院(以先到的为准)时比较两组早产儿临床资料,包括咖啡因使用时间、激素使用时间、肺表面物质的使用例数、利尿剂使用时间、第一次使用DHA/饮用水的时间、达到全肠内营养时间、静脉营养时间、住院时间、有创机械通气时间、总机械通气时间(有创+无创机械通气时间)、氧疗时间。(3)比较两组并发症及死亡情况。包括BPD、重度BPD、NEC、确诊败血症、新生儿败血症(初步诊断+确诊)及死亡。
1.4 诊断标准 NEC、新生儿败血症、确诊败血症诊断标准参照第八版儿科学[10]。BPD诊断标准参照2000年6月由NICHD和国家心脏、肺和血液研究院及少见疾病委员会举办的研讨会上制定的定义,指任何氧依赖(>21%)超过28 d的新生儿,如胎龄<32周,根据PMA 36周或出院前需FiO2分为轻度(未用氧)、中度(FiO2<30%)及重度(FiO2≥30%或需机械通气)[11]。
1.5 统计学处理 采用SPSS 13.0软件对所得数据进行统计分析,计量资料组间比较前先进行正态性检验和方差性检验,正态性分布的计量资料用(x±s)表示,比较采用t检验,非正态分布的计量资料用[M(P25,P75)]表示,采用Mann-Whitney U检验;计数资料以率(%)表示,比较采用字2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 两组母亲与早产儿一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1、2。
2.2 两组早产儿临床资料比较 两组咖啡因使用时间、激素使用时间、利尿剂使用时间、第一次使用DHA/饮用水时间、达到全肠内营养时间、静脉营养时间、肺表面物质的使用率比较,差异均无统计学意义(P>0.05);试验组住院时间、总机械通气时间、有创机械通气时间、氧疗时间均短于对照组,差异均有统计学意义(P<0.05)。见表3。
2.3 两组并发症及死亡情况比较 试验组BPD、重度BPD、NEC、新生儿败血症及确诊败血症发生率均低于对照组(P<0.05),两组死亡率比较,差异无统计学意义(P>0.05),见表4。
3 讨论
新生儿妊娠晚期DHA在胎儿体内累积量>50 mg/(kg·d),对早产儿相当于饮食中DHA占总脂肪酸含量的1%,出生后不再经胎盘提供LCPUFAs,致使早产儿LCPUFAs储存不足[12]。早产儿由于发育不够成熟,脂肪储存减少,前体脂肪酸转化率低,将α-亚油酸(ALA)合成DHA的能力也十分有限[13],致使自身储存少,低于足月儿10%[14]。早产儿出生后DHA的营养供应也常常不足,母乳中含有少量DHA,现在早产儿配方奶也常规补充DHA,但尽管有补充,不管母乳还是配方奶,在达到完全肠内喂养后才能达到42~75 mg/(kg·d)的提供量,且仅有80%DHA被肠道吸收[15-17]。如果通过胃管连续滴注方法喂养会进一步减少脂肪的供应,这可能因为是油脂黏附在胃管上,鉴于以上这些因素,肠内剂量需要大约65 mg/(kg·d),才能满足早产儿需求[18-19]。更何况早产儿常出现喂养不耐受或采用肠外营养,不能通过母乳或配方奶持续摄入DHA。所以大多数情况下早产儿难以满足自身生理需求,需要从食物补充DHA,世界卫生组织推荐每日摄入200~500 mg的DHA以预防某些慢性疾病[20]。
BPD的特点是肺弥漫性纤维化和肺泡发育障碍。虽然其发病机制是多因素的,但子宫内和产后生长受限是一个独立的危险因素,可能通过影响肺泡和血管生长来实现[21]。研究表明,n-3 LCPUFAs似乎通过DHA激活过氧化物酶体增殖物,激活受体途径,产生环氧化物而有益于肺动脉高压,从而防止肺损伤或降低BPD的严重程度,进而加速肺成熟、肺细胞生长以及血管增生[2]。DHA也有能力通过多种途径影响免疫应答来降低BPD、NEC的发生率或严重程度[22]。早产儿易患败血症,可能是先天性免疫反应减弱的结果[23]。在高氧诱导的肺损伤大鼠模型中,DHA的补充可减少幼鼠的白细胞浸润,抑制核因子(NF-kB)的激活,从而可能调节不适当的炎症反应,保护新生儿免受高氧引起的肺损伤[24-25]。这些病理生理学现象,与观察到的低DHA浓度与早产儿脓毒症发病率增加之间的关系一致。NEC的发病机制也是多因素的,与上述其他新生儿合并症一样,许多炎症介质似乎在疾病进展中起作用。几种围手术期的NEC模型显示,LCPUFA通过与肠炎症和坏死相关的多种途径调节肠病发病率和严重程度的降低[11,26-27]。所以越来越多证据证明,DHA可以通过影响免疫和抗炎反应的不同步骤来降低BPD、NEC、败血症发生率或严重程度[2,28]。
在本研究中也证实早产儿补充DHA可能降低BPD、NEC、新生儿败血症的发生率。本研究中试验组BPD、重度BPD、NEC、新生儿败血症及确诊败血症发生率均低于对照组(P<0.05)。试验组住院时间、总机械通气时间、有创机械通气时间、氧疗时间均短于对照组(P<0.05)。Makrides等[29]一项大型随机试验就是DHA预防BPD的最好证据,该试验评估60 mg/(kg·d)的DHA和标准剂量20 mg/(kg·d)的DHA对657例早产儿神经发育结局的影响,该研究并非旨在检测BPD,但在小于29周的婴儿亚组的探索性分析中,在纠正胎龄36周时需要补充氧气的婴儿中有显著的恢复。另一个60例極低出生体重儿的双盲、随机对照试验中干预组BPD发生率为13.3%,对照组为36.7%(P=0.04),干预组呼吸机支持和氧利用率明显低于对照组(P<0.05),虽然研究中没有直接检测败血症及的发生率,但炎症介质白细胞介素-1b及白介素-6水平的比较也有显著的意义[30]。而国内的一项荟萃分析研究也表明早产儿补充DHA可能降低胎龄≤30周早产儿NEC的发生率[31]。本研究两组死亡率比较,差异无统计学意义(P>0.05),Collins等[32]针对1 273名29周以下早产儿的研究也是认为补充DHA不能改变死亡率,这与本研究是一致的,但是该研究中认为补充DHA同样不能减少BPD、NEC、新生儿败血症的发生率,这与本研究有出入。究其原因,可能与样本量较少,也可能因为未对纳入的早产儿进行年龄分层统计,也可能因为DHA的最适剂量以及用法的不确定性。
未来尚需要前瞻性多中心大样本分年龄层次的更大规模、更科学严谨的研究解决这些问题,使得早产儿健康能够得到最大化的改善。
参考文献
[1] Wemh?ner A,Ortner D,Tschirch E,et al.Nutrition of preterm infants in relation to bronchopulmonary dysplasia[J].BMC Pulm Med,2011,11:7.
[2] Harris W S,Baack M L.Beyond building better brains:bridging the docosahexaenoic acid(DHA)gap of prematurity[J].J Perinatol,2015,35(1):1-7.
[3] De Mel D,Suphioglu C.Fishy Business:Effect of omega-3 fatty acids on zinc transporters and free zinc availability in human neuronal cells[J].Nutrients,2014,6(8):3245-3258.
[4]程燕,黄玉莎,王斌.二十二碳六烯酸神经保护作用的研究进展[J].实用药物与临床,2015,18(6):721-724.
[5] Zhang P,Lavoie P M,Lacaze-Masmonteil T,et al.0mega-3 long-chain polyunsaturated fatty acids for extremely preternl infaIlts:a systematic review[J].Pediatrics,2014,134(1):120-134.
[6] Qawasmi A,Landeros-Weisenberger A,Leckman J F,et al.Meta-analysis of Long-Chain Polyunsaturated Fatty Acid Supplementation of Formula and Infant Cognition[J].Pediatrics,2012,129(6):1141-1149.
[7] Martin C R,Dasilva D A,Cluette-Brown J E,et al.Decreased postnatal docosahexaenoic and arachidonic acid blood levels in premature infants are associated with neonatal morbidities[J].J Pediatr ,2011,159(5):743-749.
[8] Joss-Moore L A,Wang Y,Baack M L,et al.IUGR decreases PPARgamma and SETD8 Expression in neonatal rat lung and these effects are ameliorated by maternal DHA supplementation[J].Early Hum Dev,2010,86(12):785-791.
[9] Rogers L K,Valentine C J,Pennell M,et al.Maternal docosahexaenoic acid supplementation decreases lung inflammation in hyperoxia-exposed newborn mice[J].J Nutr,2011,141(2):214-222.
[10] Rehan V K,Sakurai R,Corral J,et al.Antenatally administered PPAR-gamma agonist rosiglitazone prevents hyperoxia-induced neonatal rat lung injury[J].Am J Physiol Lung Cell Mol Physiol,2010,299(5):672-680.
[11] Ohtsuka Y,Okada K,Yamakawa Y,et al.omega-3 fatty acids attenuate mucosal inflammation in premature rat pups[J].J Pediatr Surg,2011,46(3):489-495.
[12] Lu J,Jilling T,Li D,et al.Polyunsaturated fatty acid supplementation alters proinflammatory gene expression and reduces the incidence of necrotizing enterocolitis in a neonatal rat model[J].Pediatr Res,2007,61(4):427-432.
[13]中華医学会肠外肠内营养学分会儿科协作组,中华医学会儿科学分会新生儿学组,中华医学会小儿外科学分会新生儿学组.中国新生儿营养支持临床应用指南[J].中华小儿外科杂志,2013,34(10):782-787.
[14]王卫平.儿科学[M].8版,北京:人民卫生出版社,2013:127-128.
[15] Jobe A H,Bancalari E.Bronchopulmonary dysplasia[J].Am J Respir Crit Care Med,2001,163(7):1723-1729.
[16]曹云.营养与早产儿神经发育结局[J].临床儿科杂志,2012,30(3):208-211.
[17] Foreman-van D M,van Houwelingen A C,Kester A D,et al.Long-chain polyunsaturated fatty acids in preterm infants:status at birth and its influence on postnatal levels[J].J Pediatr,1995,126(4):611-618.
[18] Lapillonne A,Groh-Wargo S,Gonzalez C H,et al.Lipid needs of preterm infants:updated recommendations[J].J Pediatr,2013,162(3 Suppl):37-47.
[19] Kuipers R S,Luxwolda M F,Offringa P J,et al.Fetal intrauterine whole body linoleic,arachidonic and docosahexaenoic acid contents and accretion rates[J].Prostaglandins Leukot Essent Fatty Acids,2012,86(1-2):13-20.
[20] Silva V,Barazzoni R,Singer P.Biomarkers of Fish Oil Omega-3 Polyunsaturated Fatty Acids Intake in Humans[J].Nutrition in Clinical Practice,2014,29(1):63-72.
[21] Poindexter B B,Feng R,Schmidt B,et al.Comparisons and limitations of current definitions of bronchopulmonary dysplasia for the prematurity and respiratory outcomes program[J].Ann Am Thorac Soc,2015,12(12):1822-1830.
[22] Waitzberg D L,Torrinhas R S.Fish oil lipid emulsions and immune response:what clinicians need to know[J].Nutr Clin Pract,2009,24(4):487-499.
[23] Marchant E A,Kan B,Sharma A A,et al.Attenuated innate immune defenses in very premature neonates during the neonatal period[J].Pediatr Res,2015,78(5):492-497.
[24] Rogers L K,Valentine C J,Pennell M,et al.Tipple TE:Maternal DHA supplementation decreases lung inflammation in hyperoxia-exposed newborn mice[J].J Nutr,2011,141(2):214-222.
[25] Sharma D,Nkembi A S,Aubry E,et al.Maternal PUFA ω-3 Supplementation Prevents Neonatal Lung Injuries Induced by Hyperoxia in Newborn Rats[J].Int J Mol Sci,2015,16(9):22081-22093.
[26] Caplan M S,Russell T,Xiao Y,et al.Effect of polyunsaturated fatty acid(PUFA)supplementation on intestinal inflammation and necrotizing enterocolitis(NEC)in a neonatal rat model[J].Pediatr Res,2001,49(5):647-652.
[27] Lin P W,Stoll B J.Necrotising enterocolitis[J].Lancet,2006,368(9543):1271-1283.
[28] Lapillonne A,Moltu S J.Long-Chain Polyunsaturated Fatty Acids and Clinical Outcomes of Preterm Infants[J].Ann Nutr Metab 2016,69(Suppl 1):36-44.
[29] Makrides M,Gibson R A,McPhee A J,et al.Neurodevelopmental outcomes of preterm infants fed high-dose docosahexaenoic acid:a randomized controlled trial[J].JAMA,2009,301(2):175-182.
[30] Hsiao C C,Lin H C,Chang Y J,et al.Intravenous fish oil containing lipid emulsion attenuates inflammatory cytokines and the development of bronchopulmonary dysplasia in very premature infants:A double-blind,randomized controlled trial[J].Clinical Nutrition,2019,38(3):1045-1052.
[31]王潛,崔其亮,严彩满.早产儿补充长链多不饱和脂肪酸对支气管肺发育不良和坏死性小肠结肠炎发生率影响的系统评价和Meta分析[J].中国循证儿科杂志2015,10(6):419-425.
[32] Collins C T,Makrides M,McPhee A J,et al.Docosahexaenoic Acid and Bronchopulmonary Dysplasia in Preterm Infants[J].N Engl J Med,2017,376(13):1245-1255.
(收稿日期:2019-04-12) (本文编辑:田婧)
