响应曲面分析法优化常用水解酶荧光测试法研究
2019-02-10贾淑娴康晓慧郭剑芬刘捷豹
贾淑娴,康晓慧,郭剑芬,刘捷豹*
(福建师范大学 a.地理科学学院,b.湿润亚热带山地生态国家重点实验室培育基地,福州 350007)
0 引言
土壤酶是土壤中最活跃的有机成分之一,主要来源于土壤微生物分泌、植物根系分泌等。大部分酶是具有高催化活性的蛋白质[1-3],其活性直接反映微生物的营养需求和土壤中碳、氮、磷营养要素分解的方向和强度[4, 5],以及土壤生态系统的变化。因此了解土壤酶活性对认识微生物的功能及土壤生化循环具有重要的意义[6-7]。土壤酶受到矿物胶体和腐殖质的强烈吸附作用,目前很难被提取出来并直接测定。当前用于测定土壤水解酶活性的实验原理有两种,一是根据一定量底物在酶催化反应过程中的生成物或剩余底物量间接测得的,二是测定单位时间内酶催化的化学反应量。常用测定土壤酶活性的具体方法有4种:分光光度法、荧光分析法、同位素测定法和电化学方法[8-10]。20世纪50年代至今,经过多年的发展,土壤酶活性荧光测定法得到了认可,在此基础上发展起来的微孔板荧光测定法因为灵敏、便捷而得到了广泛的应用[11]。但是,传统滴定方法测量的土壤酶活性和荧光法得到的结果之间无法直接对比,并且土壤的异质性以及取样后的不确定性可能会导致土壤酶活性的测试结果出现不确定性,比如Junichiro等[12]研究发现,干燥和冷藏对β-葡糖苷酶活性影响显著,而German等[13]综述了土壤酶测定过程中的注意要点等。因此,使用荧光法测量土壤酶活性需提上议程,并且如何快速、准确地测定酶活性成为重要的生态学问题。由于土壤团聚中有机胶体与黏粒的相互复合是一个复杂的物理化学过程,而且各实验室的设备各有特色,所以酶活性测定实验的前处理手段并不统一。国际上采用高速破壁机来破坏土壤团聚体[11,14],但高速剪切可能会使土壤蛋白质变性;目前越来越多的实验开始采用低功率超声波破碎法来进行预处理[15]。该方法的优点是能够使土壤团聚体充分崩解、促进样品均质化,提高酶活性测试的效率。但是每台超声破碎机一次只能处理一个样品,如果没有合理安排样品处理时间和顺序的话,这种方法可能会人为地导致实验误差变大。此外,采用Saiya-cork试验方法的文章[14],样品在添加底物后的培育时间一般为4 h,但也有方法采用了2 h[15]和1h[16]的培育时间。可见培育时间对于结果的影响可能较大,也是影响实验结果的一个重要因素。在测定土壤酶活性时,国际上一般用悬浮液,但是澄清液对实验结果的影响未见报道。因此有必要对影响土壤酶活性的几个因素进行综合研究探讨,为准确测定酶活性提供实验依据。国际上常测定的4种水解酶包括β-葡糖苷酶(βG)和纤维素二糖水解酶(CBH)(C需求)、β-N-乙酰氨基葡萄糖苷酶(NAG, N需求)和酸性磷酸酶(AP, P需求)[17]。响应面法(Response Surface Methodology,RSM)是一种综合实验设计和数学建模的优化方法,其具有实验次数少、周期短、精密度高、求得回归方程精度高、预测性能好,支持多种因素间交互作用分析等优点[18-19],目前已在众多实验优化设计中得到应用。因此,本实验以这4种水解酶为研究对象,通过设定3个因素,即高速磁力搅拌法替代超声波破碎法对土壤样品进行不同搅拌时间的前处理、不同的培育时间、不同状态的悬浮液,采用响应面分析法优化土壤中4种常用水解酶活性的荧光测定法,研究森林土壤酶测定的最优方式,以期能找到一种方便快捷的样品处理方式,提高酶活性荧光测定法的效率,为森林土壤酶活性研究提供技术参考。
1 材料与方法
1.1 试验地概况与土样采集
试验地位于福建省西北部顺昌县的武坊林场(117°29′~118°14′E,26°38′~27°12′N)。该地属亚热带海洋性季风气候,多年平均降水量为1 600~1 800 mm,多年平均气温为18.5 ℃。土壤类型属于红壤。在该试验地的天然常绿阔叶林和杉木人工林内各设3块20 m × 20 m样方,其中常绿阔叶林样地编号为N1、N2和N3,杉木林样地编号为P1、P2和P3。天然常绿阔叶林海拔为200~290 m,优势种为壳斗科、樟科、山茶科、木兰科等树种,群落外貌多为常绿,一般呈暗绿色,林相整齐,树冠多不连续;杉木人工林海拔高度约为240~250 m,优势种为杉木,群落外貌整齐,呈深绿或灰绿色,植株分布均匀,高度一致。在每个样方内采用5点取样法,用土钻采集0~10 cm矿质土壤,混合均匀,用无菌塑封袋密封后存于低温保鲜箱中并运回实验室。
1.2 数据来源
表 1 因素水平Table 1 Experimental design of response surface analysis

水平因素A 搅拌时间/minB 静置时间/minC 培育时间/h-11003020154130305
表 2 4种土壤水解酶及其常用底物Table 2 Four kinds of soil hydrolase and their common substrates
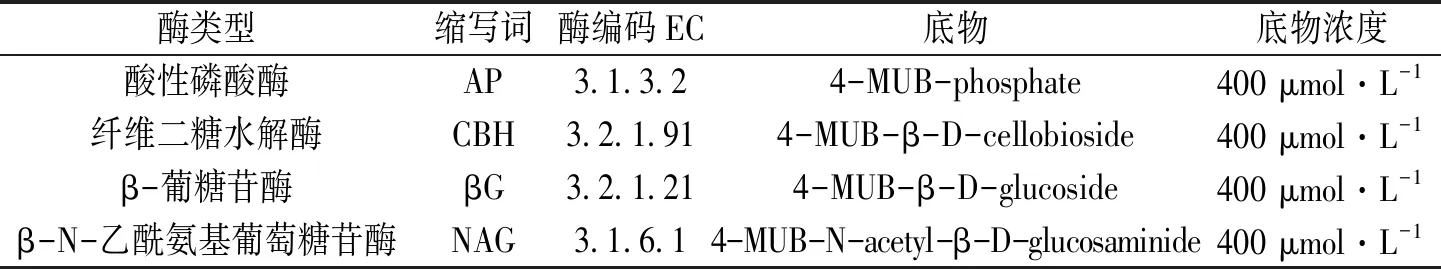
酶类型缩写词酶编码EC底物底物浓度酸性磷酸酶AP3.1.3.24-MUB-phosphate400 μmol·L-1纤维二糖水解酶CBH3.2.1.914-MUB-β-D-cellobioside400 μmol·L-1β-葡糖苷酶βG3.2.1.214-MUB-β-D-glucoside400 μmol·L-1β-N-乙酰氨基葡萄糖苷酶NAG3.1.6.14-MUB-N-acetyl-β-D-glucosaminide400 μmol·L-1
根据DeForest等、Sinsabaugh等人的研究结果[20-21]在前期单因素实验的基础上,试验探究3种因素,即搅拌时间、静置时间和样品培育时间对酶活性结果的影响。根据Box-Behnken中心组合实验设计,进行三因素三水平的实验设计,测定酶活性的变化。根据软件Design-Expert 8.0.6设计确定实验方案,获得土壤水解酶荧光法测试的最优处理(表1、2)。本研究涉及4种常见水解酶及底物(表2),采用Synergy H4多功能酶标仪测定水解酶的活性。
1.3 实验方法
在酶活性测定前,将土样混匀后过2 mm筛,置于4 ℃冰箱中冷藏保存。参照Saiya-Cork[13]和Sinsabaugh[21]的研究方法测定4种常见水解酶的活性。先取0.8 g过筛鲜土加入到150 mL 50 mM的醋酸缓冲液(pH=5.0)中,根据实验设计,用磁力搅拌机连续搅拌(时间设置为3个梯度),使其均质化,然后静置(时间设置为3个梯度)后,用移液器取其上清液(或悬浮液)200 μL移入96微孔板,每个样品有8个重复(200 μL样品+50 μL底物),每次检验都以8个阴性对照(200 μL醋酸缓冲液+50 μL底物)、8个空白(200 μL样品+50 μL醋酸缓冲液)和8个淬火标准液(200 μL醋酸缓冲液+50 μL标准液)为对照和校正。加完所有样品后,将微孔板盖上盖置于20 ℃培养箱中,黑暗培育(时间设置为3个梯度)。最后取出微孔板,迅速在每个微孔加入10 μL NaOH (1.0 mM)使反应停止。在反应停止的1 min内,在多功能酶标仪中检测样品荧光度(在365 nm下激发,450 nm下检测荧光值)。
1.4 数据处理
使用SPSS 19.0进行方差分析,使用Origin 9.0软件进行绘图,通过Design-Expert 8.0.6软件进行响应面设计及优化。
2 结果与分析
2.1 搅拌时间和培育时间对土壤水解酶活性的影响
在不同的搅拌时间下,AP酶活性随着培育时间而发生波动(图1a)。样品经过搅拌20 min和30 min后,在不同的培育时间梯度上AP酶活性波动较大,而经过10 min搅拌前处理的酶活性在时间梯度上波动变化较前二者稳定。培育时间在6 h以内,搅拌10 min时测得AP酶活性最高,且搅拌30 min,培育时间4 h,AP酶活性接近最大值,为2 499 nmol·h-1·g-1,超过4 h后酶活性下降;AP酶活性在搅拌20 min,培育时间3.5 h时达到最大值,为2 117 nmol·h-1·g-1,而后随着培育时间增加,酶活性曲线呈现下降趋势。此外,AP酶活性在培育时间为5.5 h,搅拌时间为20、30 min时达到最低值(图1a)。
在培育4 h时,搅拌10、30 min时CBH酶活性达到最大值,分别为67和48 nmol·h-1·g-1。而在搅拌时间20 min,培育时间为3 h时CBH酶活性达到最大值46 nmol·h-1·g-1。此外,培育时间在3.5~5 h时,搅拌时间为10 min时CBH酶活性高于其他搅拌时间(图1b)。
搅拌时间和培育时间对βG酶活性影响的3条曲线虽然波动性很大,但是整体呈上升趋势(图1c),且在培育4 h,搅拌时间为10、20 min时检测到βG酶活性出现第一个峰值,分别为169、238 nmol·h-1·g-1,虽然由于曲线波动过大,不易找到各培育时间段中最适合的搅拌时间,但可以看出当搅拌时间为10 min,培育时间为3~5 h,βG酶活性比其他2个搅拌时间下βG酶活性更低。
在NAG酶活性变化图中,3条曲线的趋势比较相似(图1d)。3个不同搅拌时间下,在培育时间6 h时均达到最大值,分别为202、231、218 nmol·h-1·g-1。在培育时间为3~5 h时,搅拌时间10 min与20 min对其酶活性的影响比较小,在78~164 nmol·h-1·g-1范围内波动。
因此,根据搅拌时间和培育时间对上述4种水解酶活性的影响结果,以及各参考文献中所采用的培育时间,本实验将“培育时间”这一影响因素的范围设定为3~5 h。
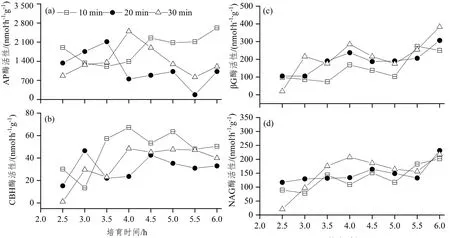
图 1 不同搅拌时间和培育时间对土壤酶活性的影响Figure 1 Effects of different stirring time and incubation time on soil enzyme activity
表 3 土壤水解酶的模型方差参数Table 3 Model variance parameters of soil hydrolases
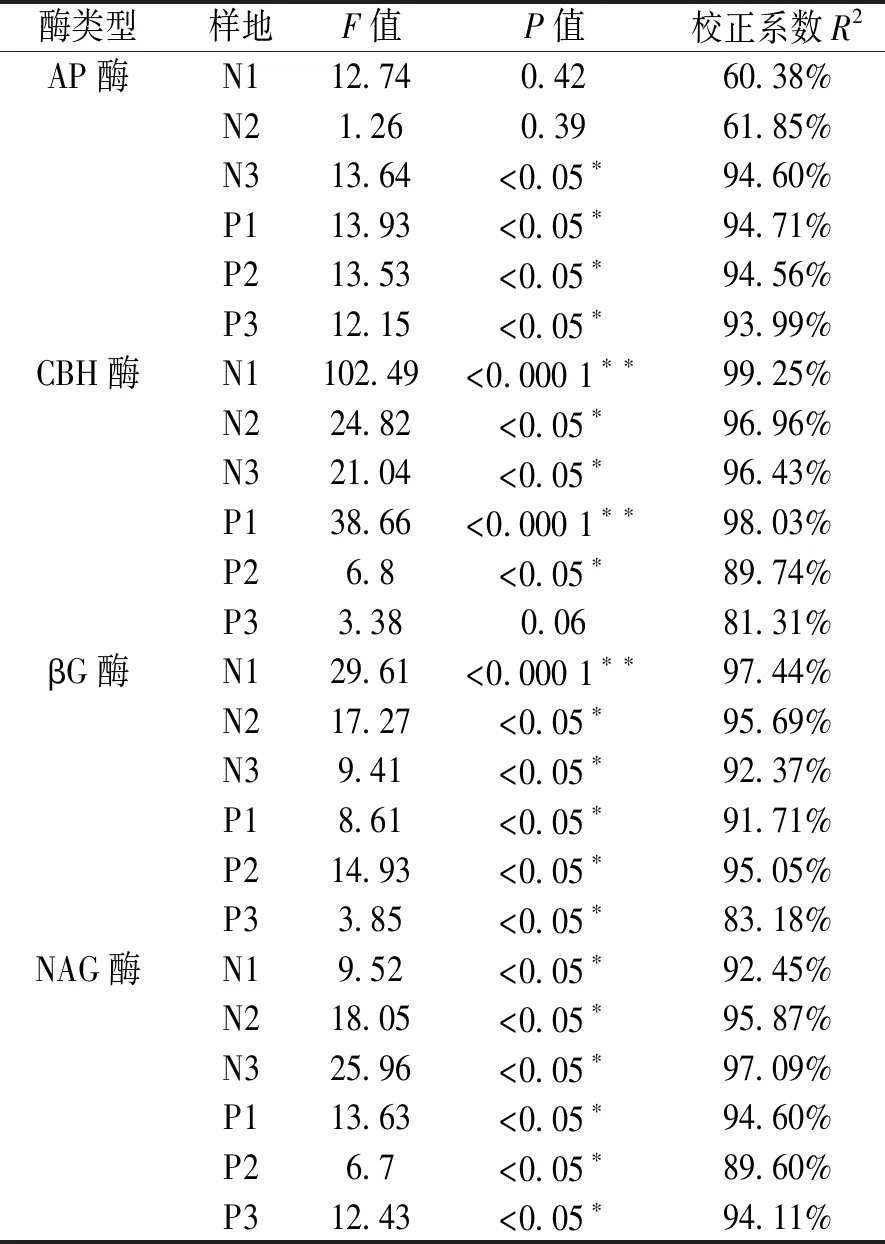
酶类型样地F值P值校正系数R2AP酶N112.740.4260.38%N21.260.3961.85%N313.64<0.05∗94.60%P113.93<0.05∗94.71%P213.53<0.05∗94.56%P312.15<0.05∗93.99%CBH酶N1102.49<0.000 1∗∗99.25%N224.82<0.05∗96.96%N321.04<0.05∗96.43%P138.66<0.000 1∗∗98.03%P26.8<0.05∗89.74%P33.380.0681.31%βG酶N129.61<0.000 1∗∗97.44%N217.27<0.05∗95.69%N39.41<0.05∗92.37%P18.61<0.05∗91.71%P214.93<0.05∗95.05%P33.85<0.05∗83.18%NAG酶N19.52<0.05∗92.45%N218.05<0.05∗95.87%N325.96<0.05∗97.09%P113.63<0.05∗94.60%P26.7<0.05∗89.60%P312.43<0.05∗94.11%
注:*显著性差异(P<0.05);**极显著性差异(P<0.001)。
2.2 响应面法优化测试方法
采用Design-Expert 8.0.6软件对实验结果进行分析,得到每个样地中每种酶模型的方差分析表(表3)。实验结果表明,N1、N2样地中AP酶和P3样地中CBH酶的模型显示结果不显著,其他模型结果均显著。
以样品土壤的最高酶活性为目标,以搅拌时间、静置时间和培育时间为优化对象,利用Design-Expert 8.0.6软件对上述模型进行了优化处理,将实验数据代入到软件中可得到实验最优的处理方案(表4)。结果表明,在酶活性测试中,静置时间为0 h效果最佳,即,使用保持搅拌状态下的悬浊液可以使96微孔板中的土壤样品获得最高的酶活性。这也从另外一个方面说明,土壤酶与腐殖质、胶体等结合紧密。而对于培育时间而言,实验发现4 h是最佳的。不同水解酶的最适搅拌时间略有差异,分别是:AP酶搅拌12.02 min时可以得到酶活性最大值;CBH酶搅拌14.3 min时可以得到酶活性最大值;βG酶搅拌19.6 min时可以得到酶活性最大值;NAG酶搅拌20.03 min时可以得到酶活性最大值。因为测量土壤酶活性时,一个土壤样品经过处理后会同时测定这4种酶的活性,所以取最优搅拌时间为16.48 min。
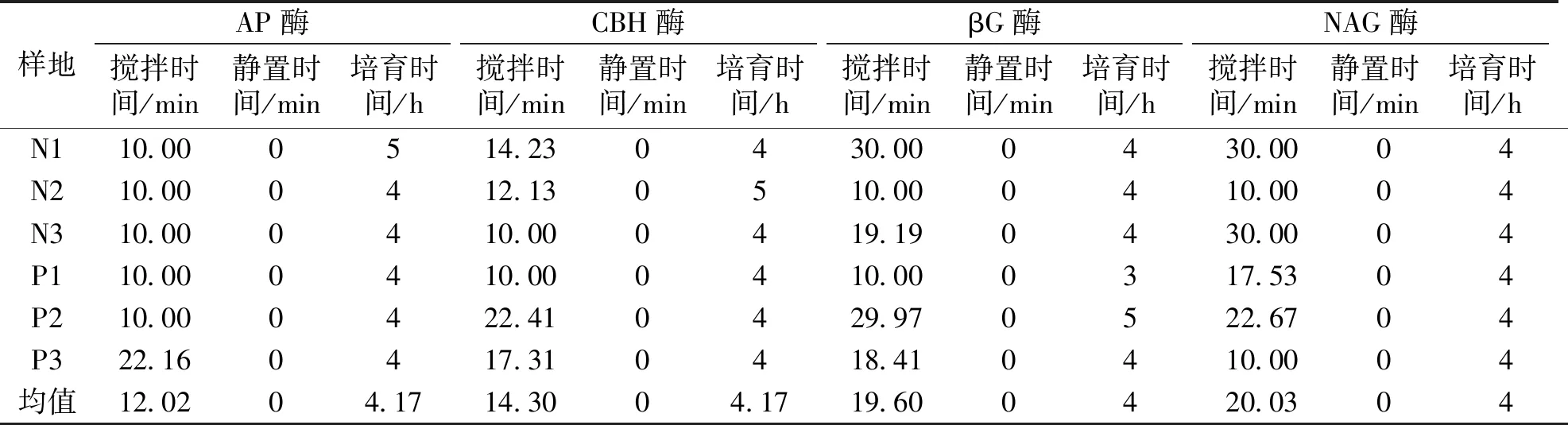
表 4 最佳处理时间参数Table 4 Optimal processing time parameter
根据上述结果,可以确定静置时间最佳效果是0 min,在这个结果之下,根据软件可以绘制出搅拌时间及培育时间双因子效应分析图(图2~图5)。2个因素之间的影响几乎没有极大值点,变化趋势一直在增加。从图2可以看出,不同搅拌时间下,在N1、P3中,培育时间一定的条件下,AP酶活性随着搅拌时间的增加表现为先增加后降低;在N2中,AP酶活性随着培育时间的延长呈现出先增加后降低的趋势,在搅拌时间为20 min,培育时间为4 h时,AP酶活性最高;而在P2中,AP酶活性则呈现出现随搅拌时间增加的趋势。由图3得出,N1、N2、N3的CBH酶活性在不同的搅拌时间下无显著差异,而P2、P3的CBH酶活性随着搅拌时间的变化表现为先增加后降低。N3、P2、P3中,培育4 h时,βG酶活性达到最大值。此外,在N1中,随着搅拌时间和培育时间的延长,NAG酶活性增加;在P1中,在搅拌时间一定的情况下,随着培育时间的增加,NAG酶活性出现先增加后降低的趋势,而P1、P2在培育时间一定的条件下,NAG酶活性随着搅拌时间的变化表现为先增加后降低。
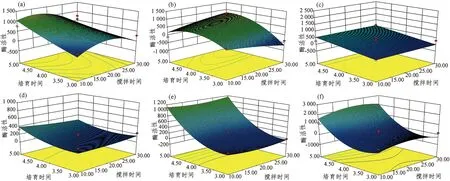
图 2 搅拌时间和培育时间对不同土壤AP酶活性影响的响应曲面Figure 2 Response surfaces of soil AP enzyme activity influenced by stirring time and incubation time
2.3 对比实验
根据实验结果得出的最优参数方案——搅拌时间16.48 min、静置时间0 min、培育时间4 h,与当前常用的低功率超声波预处理法进行对比实验(表5)。结果显示2种方法测到酶活性的sig值均大于0.05,差异不显著。因此,2种土壤的预处理方法对实验影响差别不大,说明在有限的实验室条件下采用相对便捷、成本低的搅拌机破碎法,并结合本研究的优化方案进行酶活性测定的前处理亦能得出较好的实验结果。
在最优参数条件下,将天然常绿阔叶林与杉木人工林的土壤水解酶活性进行对比检验实验,结果显示两种样地的土壤样品sig值大于0.05,证明林分因素对实验结果没有显著影响。
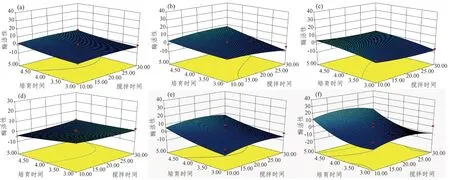
图 3 搅拌时间和培育时间对不同土壤CBH酶活性影响的响应曲面Figure 3 Response surfaces of soil CBH enzyme activity influenced by stirring time and incubation time

图 4 搅拌时间和培育时间对不同土壤βG酶活性影响的响应曲面Figure 4 Response surfaces of soil βG enzyme activity influenced by stirring time and incubation time
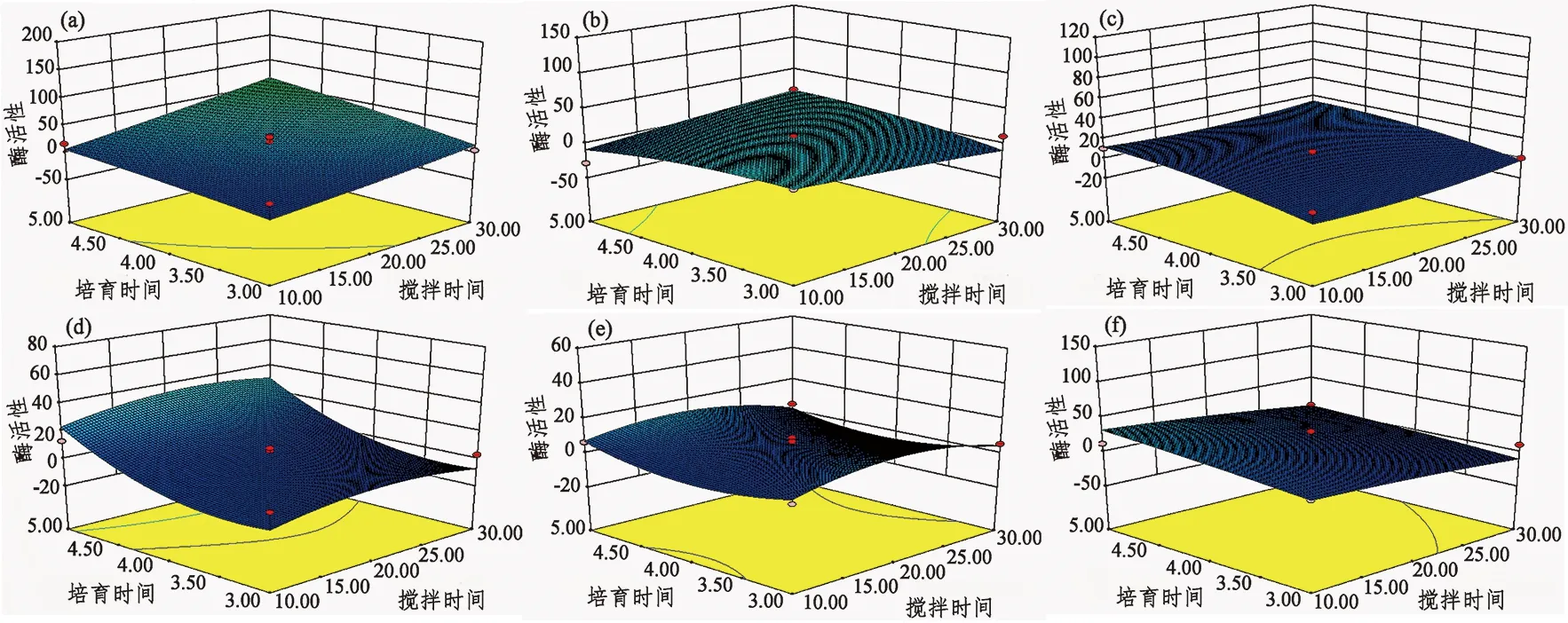
图 5 搅拌时间和培育时间对不同土壤NAG酶活性影响的响应曲面Figure 5 Response surfaces of soil NAG enzyme activity influenced by stirring time and incubation time
3 讨论
表 5 配对检验结果Table 5 Pairing test results

处理实验结果d.f.Sig.AP酶超声波破碎法×AP酶搅拌机破碎法681.01~1 206.9250.182CBH酶超声波破碎法×CBH酶搅拌机破碎法44.48~ 31.7150.223βG酶超声波破碎法×βG酶搅拌机破碎法215.89~183.8750.765NAG酶超声波破碎法×NAG酶搅拌机破碎法139.60 ~106.4150.326天然常绿阔叶林×杉木人工林568.61~903.8840.355
影响土壤酶活性测试结果的原因有很多,本次实验结果表明,在所选的3个实验参数中,搅拌时间对酶活性测试的结果影响较大。土壤团聚体是在土壤有机碳、生物相、离子键桥、黏粒和碳酸盐共同作用下结合起来的[22-23],是土壤结构的基本单元[24-25]。土壤的预处理是通过对各土壤团聚体的破坏使其中的各种酶有机会与底物溶液充分接触,因此,磁力搅拌机对样品溶液的搅拌时间不同,对团聚体的破碎效果也不同,从而影响到土壤中水解酶活性的测定。培育则是给土壤水解酶消耗底物的时间,培育时间过短,土壤酶对底物消耗不完全,培育时间过长会降低实验效率。因为土壤酶与胶体和腐殖质等结合紧密,所以土壤样品溶液的均质化程度会影响其中各种水解酶活性的测试结果,实验过程中也要注意磁力搅拌器的转速。
底物浓度也是影响酶活性测试的原因之一。有研究结果证明,土壤酶促反应受底物浓度的影响[24],在本实验中,使用的底物浓度是400 μmol·L-1,高浓度加快了酶对底物的消耗速率。在此底物浓度的条件下所得到的培育时间参数是4 h。若是底物的浓度变化,土壤酶荧光测试法的最优培育时间参数可能也会随之变化。试验结果表明,搅拌法预处理土壤样品和目前国际上常用的超声破碎法预处理土壤样品对土壤酶活性的影响无显著差异,表明本试验方法具有成本低、操作简便以及可批量操作的优势。
亚热带森林是全球森林碳吸收量最高的地区之一[26],常绿阔叶林和杉木针叶林是亚热带区域的重要植被类型[27]。确定适当的酶活性测定方法,对了解亚热带地区地下生态过程具有重要的意义。然而web of science的检索结果表明,亚热带区域森林土壤酶研究在国际期刊上少见,说明土壤酶的研究和测量还需要更多的投入,随着meta分析的应用,正确测量土壤酶活性愈加重要。因此,本研究结果有助于提高对森林生态系统的认识,可以为森林土壤的酶活性快速检测提供参考。
4 结论
在单因素实验结果的基础上,利用响应面分析法建立了常绿阔叶林和杉木针叶林土壤常见的4种水解酶的酶活性与搅拌时间、静置时间、培育时间关系的模型。分析得出在搅拌16.48 min、静置0 min和培育4 h后能获得当前处理下水解酶活性测试最优效果。本实验所用的酶底物浓度已经是优化后的数据,加上搅拌时间、静置时间和培育时间这3个参数,构成了这几种土壤酶测试的所有关键因素,因此本实验结论可以为亚热带森林土壤酶研究提供参考。
