断裂内含肽介导的蛋白纯化系统的构建
2019-02-06王玉君王姝婧杜夜星冯利利夏海锋
王玉君,王姝婧,杜夜星,冯利利,夏海锋*,2
(1.江南大学 生物工程学院,江苏 无锡 214122;2.粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡 214122)
内含肽是存在于未成熟前体蛋白中的一段多肽链,在前体蛋白转化为成熟蛋白质的过程中,依靠自我催化从前体蛋白中释放出来,同时将两端的蛋白质外显肽通过肽键连接,该过程称为蛋白质剪接[1-3]。内含肽利用自身高效的蛋白反式剪接作用,能够在目标蛋白有效纯化的同时去除纯化标签,在蛋白质纯化领域得到了广泛的研究和关注。
来源于Nostoc punctiforme PCC73102 菌株的Npu DnaE 天然断裂内含肽具有很高的剪接活性和断裂活性,其剪接活性可以达到98 %以上[4]。它的N端和C 端剪接区域分别含有102 个和36 个氨基酸且中间无归巢核酸内切酶结构域。此外,与高度同源的Ssp DnaE 天然断裂内含肽相比,Npu DnaE 断裂内含肽更加能够容忍C 末端外显肽替换并且拥有更加快速的剪接速率[5]。与其它类型的内含肽相比,Npu DnaE 断裂内含肽更加的适合生物技术领域的应用。改造过的Npu DnaE-C 端剪切型蛋白纯化系统在还原剂DTT 的诱导下能实现快速剪切,室温下30 s 内的剪切效率达到50%,半小时内可以完成90%以上外源蛋白的释放[6-7]。Ramirez[6]等利用Npu DnaE 断裂内含肽成功的纯化到磷酸脱氢酶(PTDH)、β-半乳糖苷酶(β-Gal)、麦芽糖结合蛋白(MBP)等不同结构的蛋白,充分的说明了内含肽介导的蛋白纯化系统可以广泛的应用到不同目标蛋白的分离纯化过程中去。但由于层析标签(比如麦芽糖结合蛋白(MBP)、甲壳素结合蛋白(CBD))和层析介质之间相对较弱的结合力,许多亲和配基片段易从层析介质上脱落,造成了目的蛋白的污染[7]。
基于Npu DnaE 断裂内含肽的优良剪接性能以及在蛋白质表达和纯化中的应用潜力和技术需求,本文设计了一种Npu DnaE 断裂内含肽介导的蛋白质表达与亲和纯化系统,主要包括IN亲和配基片段及IC融合蛋白片段。通过改变IN和IC片段的结构以及利用Zn2+对断裂速率的抑制,从中选择出与层析过程契合度最好的组合及断裂条件。利用Cys 代替传统的亲和标签和层析介质进行偶联,成功的制备了IN亲和层析介质,并将其应用到绿色荧光蛋白(GFP)的纯化。对于调整内含肽的剪切活性,控制剪切速率,有着重要的影响。
1 材料与方法
1.1 材料
限制性核酸内切酶、T4 DNA 连接酶、Taq DNA聚合酶购自宝生物工程(大连)有限公司;质粒提取和琼脂糖凝胶回收试剂盒购自生工生物(上海)工程技术有限公司;引物由生工生物(上海)工程技术有限公司合成;Ni-NTA 亲和层析介质和Purose 6 Fast Flow 空白层析介质,江苏千纯生物科技有限公司;含有内含肽Npu DnaE 基因序列的质粒pRSFDuet-NpuDnaE,由美国俄亥俄州立大学化工系David W.Wood 教授课题组提供;表达质粒pET-28a、pET-21b 和pET24b 由本实验室保存;质粒构建和蛋白表达用菌株E.coli JM109 和E.coli BL21(DE3)由本实验室保存。
1.2 方法
1.2.1 IN亲和配基片段重组菌株构建 设计IN以组氨酸标签为纯化标签,并利用此标签不同位置所形成的空间位阻,考察IN和IC片段断裂性质的影响。利用pET-28a 和pET-21b 表达载体在多克隆位点结构上的差异以及组氨酸标签位置的不同,以Nde I 和Hind III 两个酶切位点进行3 种亲和配基片段构建。其结构示意图如图1 所示。主要包括以下几个方面的改造:1)采用基因定点突变的方法将IN 首位的氨基酸Cys 突变为Ala,阻断N 端断裂反应的进行[8-9];2)在IN的C 末端添加Cys,利用其上面的巯基和活化的琼脂糖凝胶介质上的环氧乙烷基团反应进行共价偶联[10];3)通过组氨酸标签在IN片段中的位置不同(在IN的N 端或者C 端)以及组氨酸标签和IN片段之间多余氨基酸片段的添加构建了3 种不同结构的IN亲和配基片段。

图1 亲和配基片段的结构Fig.1 Structure of affinity ligand
以pRSFDuet-NpuDnaE 质粒为模板,分别加入引物S′IN-1/A′IN-1、S′IN-2/A′IN-2 和S′IN-3/A′IN-3进行PCR 扩增,构建3 种不同的IN片段(N1,N2,N3)。本文中所使用的引物如表1 所示。将PCR 扩增得到的序列分别于pMD19(Simple)-T 载体进行连接,涂布相应抗性的平板,筛选阳性克隆子,酶切和测序验证。利用Nde I 和Hind III 限制性核酸内切酶将N1 与pET-28a 载体进行连接,N2、N3 片段分别与pET-21b 载体进行连接。将构建好的重组质粒pET-28a-N1 及pET-21b-(N2,N3)转 入E.coli BL21(DE3)感受态细胞中,得到重组表达菌株E.coli BL21(DE3)/pET-28a-N1 和E.coli BL21(DE3)/pET-21b-(N2,N3),-80 ℃超低温下甘油管保藏。

表1 本文中所使用的引物Table 1 Primers used in this study
1.2.2 IC融合蛋白片段重组菌株构建 同理利用pET-28a 和pET-24b 表达载体的不同,以Nde I 和Hind III 两个酶切位点进行2 种IC融合蛋白片段构建。以Npu DnaE 断裂内含肽的C 片段为基础进行IC融合蛋白片段的改造,主要包括以下几个方面:1)采用基因定点突变的方法引入D118G 突变。该突变可以解除C 端断裂对N 端断裂的依赖,提高C 端断裂速率[6];2)通过融合PCR 的方式将IC片段和GFP连接,并在IC片段末端连接了3 个氨基酸Cys-Phe-Asn(CFN)来提供C 端断裂过程中的关键氨基酸+1Cys[11-12];3)将IC-GFP 片段分别与表达载体pET-28a 与pET-24b 连接,构建两种不同结构的融合蛋白片段。其结构示意图如图2 所示,分别命名为CG1(H-C-GFP)和CG2(C-GFP-H)。
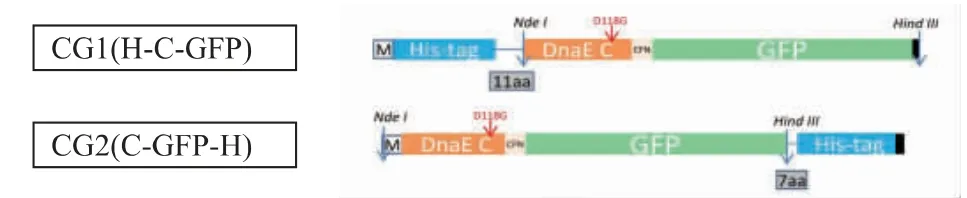
图2 融合蛋白片段的结构Fig.2 Structure of IC-GFP fusion protein fragment
以pRSFDuet-NpuDnaE 质粒为模板,加入引物S′D118G/A′D118G 对IC片段进行基因定点突变。将质粒转入E.coli JM109 感受态细胞中,测序验证后,-80 ℃低温保存。
分别以D118G 突变后的质粒以及含有GFP 片段的质粒pEGFP-N1 为模板,利用引物F1/R1和F1/R1进行IC和GFP 片段的扩增。将两片段按照等摩尔浓度进行混合,用PrimeSTAR DNA 聚合酶进行扩增。最后以F1/R2为引物,使用Ex Taq DNA 聚合酶对融合后的片段进行PCR 扩增。凝胶回收融合后的IC-GFP 片段,与pMD19(Simple)-T 载体进行连接,得到pMD-19T-IC-GFP 重组质粒。
将酶切后的IC-GFP 片段分别与酶切后的pET-28a 和pET-24b 载体进行连接,得到重组质粒pET-28a-CG1 及pET-24b-CG2。最后转入E.coli BL21(DE3)感受态细胞中,得到重组表达菌株E.coli BL21(DE3)/pET-28a-CG1 及E.coli BL21(DE3)/pET-24b-CG2,-80 ℃超低温下甘油管保藏。
1.2.3 蛋白表达与纯化 取已构建的甘油管保藏的菌株于LB 培养基中过夜培养活化。按照1%的接种量接种到新鲜的TB 培养基(含有相应的抗生素)中至菌体浓度(OD600)达到0.8 时,加入50 mmol/L的IPTG 储存液至终浓度为1 mmol/L[13]。在16 ℃,180 r/min 的条件下诱导蛋白表达20 h,离心收集表达后的菌体细胞,于-80 ℃冰箱中待用。
将收集到的菌体按照细胞湿重10%(w/v)的量加入结合缓冲液Buffer A(50 mmol/L 磷酸钠;0.5 mol/L 氯化钠;100 mmol/L 咪唑;pH 8.0)重悬,冰浴条件下超声裂解细胞。将破碎的细胞裂解液离心(12 000 g×30 min)收集上清并用0.22 μm 的滤膜过滤。使用ÄKTA 蛋白纯化仪将细胞上清液上样到Ni-NTA 亲和层析柱中,用20 mmol/L 咪唑浓度的结合缓冲液清洗未结合的杂蛋白;用洗脱缓冲液Buffer B(50 mmol/L 磷酸钠;0.5 mol/L 氯化钠;500 mmol/L 咪唑;pH 8.0)洗脱目的蛋白。纯化后的目的蛋白通过3 000 kDa(N1、N2、N3)和10 kDa(CG1、CG2)的超滤膜进行超滤浓缩和缓冲液的更换。
1.2.4 柱外断裂实验 通过超滤管将纯化后的目的蛋白中的缓冲液更换成Buffer C(50 mmol/L 磷酸钠;0.5 mol/L 氯化钠;pH 8.0)。采用考马斯亮蓝法[14]测定各片段的浓度,按照摩尔比为3∶1(IN∶IC)的比例取相应体积的IN 片段(N1、N2、N3)于1.5 mL 的EP 管中,加入终浓度为50 mmol/L 的二硫苏糖醇(DTT)。取相应体积的CG(CG1、CG2)片段加入反应体系中混匀,开始断裂反应。该反应在室温下进行,在不同时间点取样进行SDS-PAGE 电泳检测。利用IamgeJ 软件扫描SDS-PAGE 图片上的相应目标条带的浓度,根据相对分子质量计算相应条带的摩尔浓度,按照文献[8]的方法计算断裂效率。
1.2.5 Zn2+的抑制作用 本文研究了不同浓度的Zn2+对断裂反应的抑制效果。由于Zn2+在碱性环境中容易发生沉淀,在研究Zn2+对断裂反应的抑制作用的过程中将目标蛋白的环境条件更换为Buffer C(x mmol/L Zn2+;0.5 mol/L NaCl;50 mmol/L Na2HPO4;pH 6.0)。在Buffer C 中将Zn2+的浓度分别设定为x=0,0.5,1,1.5,2,5。
按照N 片段与CG 片段摩尔比为3∶1 的比例称取适量的蛋白冻干粉,用不同Zn2+浓度的Buffer C缓冲液溶解。在室温下进行断裂反应,并在反应的不同时间分别取样,进行SDS-PAGE 检测和分析。
1.2.6 IN层析介质的偶联 采用Buffer D(0.1mol/L Na2CO3/NaHCO3,pH 10.0)溶解亲和配基片段N3,配置成浓度为7 mg/mL 的蛋白溶液。称取5 g 环氧活化的琼脂糖凝胶介质于带塞的25 mL 三角瓶中,加入15 mL 的N3 蛋白溶液进行偶联反应。偶联条件为:40 ℃,150 r/min,16 h。偶联后的介质用大量的去离子水清洗并抽干,20 %乙醇溶液中,4 ℃保存。
1.2.7 IN亲和层析介质对融合蛋白表达片段CG2的纯化 将制备好的亲和层析介质装于1 mL 的预装柱中,采用ÄKTA purifier 层析系统进行整个蛋白纯化过程,流速控制在1 mL/min。其亲和纯化过程如图3 所示,具体操作如下所示:
1)介质平衡与上样。用10 倍柱体积的平衡缓冲 液Buffer E(1 mmol/L Zn2+;0.5 mol/L NaCl;50 mmol/L 磷酸钠;pH 6.0)对介质进行充分平衡,以1 mL/min 的流速将CG 粗蛋白液上样1 mL。
2)清洗杂蛋白。用5 倍柱体积的平衡缓冲液充分冲洗,除去未结合的蛋白。最后用2 倍体积不含Zn2+的平衡缓冲液冲洗,除去介质内的Zn2+。
3)诱导断裂。3 倍体积断裂缓冲液Buffer F(50 mmol/L DTT,20 mmol/L EDTA,0.5 mol/L NaCl,50 mmol/L 磷酸钠,pH 8.0)冲洗层析介质。室温下静置10 min。
5)洗脱。用洗脱缓冲液Buffer C(50 mmol/L 磷酸钠;0.5 mol/L 氯化钠;pH 8.0)洗下断裂后的GFP并进行收集。
6)亲和层析介质的再生。用再生缓冲液Buffer G(10 mmol/L Tris-HCl;0.5 mol/L NaCl;6 mol/L 盐酸胍,pH 8.0)将与亲和介质结合的IC 以及未完全断裂的CG2 片段洗脱下来。

图3 IN亲和层析介质的亲和纯化过程Fig.3 Purification process of INaffinity chromatography
2 结果与讨论
2.1 重组菌株的构建
以pRSFDuet-NpuDnaE 和pEGFP-N1 质粒为模板,利用分子生物学手段成功的构建了重组质粒pET-28a-N1、pET-21b-(N2,N3)、pET-28a-CG1和pET-24b-CG2。重组质粒的双酶切结果表明(图4):在300 bp 与400 bp 相对应的位置出现目的基因条带,证明N1、N2、N3 片段与表达载体正确连接;在800 bp 与1 000 bp 之间也有相应的CG 基因片段的目标条带出现。所有的质粒都经过基因测序进一步证明序列的正确性。
2.2 蛋白表达和纯化
接种构建好的重组表达菌株于新鲜的TB 培养基中进行亲和配基片段和融合蛋白片段的表达。在IPTG 的诱导下,3 种N 片段和两种CG 片段都成功的进行了表达,表达比较高。(图5)
为了研究N 与CG 片段在柱外断裂情况,需要对这五种蛋白片段进行分离纯化。本实验中利用N与CG 片段中带有的His 标签对其进行Ni 亲和纯化。结果表明,3 种N 片段及CG1 与CG2 片段都得到了较好的纯化效果。穿透液中有少量的目标蛋白存在,这可能是目标蛋白在表达过程中组氨酸标签没有暴露导致无法与Ni-NTA 层析介质结合[15]。通过后续进一步优化蛋白表达条件可以避免这种现象的产生。

图4 重组质粒双酶切验证图Fig.4 Digestion of recombinant plasmids with Nde I and Hind III

图5 纯化电泳图Fig.5 SDS-PAGE results of the purification
2.3 体外断裂实验
将3 种N 片段和两种CG 片段两两组合,共形成6 种不同的断裂反应组合,分别命名为A、B、C、D、E、F。各个组合断裂结果如图6 所示。通过分析发现,结构不同的N 和CG 片段相互作用时,其断裂速率各不相同,呈现一定的规律性。其中,组合F 的断裂速率最快,小于1 min 的时间内就可以达到90%以上的断裂速率。而文献[7]构建的纯化体系为了达到相同的断裂速率需要花费30 min 以上的时间。可能是因为Cys 替代CBD 标签在三维空间结构上减少了两片段之间结合阻力,加速断裂反应的进行。为了更直观的比较不同组合断裂时所需要的时间,本文将6 中不同组合的断裂速率总结成表2。

图6 6种组合断裂过程不同时间点取样SDS-PAGE 结果图Fig.6 SDS-PAGE of the C-cleavage reaction between six different groups of N and CG

表2 六种组合断裂反应活性比较Table 2 Comparation of C -cleavage of six different groups
文献[7]研究发现,空间位阻对断裂反应速率有着很大的影响。Npu DnaE 断裂内含肽两片段相互结合时,IN的N 端剪接结构域与IC的C 端剪接结构域相互靠近[5,16]。为了考察空间位阻对断裂反应的影响,将6 种组合相互作用的结构示意图绘制成图7。通过该图我们可以发现:IN的N 端片段越短,参与的断裂反应速率越快;IC的N 端片段越短,断裂速率越快。通过改变IN和IC的N 端插入序列的多少,可以对内含肽断裂反应的速率进行调控,有望实现断裂内含肽的可控性断裂。
2.4 Zn2+对断裂反应的抑制
本文中选取断裂速度最快的组合F(N3&CG2)来研究不同浓度的Zn2+对断裂反应的抑制作用。当Zn2+浓度大于1 mmol/L 时,反应体系中的目标蛋白会发生沉淀(对反应体系中的上清部分进行取样)。实验结果如图8 所示,Zn2+对断裂反应没有显著的抑制效果。与Guan 所述的0.5 mmol Zn2+对断裂反应有明显的抑制效果相违背[6]。

图7 六种组合在IN与IC结合过程中空间位阻对断裂反应的影响Fig.7 Effect of steric hinderance on cleavage reaction during the process of INand ICrecognition
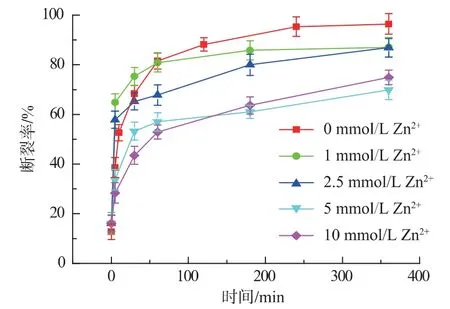
图8 不同浓度Zn2+对组合F(N3&CG2)断裂反应的抑制作用Fig.8 Inhibition effects of different concentration of Zn2+on cleavage group F(N3&CG2)
Zn2+对断裂反应的抑制作用主要是有Zn2+结合域的存在。Ssp DnaE 断裂内含肽的Zn2+结合区域是由His48,Asp140,His110 以及+1Cys 组成[17]。由于断裂内含肽Ssp DnaE 和Npu DnaE 高度同源性,根据氨基酸序列比对,Npu DnaE 对应的Zn2+结合位点为His48,Asp118 和+1Cys(His110 在Npu DnaE 中无对应)。本实验中引入的D118G 突变破坏了上述结合位点,造成Zn2+抑制效果不佳。
文献[18]研究发现Mtu RecA 内含肽中存在第二个Zn2+结合位点——Cys1 和His73。由于Npu DnaE 内含肽与mini-Mtu RecA 内含肽在序列和结构上同源性很高,我们推测Npu DnaE 中的Cys1 位点可能是Zn2+结合域的关键氨基酸,参与Zn2+抑制。为了验证该推论,我们将N3 片段中的首位氨基酸进行回复性突变即引入A1C 突变。突变之后的N3片段在1 mmol/L Zn2+浓度的条件下进行断裂实验,不同时间点进行取样,计算断裂率。结果表明,回复突变之后,Zn2+具有了明显的抑制作用(图9)。这论证了Cys1 参与Zn2+对断裂反应抑制作用的推断。

图9 N3 回复突变前后的Zn2+抑制效果比较Fig.9 Comparation of Zn2+ inhibition effects before and after A1C mutation
2.5 IN亲和层析介质对融合蛋白表达片段CG2 的纯化
自制的IN亲和层析介质对CG2 蛋白纯化过程图如图10 所示,粗蛋白样品的上样量为1 mL。图中A 阶段为杂蛋白清洗,B 阶段为DTT 诱导断裂,C段为目标蛋白洗脱。
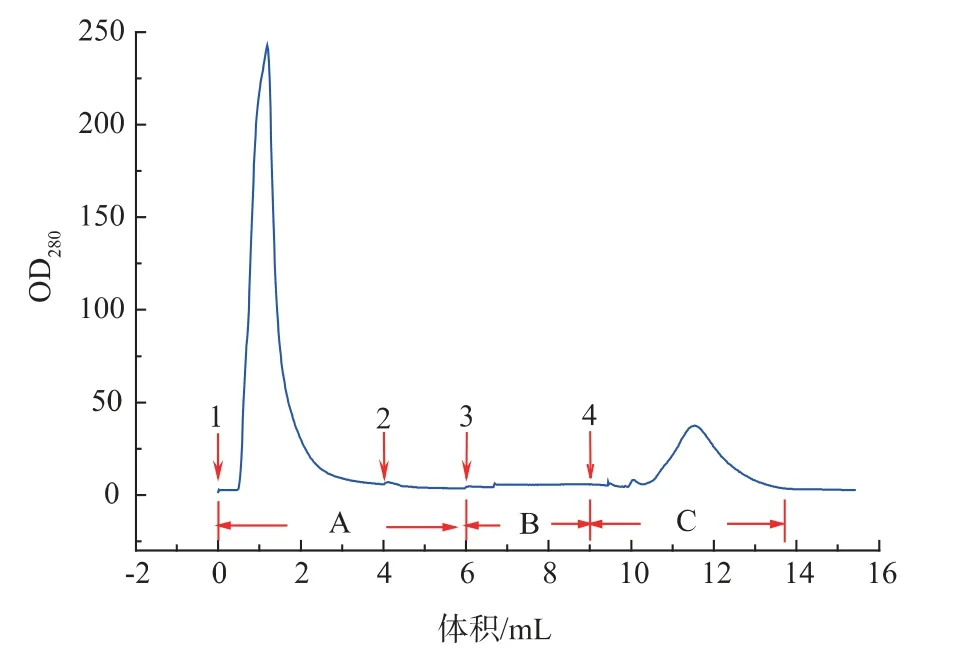
图10 CG2 样品的纯化过程图Fig.10 Purification process of CG2 segment
对纯化过程中各个阶段取样进行SDS-PAGE分析,结果如图11 所示。穿透峰中含有少量未结合的CG2 片段(图11 第3 泳道),这可能是由于IN 层析介质的吸附量达到了饱和。洗脱后获得纯度较高的单一的目标条带GFP(29 kDa)。通过IamgeJ 软件扫描SDS-PAGE 图片上粗样品和纯化后GFP 蛋白的纯度,得出目标蛋白的纯化倍数为8.13 倍。利用考马斯亮蓝法测定并计算得到粗样品中CG2 片段的含量为0.318 mg,洗脱样品中GFP 的含量为0.173 mg,对GFP 的回收率约为54.7%。通过该方法纯化得到的目的蛋白在纯度和回收率上要优于文献[7]的方法(GFP 的纯度和回收率分别为81%和43%),可能因为引入的Cys 避免了IN亲和配基的脱落,间接的提高了目的蛋白的纯度,此外,A1C 回复突变之后使Zn2+的抑制效果更加显著,目标蛋白断裂速率降低,增加了介质的回收率。
由于IN亲和层析介质动态载量低,使得CG2片段未能完全与层析介质结合(图11,泳道3)。此外,在清洗杂蛋白的过程中,部分CG2 片段发生了断裂,造成目的蛋白的损失。后续可通过优化IN亲和层析介质的偶联条件来增加其配基密度,提高目的蛋白的回收率。用再生缓冲液Buffer G 将结合在介质上的IC片段(4 kDa)进行分离(如图11 泳道6)。由图可知,洗脱样品中存在少量未断裂完全的CG2 片段。同时,由于IC片段的分子量较小,洗脱后的样品在电泳图中的条带不清晰。
3 结语

图11 CG2 纯化过程SDS-PAGEFig.11 SDS-PAGE results of purification process of CG2
以天然断裂内含肽Npu DnaE 为研究对象,利用分子生物学的方法对IN和IC结构进行了改造,成功的构建了3 种亲和配基片段(N1、N2、N3)和两种IC融合蛋白片段(CG1、CG2)。通过6 种不同组合的柱外断裂实验,可以发现IN和IC的N 端插入序列的多少对内含肽断裂活性有着重要的影响;通过不同浓度的Zn2+抑制试验,发现Npu DnaE 内含肽的第2 个Zn2+结合位点Cys1。利用在N3 片段C 末端添加的Cys 与环氧活化的琼脂糖凝胶介质进行偶联,成功的制备了IN亲和层析介质。以CG2 为模型蛋白,成功的对其进行了纯化,获得了高纯度的目标蛋白GFP。为以Npu DnaE 断裂内含肽所介导的亲和纯化体系在蛋白纯化领域的应用提供了基础。
此外,该方法还存在一定的局限性。为了加快C端断裂反应的速率,向反应体系中添加了50 mmol/L DTT,可能最终会影响含有二硫键的目的蛋白从而影响其功能。此外,由于IN片段中含有多余的Cys的存在,在进行共价偶联的过程中会造成亲和配基片段非定向的结合,最终影响C 端断裂速率。
