利用重组枯草芽孢杆菌产Bacillus pumilus 来源的γ-谷氨酰转肽酶及其在L-茶氨酸合成中的应用
2019-02-06KOMERAIrene杨套伟饶志明徐美娟
KOMERA Irene,杨套伟,张 显,饶志明,徐美娟
(江南大学 生物工程学院,江苏 无锡 214122)
茶具有强身健体、治疗疾病等之药物疗效。现代医学研究证实,这些功效与茶叶含有的功能氨基酸L-茶氨酸有密切的关系[1]。L-茶氨酸是由日本学者Sakato 首次从玉露绿茶中分离提取得到并因此而命名[2]。L-茶氨酸是存在于茶类植物中的一种天然氨基酸,对茶叶的品质和风味具有重要影响。L-茶氨酸作为茶叶三大天然提取物之一,其安全性已经得到众多国家的共同认可。对人体具有多方面的健康功效,其作为一种“天然镇静剂”添加在多种食品、饮品及保健品,需求量日益增加[1]。
目前,L-茶氨酸的生产方法主要有茶叶提取法,化学合成法和酶转化法3 种。L-茶氨酸一般占干茶叶比重达1%~3%[3],因此,通过茶叶提取L-茶氨酸具有提取率低、周期长、成本高等缺点。化学法合成茶氨酸的缺点为反应条件剧烈,反应过程中难以避免有机试剂的使用,同时产物多为D-型和L-型茶氨酸异构体混合物[4]。酶催化法因其反应条件温和、专一性高、催化效率高等优点而备受关注,据报道,主要有四种酶类能够催化合成L-茶氨酸:L-谷氨酰胺合成酶,L-谷氨酰胺酶,γ-谷氨酰甲胺合成酶和γ-谷氨酰转肽酶,而γ-谷氨酰转肽酶催化反应因不需要ATP 的参与而广受青睐[5]。
本研究克隆了一种来源于Bacillus pumilus ML413 的γ-谷氨酰转肽酶(GGT),并在安全菌株Bacillus subtilis 168 中进行了表达,并研究了该重组GGT 催化合成L-茶氨酸中的应用。
1 材料与方法
1.1 菌株与试剂
1.1.1 菌株 本研究采用模式菌株Escherichia coli 109 作为克隆宿主,模式菌株Bacillus subtilis 168作为表达宿主。以本研究室前期筛选并保藏的B.pumilus ML413 全基因组为模板,利用引物对ggt-F/ggt-his tag-R 通过PCR 扩增获得ggt 基因,随后用限制性内切酶BamH I 和Mlu I 分别处理ggt 基因和表达载体pMA5-HpaII,最后将纯化后基因和载体进行连接,获得重组载体pMA5-ggt,采用化学方法将其转化至B.subtilis 168 中[6],获得重组菌B.subtilis 168/pMA5-ggt,并将其命名为BsG。
1.1.2 引物 本研究所用引物见表1。

表1 本研究所用引物Table 1 Primers used in this study
1.2 培养基与培养条件
菌株活化、种子培养主要采用LB 液体培养基(g/L):氯化钠10,Tryptone 10,Yeast Extract 5。旋转式摇床培养,摇床转速160 r/min,培养温度37 ℃。
转化子筛选采用LB 固体培养基,根据需要加入氨苄青霉素100 μg/mL 或卡那霉素50 μg/mL。
产酶发酵培养基(g/L):葡萄糖10,yeast extract 20,玉米浆15,MgSO4·7H2O 1,K2HPO4·3H2O 2,pH 7.2。摇床转速160 r/min,培养温度37 ℃。
1.3 实验方法
1.3.1 重组菌GGT 粗酶液的制备 重组菌培养结束后,离心(10 000 r/min,30 min),上清液即为胞外GGT 粗酶液。离心获得的细胞用Tris-HCl 缓冲液(pH 8.0)洗涤2~3 次,细胞悬浮液采用超声波破碎,离心(10 000 r/min,30 min)获得胞内GGT 粗酶液。上述GGT 粗酶液均置于4 ℃保存,用于后续实验。
1.3.2 GGT 酶活力的测定 酶活反应体系参照文献 [7],1 mL反应体系中包含:50 mmol/L 硼酸-NaOH 缓冲液(pH 10.0),2.5 mmol/L γ-GpNA,60 mmol/L 双甘二肽,20 μL 适当稀释的酶液。37 ℃反应10 min 后,添加125 μL 浓度为3.5 mol/L 的醋酸终止反应。以不添加双甘二肽受体的反应液作为对照,采用分光光度计在410 nm 处测定吸光度差值。酶活单位定义为:1 min 内经由转肽反应催化生成1 μmol 对硝基苯胺(p-Nitrophenylamine)所需酶量即为一个酶活单位(U)。
1.3.3 重组酶纯化 将上述所得的粗酶液先经0.45 μm 滤膜过滤后,利用Ni-NTA 蛋白纯化柱进行纯化,先用不含咪唑的缓冲液洗脱杂蛋白,再用不同浓度的咪唑缓冲液进行梯度洗脱,依据酶分子的大小与金属离子的结合牢固程度,在一定的咪唑浓度条件下,可以得到较纯的酶液。
1.3.4 酶法合成L-茶氨酸体系 转化体系主要包含:L-谷氨酰胺,乙胺,GGT 蛋白酶,50 mmol/L 硼酸-NaOH 缓冲液(pH 10.0),37 ℃反应结束后,添加10%的TCA 终止反应。
1.3.5 L-茶氨酸分析方法 采用高效液相色谱(HPLC)来测定L-茶氨酸的含量[7]。转化液离心后先用0.24 μm 滤膜过滤后处理。利用OPA 柱前进行衍生。HPLC 条件:Angilent 1260;色谱柱:Hypersil ODS C18(4.0 mm×125 mm)。流动相A(8 g/L 醋酸钠,225 μL/L 三乙胺,5 ml/L 四氢呋喃,pH 7.2)和流动相B(30 g/L 醋酸钠,pH 7.2/乙腈/甲醇(1∶2∶2,V/V))的梯度洗脱程序为:保留时间为0、27.5、31.5、34、35、40 min 时,A/B 分别为92∶8、40∶60、0∶100、0∶100、92∶8、92∶8;流速:1.0 mL/min;紫外检测器;检测波长:338 nm;柱温:40 ℃。
2 结果与讨论
2.1 B.pumilus 来源的γ-谷氨酰转肽酶在B.subtilis 168 中的表达分析
将重组B.subtilis 接种至发酵培养基,30 ℃条件下培养24 h,培养结束后离心收集上清液,获得GGT 粗酶液。随后用AKATA purifier 对GGT 粗酶液进行纯化,获得GGT 纯酶液。对GGT 粗酶液和纯酶液进行SDS-PAGE 分析发现(图1),B.pumilus来源的γ-谷氨酰转肽酶成功在B.subtilis 168 中进行了表达,该GGT 蛋白是由大小分别为38、23 kDa的两个大小亚基组成的二聚体蛋白。
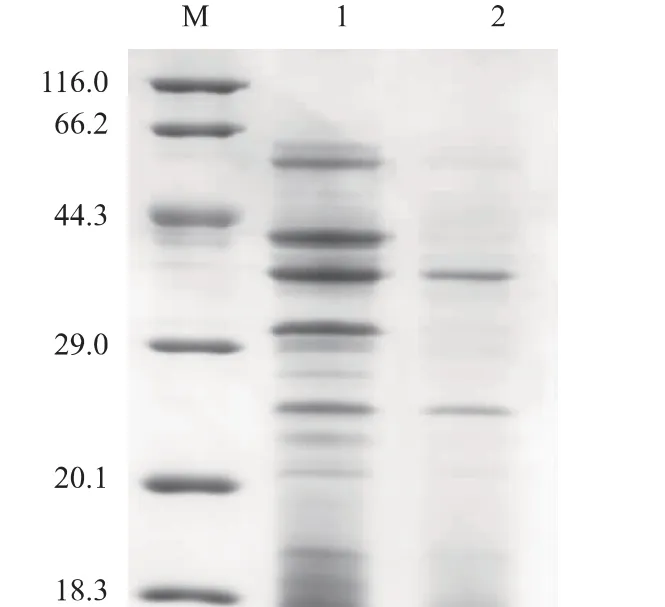
图1 重组B.subtilis 发酵上清和纯化液SDS-PAGE 分析Fig.1 SDS-PAGE of crude and purified enzyme of recombinant B.subtilis
同时,按照1.3.2 节所述的GGT 活力测定方法,对的重组B.subtilis 胞内外GGT 活力进行了检测,结果表明,发酵培养24 h,重组B.subtilis 胞外GGT活力达到3 U/mL,而胞内GGT 酶活只有0.2 U/mL,说明重组B.subtilis 产的GGT 为胞外分泌表达。
2.3 重组B.subtilis 发酵上清液中GGT 催化生产L-茶氨酸能力分析
考察了重组B.subtilis 胞外GGT 蛋白催化合成L-茶氨酸的能力,酶催化反应体系如下:20 mmol/L 的L-谷氨酰胺,40 mmol/L 的乙胺,GGT 酶液浓度为0.04 U/mL,反应体系pH 10,37 ℃条件下反应5 h 后,添加三氯乙酸(TCA)至终浓度为10%终止反应。反应液适当稀释过滤后进行HPLCMASS 分析,结果如图2 所示,说明该酶具备催化生成L-茶氨酸的能力。

图2 重组GGT 催化合成L-茶氨酸能力分析Fig.2 Identification of L-theanine synthesized by the recombinant GGT
2.4 重组GGT 催化特征分析
GGT 催化γ-谷氨酰类化合物的γ-谷氨酰分子转移到其他氨基酸、短肽等受体分子上(转肽反应)或水分子上(水解反应),因此,要抑制水解等副反应的发生。据研究报道,GGT 催化反应特性与反应pH 密切相关,同时还主要受酶添加量、乙胺浓度等因素影响[8]。
首先,考察了GGT 在不同pH(4~12)条件下的催化特征,结果如图3 所示,在pH 7~9 范围内,GGT 水解活力和转肽活力都比较大,说明在此环境中,产物除了茶氨酸外,还会有大量副产物L-谷氨酸的积累。而当控制pH=10 时,GGT 水解活力和转肽活力都显著下降,但是GGT 水解活力下降更为明显,而转肽活力仍保持较高水平,因此,选用pH 10作为L-茶氨酸合成的最适pH。
为了降低水分子与底物L-谷氨酰胺对受体乙胺的竞争力,反应过程中需要保证受体乙胺的用量大于供体L-谷氨酰胺用量,因此,考察了乙胺浓度(20~240 mmol/L)对茶氨酸合成的影响。结果如图4所示,随着乙胺添加量的增加,L-茶氨酸产量逐渐提高,当乙胺浓度为200 mmol/L,即谷氨酰胺∶乙胺=1∶10 时,茶氨酸产量最大。
酶的添加量对酶催化反应具有重要影响,因此,考察了GGT 添加量对L-谷氨酰胺转化率的影响。结果如图5 所示,随着GGT 添加量的增加,底物L-谷氨酰胺转化率逐渐提高,当GGT 添加量为1 U/mL 时,底物转化率最高达到87.2%,继续增加酶量,转化率略有下降,因此,确定GGT 的最适添加量为1 U/mL。
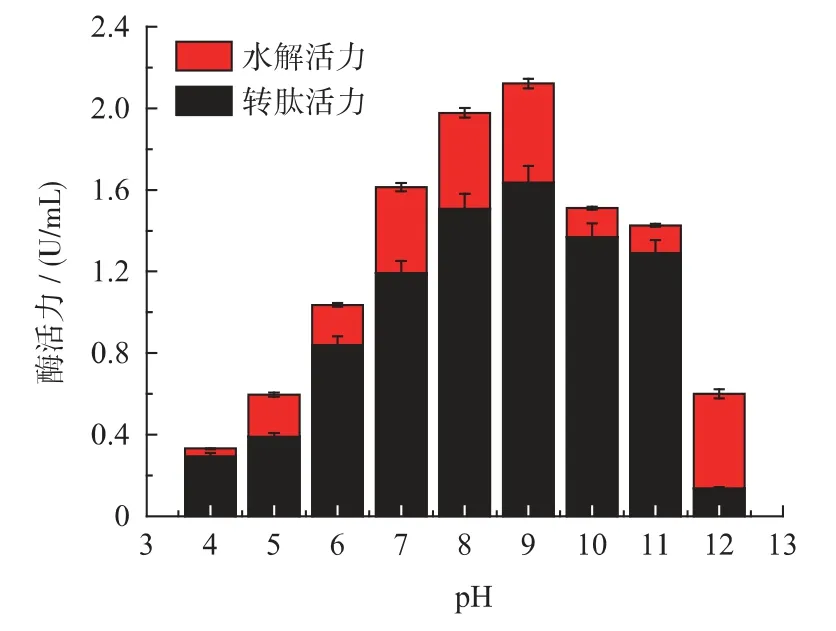
图3 p H 对GGT 转肽和水解活力的影响Fig.3 Effects of pH to GGT activity

图4 谷氨酰胺与乙胺添加比对茶氨酸合成的影响Fig.4 Substrate ratio optimization
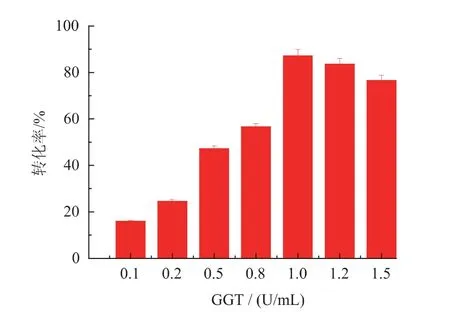
图5 GGT 添加量对茶氨酸合成的影响Fig.5 Effects of GGT dosage on theanine production
2.5 流加转化
为了进一步提高茶氨酸产量,需要添加高浓度的底物,然而,高浓度的乙胺对GGT 具有抑制作用,L-谷氨酰胺溶解度较低,同时,L-谷氨酰胺和乙胺的添加比例和用量对茶氨酸合成具有较大的影响。批次流加底物是解决上述不利因素的有效策略。初始转化体积为1 L,L-谷氨酰胺和乙胺初始添加量分别为20 mmol/L 和60 mmol/L,转化体系中添加1.0 U/mL 的GGT,每隔3 h 补加同样浓度的L-谷氨酰胺和乙胺,转化条件一直维持在pH 10,37 ℃;直至茶氨酸产量几乎不增加时停止反应,转化16 h,茶氨酸产量达到50.8 g/L(图6)。

图6 批次流加合成L-茶氨酸Fig.6 Fed-batch production of L-theanine
2.6 利用发酵液催化合成L-茶氨酸
由于重组B.subtilis 生产的GGT 为胞外表达,且胞外GGT 酶活达到3 U/mL,因此,从未来生产应用的角度,考虑在重组枯草芽孢杆菌发酵产酶结束后,直接在发酵液中加入底物进行L-茶氨酸的生物合成,设计了带细胞的发酵液和除细胞的发酵液上两个实验清。结果如图7 所示,两种情况下最终的L-茶氨酸浓度基本一致,但是利用发酵液进行催化时,底物消耗和产物合成速度较利用上清作为催化剂时效率略高,同时副产物L-谷氨酸初始积累量也偏好,但副产物L-谷氨酸最终积累量基本没有差别,可能原因是发酵液中除了上清液中的GGT 外,还包括细胞内的GGT,因此其GGT 总活力较高。另外,在发酵液中L-茶氨酸合成效率与在硼酸-NaOH缓冲液体系中的效率相差不大,因此,从未来生产应用的角度考虑,直接在重组B.subtilis 发酵液中加入底物进行L-茶氨酸的催化合成具有较好的前景。
3 结语
前期已报道的研究中,多采用大肠杆菌作为GGT 的表达宿主[9],这在食品安全上存在一定的安全隐患。选用安全菌株B.subtilis 168 作为宿主菌,克隆表达B.pumilus 来源的γ-谷氨酰转肽酶,并对该酶的催化特征以及催化合成L-茶氨酸的催化条件进行了优化,通过补料分批流加催化16 h,L-茶氨酸产量达到50.8 g/L,该结果与文献[8]以大肠杆菌作为宿主菌表达GGT 并催化合成L-茶氨酸的产量相媲美。另外,直接在重组B.subtilis 发酵液中加入底物进行L-茶氨酸的催化合成具有较好的前景。选用FDA 认可的B.subtilis 168 作为宿主菌更符合工业化安全生产的要求。
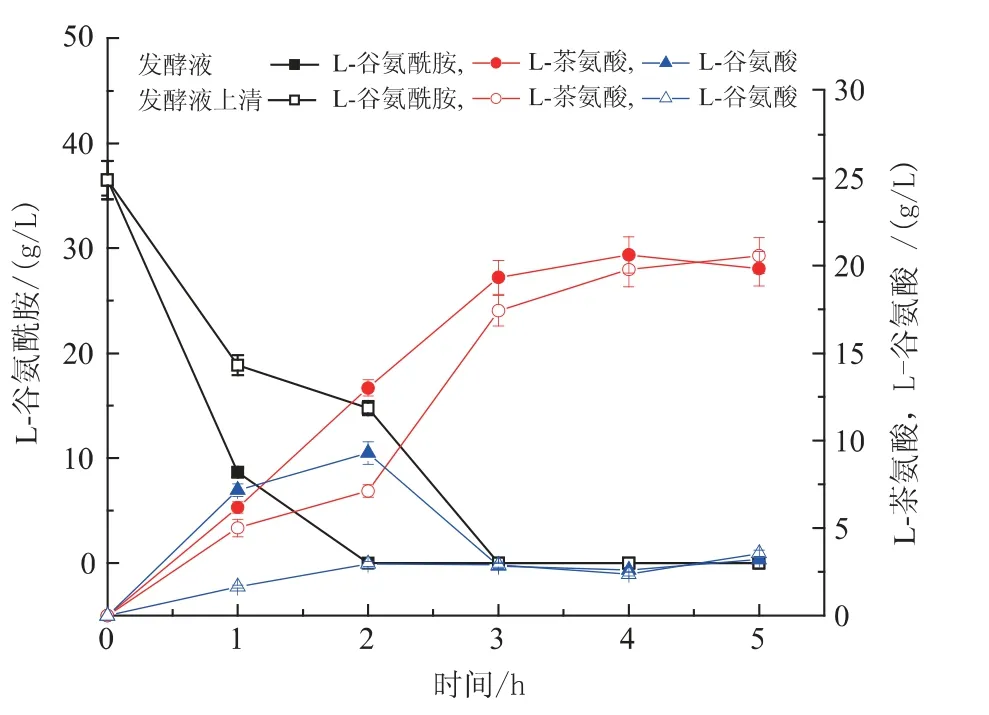
图7 利用发酵液催化合成L-茶氨酸Fig.7 Biosynthesis of L-theanine with fermentation broth
