微小RNA-26a对食管癌Eca109细胞增殖、迁移、凋亡及细胞周期的影响
2019-01-31贺家勇杨晨晨
贺家勇,徐 茜,杨晨晨
(1.中国石油乌鲁木齐石油化工有限公司职工医院外一科,新疆 乌鲁木齐 830019;2.新疆医科大学基础医学院免疫学教研室,新疆 乌鲁木齐 830011;3.新疆医科大学学报编辑部,新疆 乌鲁木齐 830011)
食管癌是人类常见的消化道肿瘤之一,其病理类型分为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(adenocarcinoma,AEC),其中最常见的是ESCC。在世界范围内,食管癌的发病率和病死率分别居第8位和第6位[1]。我国是食管癌高发国家[2]。寻找食管癌的肿瘤标志物,对于食管癌发病机制的阐明和早期诊断具有一定意义。微小RNA(microRNA,miR)是在动物和植物细胞中发现的一类短链非编码RNA,由18~25个核苷酸组成,第1个miR于1993年在秀丽隐杆线虫中被识别。miR主要在转录后水平调控基因表达,对机体的多种生理和病理生理过程发挥调节作用[3-4]。研究显示,miR表达异常与肿瘤恶性潜能、预后有关[5-6],调节性miR-26a在肿瘤中具有明显的双重功能,当作为致癌基因时,miR-26a作为磷酸酶的拮抗剂张力蛋白同源物和丝裂原活化蛋白激酶,可促进胶质母细胞瘤的形成[7-8]。相反,miR-26a可阻止正常肝组织从炎症发展为肝细胞癌[9],通过腺相关病毒递送,减弱细胞周期蛋白(recombinant cyclin,CCN)D2和CCNE2的表达[10]。另外,miR-26a在横纹肌肉瘤和MYC诱导的淋巴瘤中表达下调[11-12]。但在食管癌中,miR-26a的作用尚不清楚。本研究分析了miR-26a对食管鳞状细胞癌Eca109细胞增殖、迁移、细胞周期和凋亡的影响,以探讨miR-26a在食管癌中的生物学作用。
1 材料与方法
1.1细胞来源人食管鳞状细胞癌细胞系Eca109由武汉大学细胞保藏中心惠赠,细胞培养于37 ℃、含体积分数5%CO2的恒温培养箱,采用含青链霉素双抗及体积分数10%胎牛血清(fatal bovine serum,FBS)的RPMI1640培养液培养。
1.2主要试剂与仪器FBS、2.5 g·L-1胰蛋白酶(美国Gibico公司),磷酸盐缓冲液(phosphate buffer saline,PBS)(美国HyClone公司),细胞凋亡试剂盒(美国Invitrogen公司),二甲基亚砜(dimethyl sulfoxide,DMSO)(美国Sigma公司),RNA酶(北京天根生化科技有限公司),四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)(南京碧波生物科技有限公司);电热恒温培养箱(德国Thermo公司),倒置显微镜(日本Olympus公司),酶标仪(美国Bio-Rad公司)。
1.3方法
1.3.1细胞分组与处理将正常培养的人食管鳞状细胞癌Eca109细胞分为正常对照组、阴性对照组和miR-26a过表达组。正常对照组Eca109细胞正常培养,不加任何类型慢病毒;阴性对照组细胞转染随机序列慢病毒,miR-26a过表达组细胞转染过表达慢病毒miR-26a。
根据慢病毒转染的预实验,得到感染复数(multiplicity of infection,MOI)值为20,根据厂家提供的病毒滴度换算加入病毒的体积。MOI=20时,96、6孔板每孔加病毒量分别为2、40 μL。
1.3.2MTT法检测细胞增殖能力取各组转染细胞,按每孔3×104个细胞接种于96孔板,每组设3个复孔。分别于转染后培养0、24、48、72、96 h时后,每孔加入5 g·L-1MTT溶液20 μL,恒温培养箱中继续培养5 h,弃上清液;每孔加入150 μL DMSO。用酶标仪在490 nm波长下测定各孔吸光度值。
1.3.3流式细胞术检测细胞周期取各组转染细胞,按每孔3×105个细胞接种于6孔板,每组设3个复孔。培养48 h后制备细胞悬液;缓慢滴入 375 μL -20 ℃预冷的无水乙醇,1 000 r·min-1离心 5 min,弃去无水乙醇,用PBS洗2~3遍;加入 500 μL 含50 mg·L-1RNA酶的PBS,37 ℃恒温培养箱内孵育30 min;加入5 μL 1 g·L-1碘化丙啶(propidium iodide,PI)染色液,冰上避光孵育 15 min。用流式细胞仪检测各组细胞的周期分布。
1.3.4流式细胞术检测细胞凋亡取各组转染细胞,按每孔3×105个细胞接种于6孔板中,每组设3个复孔。培养72 h后制备细胞悬液;1 000 r·min-1离心5 min,弃上清液;将细胞沉淀加入1×结合缓冲液100 μL重悬,平均分成3份,加入3个EP管中,1个EP管加入5 μL AnnexinⅤ-异硫氰酸荧光素(fluorescein isothiocyanate,FITC),1个EP管中加0.4 μL 10 g·L-1PI染色液,另1个EP管加入AnnexinⅤ-FITC和PI,混匀后避光 5 min;每个EP管中加入400 μL 1×binding buffer,用200~400目钢筛过滤,流式细胞术检测细胞凋亡率。
1.3.5细胞划痕实验检测细胞迁移能力取各组转染细胞,按每孔3×105个细胞接种于6孔板,每组设3个复孔。所有细胞正常培养,换液时用 10 μL 无菌枪头在每孔底部距直径0.5 cm的位置平行画2条直线。分别于转染后0、24、48、72 h时拍照,测量划痕宽度,计算划痕愈合率,划痕愈合率=(0 h的宽度-测量时间点的宽度)/0 h时的宽度。
2 结果
2.1miR-26a过表达对食管癌Eca109细胞增殖的影响结果见表1。转染后0、24、48 h,3组细胞增殖能力比较差异无统计学意义(P>0.05)。转染后72、96 h,miR-26a过表达组细胞增殖能力低于正常对照组和阴性对照组,差异有统计学意义(P<0.05);阴性对照组与正常对照组细胞增殖能力比较差异无统计学意义(P>0.05)。
表13组Eca109细胞增殖能力的比较

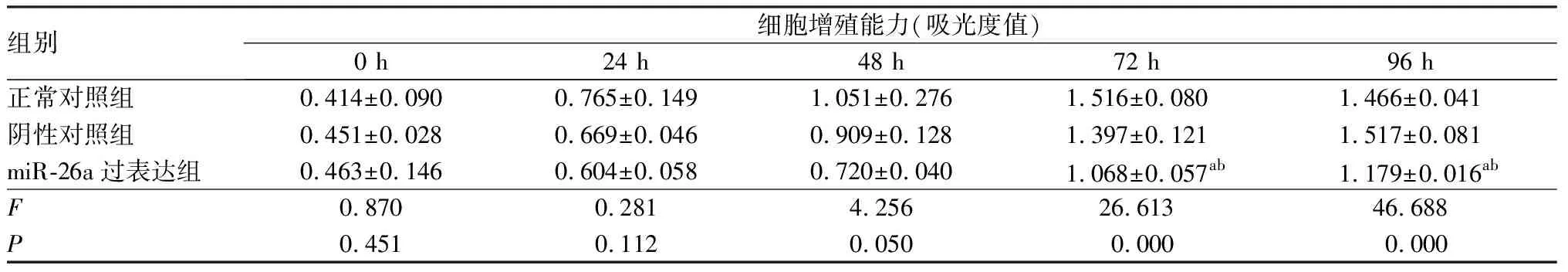
组别细胞增殖能力(吸光度值)0 h24 h48 h72 h96 h正常对照组0.414±0.0900.765±0.1491.051±0.2761.516±0.0801.466±0.041阴性对照组0.451±0.0280.669±0.0460.909±0.1281.397±0.1211.517±0.081miR-26a过表达组0.463±0.1460.604±0.0580.720±0.0401.068±0.057ab1.179±0.016abF0.8700.2814.25626.61346.688P0.4510.1120.0500.0000.000
注:与正常对照组比较aP<0.05;与阴性对照组组比较bP<0.05。
2.2miR-26a过表达对Eca109细胞周期的影响结果见表2。转染后48 h,miR-26a过表达组G1、G2期细胞所占比例高于正常对照组和阴性对照组,S期细胞所占比例低于正常对照组和阴性对照组,差异均有统计学意义(P<0.05)。阴性对照组与正常对照组G1、S和G2期细胞所占比例比较差异无统计意义(P>0.05)。
表23组Eca109细胞周期分布比较

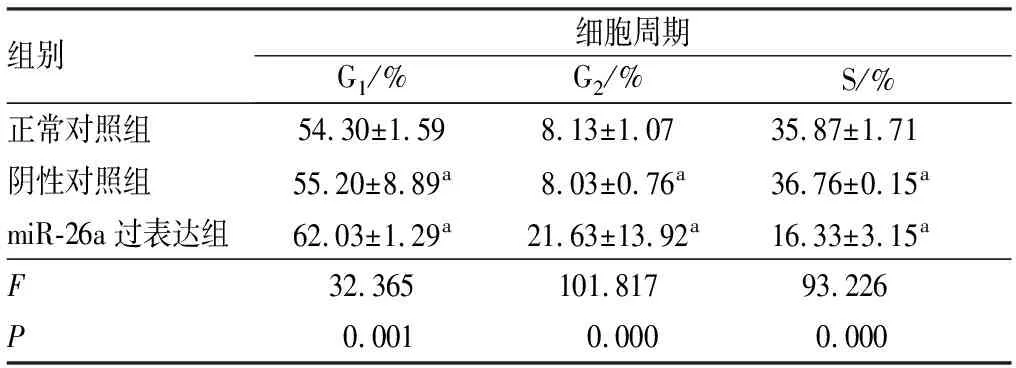
组别细胞周期G1/%G2/%S/%正常对照组54.30±1.598.13±1.0735.87±1.71阴性对照组55.20±8.89a8.03±0.76a36.76±0.15amiR-26a过表达组62.03±1.29a21.63±13.92a16.33±3.15aF32.365101.81793.226P0.0010.0000.000
注:与miR-26a过表达组比较aP<0.05。
2.3miR-26a过表达对食管癌细胞Eca109凋亡的影响转染后72 h,正常对照组、阴性对照组和miR-26a过表达组细胞凋亡率分别为(2.28±0.24)%、(2.40±0.54)%、(2.31±0.27)%,3组细胞凋亡率比较差异无统计学意义(F=0.101,P>0.05)。
2.4miR-26a过表达对食管癌Eca109细胞迁移能力的影响结果见图1和表3。转染后0、48 h,3组划痕愈合距离无明显差别,划痕宽度相近,划痕愈合率比较差异无统计学意义(P>0.05)。转染后 72 h,正常对照组、阴性对照组划痕两端的细胞已接近靠拢,miR-26a过表达组细胞划痕宽度仍较宽;miR-26a过表达组细胞划痕愈合率低于正常对照组和阴性对照组,差异有统计学意义(P<0.05);阴性对照组与正常对照组细胞划痕愈合率比较差异无统计学意义(P>0.05)。
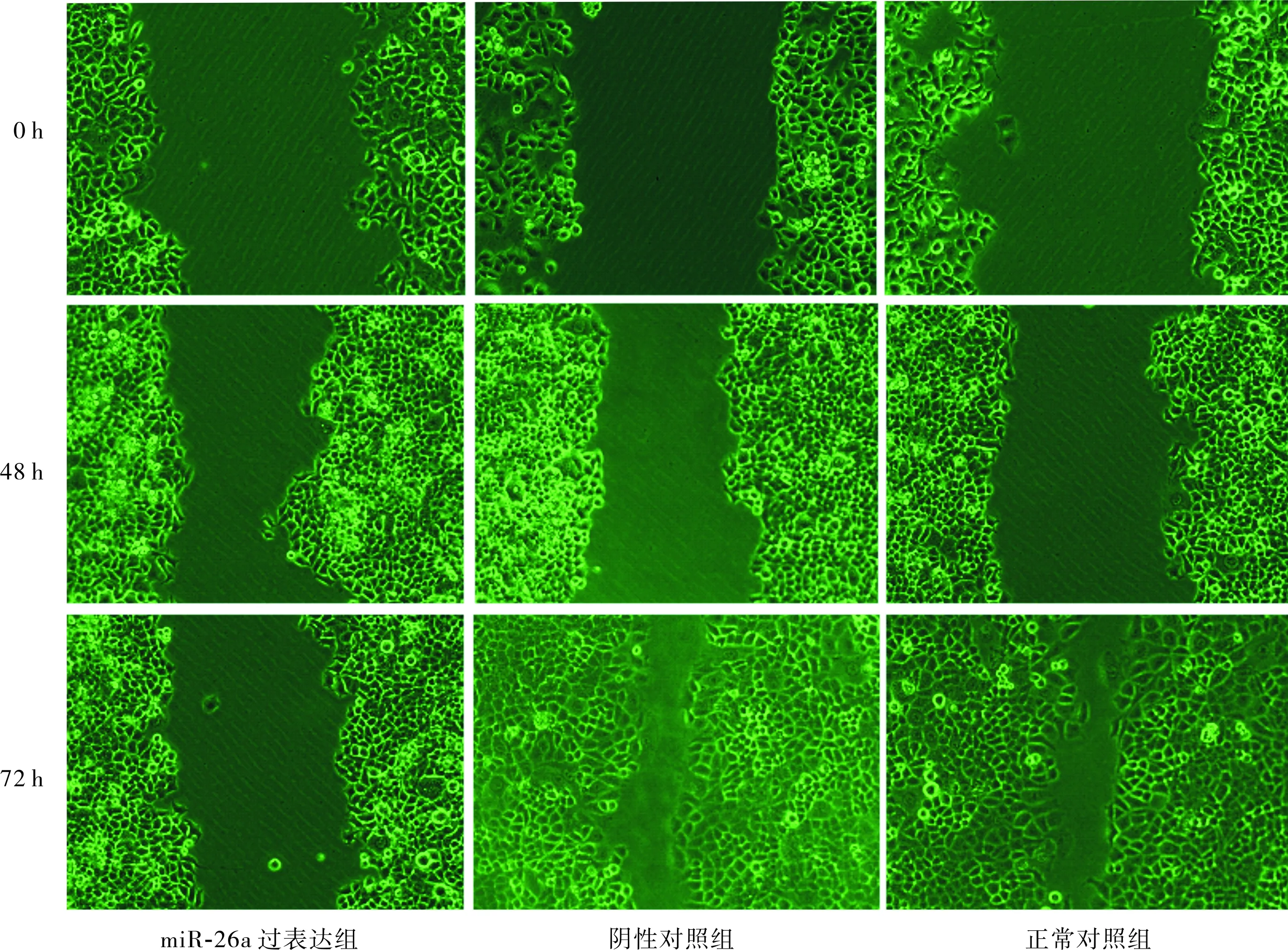
图1miR-26a过表达对Eca109细胞迁移能力的影响(倒置显微镜,×100)
Fig.1EffectofmiR-26aoverexpressiononthemigrationofEca109cells(invertedmicroscope,×100)
表33组Eca109细胞划痕愈合率比较

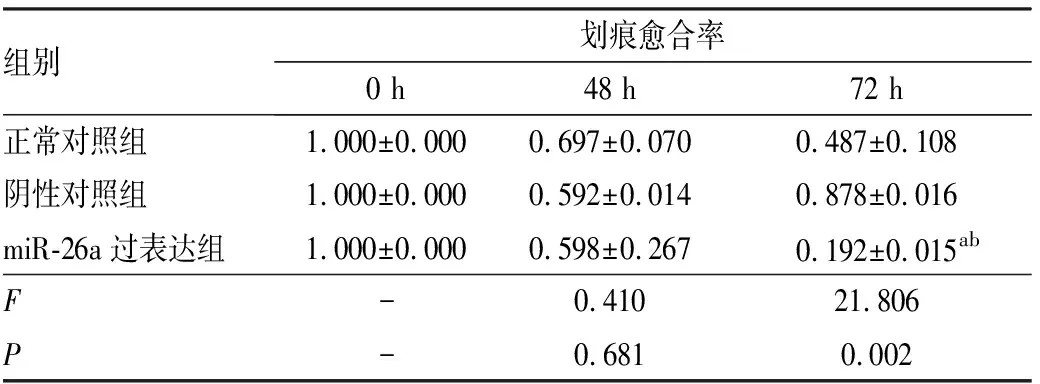
组别划痕愈合率0 h48 h72 h正常对照组1.000±0.0000.697±0.0700.487±0.108阴性对照组1.000±0.0000.592±0.0140.878±0.016miR-26a过表达组1.000±0.0000.598±0.2670.192±0.015abF-0.41021.806P-0.6810.002
注:与正常对照组比较aP<0.05;与阴性对照组比较bP<0.05;“-”表示无数据。
3 讨论
有研究显示,miR在肿瘤的发生、细胞增殖和凋亡、肿瘤血管形成、侵袭和转移等方面发挥着重要的作用[13-15],因此,miR可能作为某些肿瘤新的预测指标和治疗靶点。miR-26a在不同肿瘤中可以扮演抑癌基因和促癌基因的双重角色,但miR-26a在食管癌中的作用尚不明确。
本研究结果显示,转染后72、96 h,miR-26a过表达组细胞吸光度值低于正常对照组和阴性对照组,提示miR-26a过表达能降低食管癌细胞的增殖能力。邓静静[16]将miR-26a特异表达载体稳定转染入胰腺癌细胞株SW-1990和Capan-2,通过细胞计数试剂盒法对细胞增殖能力进行分析显示,miR-26a过表达对胰腺癌细胞的增殖具有抑制作用。本研究结果与其一致,在食管癌细胞中miR-26a过表达使食管癌细胞生长缓慢,miR-26a对食管癌细胞的生长起抑制作用。
赵文淘[17]研究显示,miR-26a可抑制肝癌细胞增殖并促进其迁移,过表达miR-26a后BEL-7402和HepG2细胞体外迁移能力增强。进一步研究发现,miR-26a在癌旁组织中高表达,在肝癌组织中低表达,有转移的肝癌组织中miR-26a的表达较无转移肝癌组织高,提示miR-26a可以促进肝癌细胞迁移及侵袭。本研究结果显示,转染后72 h,正常对照组、阴性对照组划痕两端的细胞已接近靠拢,而miR-26a过表达组细胞划痕宽度仍较宽,提示miR-26a对食管癌细胞的迁移起抑制作用。本研究与赵文淘[17]报道不一致,推测miR-26a在食管癌发生、发展的过程中所起到的作用在不同时期可能是不一样的,这有待于进一步研究证实。
细胞周期是指细胞从一次分裂完成开始,至下一次分裂结束所经历的过程,细胞周期可分为间期与分裂期2个阶段。杨璐西等[18]研究了miR-26a对子宫肌瘤细胞周期和增殖的影响,结果发现,在转染后24 h,与对照组比较,miR-26a高表达的子宫肌瘤细胞G1期所占比例增高。本研究结果显示,miR-26a过表达组细胞转染后48 h,G1期细胞所占比例高于正常对照组和阴性对照组,S期和G2期细胞所占比例低于正常对照组和阴性对照组,与杨璐西等[18]报道的miR-26a在子宫肌瘤细胞周期中的作用特点一致,提示miR-26a可阻断人食管鳞状细胞癌Eca109细胞由G1期向S期的过渡。但正常对照组、阴性对照组和miR-26a过表达组细胞凋亡率比较差异无统计学意义,提示miR-26a对食管癌细胞的凋亡未产生影响,可能与细胞类型有关。
综上所述,miR-26a可以抑制食管鳞状细胞癌Eca109细胞增殖和迁移,阻断细胞由G1期向S期的过渡,但对细胞凋亡未产生明显影响。miR-26a有望成为食管癌的肿瘤标志物,但是本研究仅从细胞水平验证了miR-26a对食管鳞状细胞癌Eca109细胞功能的影响,后续实验可收集食管癌患者临床资料进行组织水平的研究,探讨miR-26a的表达与食管癌患者临床病理学特征及预后的关系,同时可进一步分析miR-26a对食管癌发生、发展的调控作用,为食管癌的治疗及预后判断提供参考依据。
