小分子干扰RNA沉默果蝇zeste基因增强子同源物2对宫颈癌Hela细胞顺铂敏感性的影响
2019-01-31秦海霞李少平朱利红张全华王世进
秦海霞,李少平,朱利红,张全华,王世进
(新乡医学院第一附属医院妇科 河南省神经修复重点实验室,河南 卫辉 453100)
宫颈癌是女性常见的恶性肿瘤,严重威胁女性生命健康[1]。顺铂是宫颈癌常用的一线化学治疗药物,但由于患者先天性或后天获得性耐药,使得部分患者无法完全获益[2],如何增强宫颈癌对顺铂的敏感性是临床亟待解决的热点及难点问题。果蝇zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)为多梳基因(polycomb group gene,PcG)蛋白家族成员,其持续激活可导致细胞异常增殖与恶性转化,被视为癌基因[3]。研究表明,沉默EZH2可提高非小细胞肺癌、卵巢癌对顺铂的敏感性[4-5]。但沉默EZH2对宫颈癌顺铂敏感性的影响尚未可知。本研究利用小分子干扰RNA(small interfering RNA,siRNA)技术降低宫颈癌Hela细胞中EZH2表达,观察EZH2表达变化对宫颈癌顺铂敏感性的影响,以期为宫颈癌分子靶向治疗及化学治疗的增敏治疗提供理论依据。
1 材料与方法
1.1细胞来源、主要试剂与仪器人宫颈癌细胞系Hela细胞购于美国标准菌库;达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、磷酸盐缓冲液(phosphate buffered saline,PBS)、胰蛋白酶、胎牛血清(fetal bovine serum,FBS)购于美国Gibco公司,四甲基偶氮唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]试剂盒、RNA提取试剂盒购于武汉博士德生物工程有限公司,Lipofectamine 2000脂质体购于美国Invitrogen公司,EZH2单克隆抗体、β-actin单克隆抗体购于大连TaKaRa公司,细胞周期检测试剂盒、流式细胞仪购于美国BD公司,EZH2 siRNA、control siRNA由广州锐博科技有限公司构建;全自动酶标仪、超低温冰箱、CL31R台式冷冻离心机购于美国Thermo公司。
1.2细胞培养及转染复苏Hela细胞,用DMEM培养液(含体积分数1%双抗和体积分数10%FBS)悬浮细胞,于37 ℃、含体积分数5% CO2的恒温培养箱中培养。收集对数生长期的Hela细胞,接种于6孔培养板中,然后置于37 ℃、含体积分数5%CO2的恒温培养箱中培养24 h,待贴壁细胞长满底部面积80%~90%时进行转染。将Hela细胞随机分为空白对照组、control siRNA组和EZH2 siRNA组,每组3个复孔。Control siRNA组细胞转染control siRNA,EZH2 siRNA组细胞转染EZH2 siRNA,空白对照组细胞不作处理;转染操作严格按照试剂盒说明书进行。细胞转染后继续恒温培养6 h,更换培养基并继续培养细胞;转染后48 h收集各组细胞进行后续实验。
1.3实时荧光定量聚合酶链反应(polymerasechainreaction,PCR)检测3组Hela细胞中EZH2mRNA表达收集各组转染后细胞,采用TRIzol试剂盒分别提取各组细胞总RNA,反转录总RNA至cDNA,取1 μL反转录产物进行实时荧光定量PCR,以β-actin为内参。EZH2上游引物序列为5′-TTGTTGGCGGAAGCGTGTAAAATC-3′,下游引物序列为5′-TCCCTAGTCCCGCGCAATGAGC-3′;β-actin上游引物序列为5′-CATGTCGAGTTAAGGAGAAGC-3′,下游引物序列为5′-CTTTTAGTGGAGTGCCACA-GG-3′。实时荧光定量PCR反应使用SYBR®Primix Ex TaqTM试剂盒,具体操作按照试剂盒说明书进行。以β-actin管家基因作为内参,在ABI 7900HT PCR仪上进行PCR反应,反应采用二步法PCR扩增标准程序,反应条件为:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 31 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,4 ℃保存。每个反应体系设置2个平行,每次循环的最后一步收集SYBR Green荧光,循环结束时从60 ℃开始做溶解曲线。采用2-△△Ct法获得EZH2 mRNA的相对表达量。
1.4Westernblot法检测3组Hela细胞中EZH2蛋白表达收集各组转染后细胞并提取细胞蛋白,定量蛋白浓度后行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至硝酸纤维素膜,将硝酸纤维素膜置于50 g·L-1脱脂奶粉封闭液4 ℃封闭4 h;含Tween-20的PBS洗涤3次,每次5 min;加入EZH2单克隆抗体(12 000)孵育过夜,含Tween-20的PBS洗涤3次,每次5 min;滴加二抗(1500)孵育4 h,含Tween-20的PBS洗涤3次,每次5 min;按电化学发光试剂盒说明书检测EZH2蛋白表达;β-actin为内参。
1.5碘化丙啶(propidiumiodide,PI)染色法检测3组Hela细胞的细胞周期收集各组转染后细胞,每组2×105个细胞,PBS洗涤2次,每次3 min,1 mL 体积分数70%乙醇固定,4 ℃保存过夜;PBS洗涤2次,每次3 min;加入500 μL PI 染色液,37 ℃避光孵育30 min,应用流式细胞仪检测细胞周期。
1.6MTT法检测3组细胞对顺铂的敏感性收集各组转染后细胞,将细胞接种至96孔板,每孔1×104个细胞,加入100 μL培养液,将细胞置于37 ℃、含体积分数5% CO2的恒温培养箱中培养24 h;第2天,每孔加入顺铂,顺铂最终质量浓度分别为0.0、12.5、25.0、50.0、100.0、200.0 g·L-1;继续培养 48 h 后1 500 r·min-1离心5 min,弃上清液;每孔加入5 g·L-1MTT溶液20 μL,继续于37 ℃、含体积分数5% CO2的恒温培养箱中培养4 h;1 500 r·min-1离心5 min,弃上清液;每孔加入 100 μL 二甲基亚砜,震荡至结晶物充分溶解;采用全自动酶标仪测波长450 nm处吸光度值。计算各组细胞存活率。
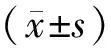
2 结果
2.1Hela细胞转染效果结果见图1。Control siRNA和EZH2 siRNA可高效转染Hela细胞,转染率均达90%以上。
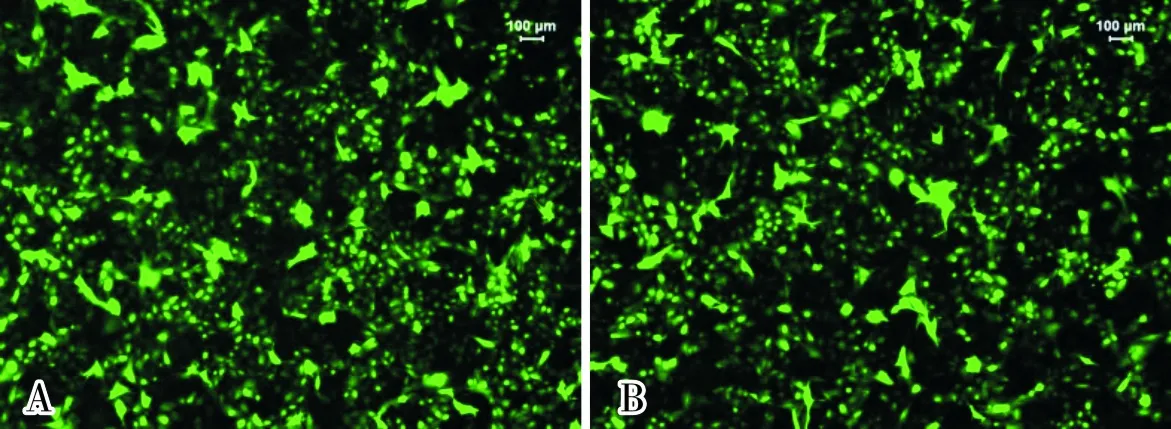
A:control siRNA组;B:EZH2 siRNA组。
图1Hela细胞转染效果
Fig.1ResultsofHelacelltransfection
2.23组Hela细胞中EZH2mRNA表达比较空白对照组、control siRNA组和EZH2 siRNA组Hela细胞中EZH2 mRNA相对表达量分别为396.7±88.4、389.2±70.6和98.5±20.3,EZH2 siRNA组Hela细胞中EZH2 mRNA相对表达量显著低于空白对照组和control siRNA组,差异均有统计学意义(t=2.057、2.015,P<0.01);空白对照组与control siRNA组Hela细胞中EZH2 mRNA相对表达量比较差异无统计学意义(t=1.476,P>0.05)。
2.33组Hela细胞中EZH2蛋白表达比较结果见图2。空白对照组、control siRNA组和EZH2 siRNA组Hela细胞中EZH2 蛋白相对表达量分别为 509.4±110.7、497.5±80.4和120.4±31.3,EZH2 siRNA组Hela细胞中EZH2 蛋白相对表达量显著低于空白对照组和control siRNA组,差异均有统计学意义(t=2.682、2.597,P<0.01);空白对照组与control siRNA组Hela细胞中EZH2蛋白相对表达量比较差异无统计学意义(t=1.943,P>0.05)。

图23组Hela细胞中EZH2蛋白表达(Westernblot)
Fig.2ExpressionofEZH2proteininHelacellsofthethreegroups(Westernblot)
2.43组Hela细胞周期比较结果见图3和表1。EZH2 siRNA组G0/G1期细胞比例显著高于空白对照组和control siRNA组,差异有统计学意义(t=2.893、3.087,P<0.05);EZH2 siRNA组S期、G2/M期细胞比例显著低于空白对照组和control siRNA组,差异有统计学意义(EZH2 siRNA组与空白对照组比较:t=2.526、5.462,P<0.05;EZH2 siRNA组与control siRNA组比较:t=2.498、5.417,P<0.05)。空白对照组与control siRNA组G0/G1期、S期及G2/M期细胞比例比较差异均无统计学意义(t=0.926、1.017、0.947,P>0.05)。

A:空白对照组;B:control siRNA组;C:EZH2 siRNA组。
图3流式细胞术检测3组Hela细胞周期
Fig.3Helacellcycleinthethreegroupsdetectedbyflowcytometry
表13组Hela细胞周期比较

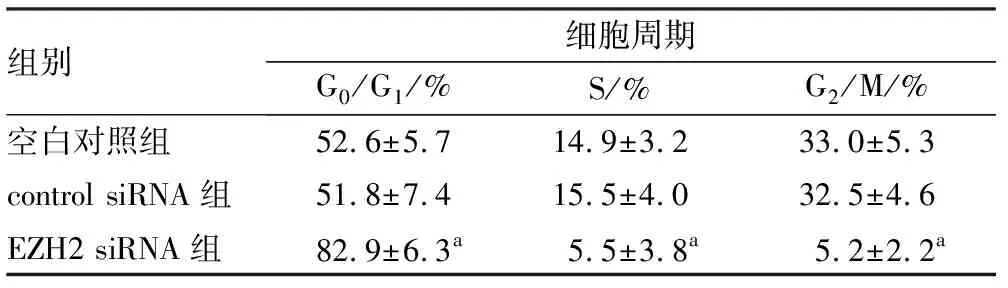
组别细胞周期G0/G1/%S/%G2/M/%空白对照组52.6±5.714.9±3.233.0±5.3control siRNA组51.8±7.415.5±4.032.5±4.6EZH2 siRNA组82.9±6.3a5.5±3.8a5.2±2.2a
注:与空白对照组和control siRNA组比较aP<0.05。
2.53组Hela细胞的顺铂敏感性比较结果见图4和表2。不同质量浓度顺铂作用48 h后,同一质量浓度下EZH2 siRNA组Hela细胞的存活率明显低于空白对照组及control siRNA组(P<0.05),且随着顺铂浓度的增加,3组Hela细胞的存活率均呈逐渐下降趋势。
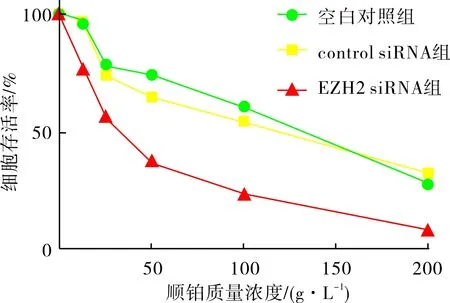
图43组Hela细胞存活率比较
Fig.4ComparisonofthesurvivalrateofHelacellsamongthethreegroups
表2不同质量浓度顺铂作用下3组Hela细胞存活率比较

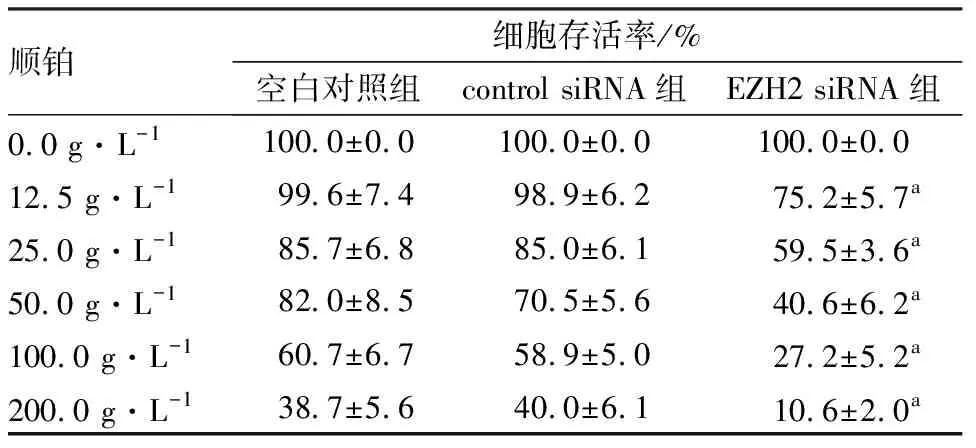
顺铂细胞存活率/%空白对照组control siRNA组EZH2 siRNA组0.0 g·L-1100.0±0.0100.0±0.0100.0±0.012.5 g·L-199.6±7.498.9±6.275.2±5.7a25.0 g·L-185.7±6.885.0±6.159.5±3.6a50.0 g·L-182.0±8.570.5±5.640.6±6.2a100.0 g·L-160.7±6.758.9±5.027.2±5.2a200.0 g·L-138.7±5.640.0±6.110.6±2.0a
注:与空白对照组和control siRNA组比较aP<0.05。
3 讨论
宫颈癌起病隐匿,大多数患者确诊时已为中晚期,失去了手术治疗机会,临床上常使用铂类化学药物治疗,但患者的临床受益率和症状缓解率仍不理想,其原因可能与铂类药物的原发性及继发性耐药有关[6-7]。因此,探讨宫颈癌对铂类药物耐药的机制是提高宫颈癌化学治疗敏感性和改善临床预后的关键。
表观遗传学改变在恶性肿瘤中很常见,是诱发肿瘤化学治疗耐药的重要基础[8]。EZH2是新近发现的表观遗传调控因子,定位于人染色体7q35,在进化过程中高度保守,其作为PcG通路的核心组成部分,可发挥组蛋白甲基转移酶作用,使PcG氨基发生三甲基化,招募多梳抑制复合物至特定基因位点,从而沉默与抑制细胞增殖相关的基因,进而诱导肿瘤的发生与发展[9-11]。刘跃洋等[12]研究表明,宫颈癌组织中EZH2阳性表达率显著高于宫颈上皮内瘤变组织,且其表达与宫颈癌临床分期、肿瘤分化程度、淋巴结转移及间质浸润深度密切相关,提示EZH2参与宫颈癌的发生和发展。目前,EZH2对宫颈癌铂类药物耐药性的影响及机制尚未明确。
ZHOU等[13]研究发现,非小细胞肺癌耐顺铂细胞株A549/DDP、胃癌耐顺铂细胞株AGS/DDP中EZH2表达均显著高于非耐药细胞株,将EZH2 siRNA转染至上述耐药细胞,可显著抑制细胞中EZH2表达,同时提高细胞对顺铂的敏感性,提示沉默EZH2表达可逆转非小细胞肺癌及胃癌的顺铂耐药性。本研究结果显示,转染EZH2 siRNA可显著降低宫颈癌Hela细胞中EZH2 mRNA及蛋白表达,并增强顺铂对Hela细胞的抑制能力,提示沉默EZH2表达可提高宫颈癌细胞对顺铂的敏感性。此外,通过检测细胞周期变化发现,转染EZH2 siRNA可提高G0/G1期细胞比例,同时降低S期、G2/M期细胞比例,表明细胞周期发生了G1/S期阻滞。细胞周期阻滞是诱发细胞衰老的重要机制,而抵抗化学治疗药物所诱导的细胞衰老是肿瘤细胞产生多药耐药性的重要因素[14]。
INK4a/ARF/Rb基因是机体调控细胞衰老的重要信号通路,PcG对INK4a/ARF基因的沉默已被证实具有抑制细胞衰老及分化的作用[15-16]。鉴于EZH2在PcG通路的核心调控地位,故推测EZH2可抑制宫颈癌细胞衰老,而沉默EZH2表达可通过诱导细胞周期阻滞,进而诱导细胞衰老,这可能是沉默EZH2表达后提高宫颈癌细胞顺铂敏感性的重要作用机制。
综上所述,沉默EZH2表达可提高宫颈癌Hela细胞对顺铂的敏感性,而阻滞细胞周期可能是其主要作用机制。
