酶标仪法测定微孔板发酵液中林可霉素
2019-01-30余飞秦艳飞王洲孙俊峰张敏薛正莲
余飞 秦艳飞 王洲 孙俊峰 张敏 薛正莲,*
(1 安徽工程大学生物与化学工程学院,微生物发酵安徽省工程技术研究中心,芜湖 241000;2 新宇药业股份有限公司,宿州 234000)
林可霉素属于林可胺类抗生素[1],对于革兰阳性菌(藤黄八叠球菌、肺炎链球菌等)及支原体等引起的感染具有较好的治疗效果,目前已成为临床主要抗生素之一[2-5]。关于林可霉素的测定,近年来国内外有胶体金免疫层析法、高效液相色谱法(HPLC)、高效液相色谱串联质谱法(LC-MS/MS)、流动注射-化学发光分析法、旋光法等[6]。但以上方法大多成本高、周期长、操作复杂,不宜用于大批量样品的检测。
酶标仪和分光光度计满足吸光物质浓度在一定波长下与吸光度成线性相关的规律,是实验室常用的设备,都适用于物质的检测定量分析[7-9]。但分光光度计相对于酶标仪定量检测物质操作复杂,效率低,试剂用量大,尤其是大批量样品的快速检测[10]。
林可霉素是由林肯链霉菌发酵产生的次级代谢产物,菌种生产能力的提升主要通过诱变技术获得,诱变所获得的大量的突变株经微孔板发酵后如何快速、准确的测定发酵液中林可霉素含量也是制约高产菌株高通量选育的重要因素。目前关于酶标仪法测定微孔板发酵液中林可霉素含量方面的研究尚未见报道,本实验通过酶标仪法测定微孔板发酵液中林可霉素的含量,并利用Origin 8.6软件与分光光度计法进行了拟合,显示两种方法具有很好的一致性,为后续高通量选育林可霉素高产菌株奠定了基础。
1 材料与方法
1.1 仪器
BioTek Epoch全波长酶标仪;常温室压等离子诱变系统(ARTP),北京思清源生物科技有限公司;单道、八道手动可调移液器,Sartorius;TU-1810 紫外可见分光光度计,北京普析通用仪器有限责任公司;HTS-T008 Canvic甘薇深孔板摇床,上海甘薇生物科技有限公司。
1.2 药品和试剂
林可霉素标准品(含量为96.2%,批号:1604312x),新宇药业股份有限公司;氯化钯(分析纯),国药集团化学试剂有限公司;盐酸(分析纯),南京化学试剂有限公司;水为蒸馏水。
0.02 mol/L氯化钯溶液:称取氯化钯0.3547g,用1mol/L盐酸溶解并定容至100mL,避光保存。
5mg/mL林可霉素工作液(I):称取林可霉素标准品500mg,加蒸馏水溶解,用容量瓶定容至100mL。
5mg/mL林可霉素工作液(II):称取林可霉素标准品500mg,加新鲜发酵培养基溶解,用容量瓶定容至100mL;8000r/min离心5min,吸取上清液待用。
1.3 菌种
林肯链霉菌:本实验室保存。
1.4 培养基
种子培养基(g/L):淀粉20、豆粉20、葡萄糖15、硫酸铵1.5、碳酸钙4、玉米浆30,pH7.0。115℃,灭菌25min。
发酵培养基(g/L):淀粉20、葡萄糖90、豆粉20、氯化钠4、硝酸钠8、硫酸铵7、玉米浆3、碳酸钙8、磷酸二氢钾0.25,pH7.0。115℃,灭菌25min。
1.5 实验方法
1.5.1 检测波长的选择
吸取5mg/mL林可霉素工作液150μL置于1.5mL EP管中,加入0.02mol/L氯化钯溶液150μL,用1mol/L盐酸定容至1mL,放置30min,吸取反应液100μL至酶标板,以不含林可霉素同法配制的溶液作为空白对照,使用全波长酶标仪在200~900nm波长范围内进行吸收图谱扫描。
1.5.2 林可霉素测定原理及方法
实验原理:在酸性条件下林可霉素与氯化钯能够形成有色络合物,随着林可霉素浓度的增大该络合物的颜色逐渐加深,在一定的波长下可以使用酶标仪定量检测林可霉素的浓度[11]。
分光光度计法:参考文献[12]测定样品中林可霉素含量。
酶标仪法:吸取发酵液150μL,依次加入0.02mol/L氯化钯溶液150μL,用1mol/L盐酸定容至1mL,放置30min,吸取反应液100μL至酶标板,以不含林可霉素空白溶液为对照,在380nm波长处测定其吸光度。
1.5.3 0.02mol/L氯化钯溶液添加量的影响
5mg/mL林可霉素工作液分别取50、100、150、200和250μL,0.02mol/L氯化钯溶液取值为0、25、50、100、150、200、250、300和350μL,用1mol/L盐酸定容至1mL,放置30min,吸取反应液100μL至酶标板,以不含林可霉素空白溶液为对照,在380nm波长处测定其吸光度。
1.5.4 1mol/L盐酸添加量的影响
5mg/mL林可霉素工作液分别取50、150和250μL,加入0.02mol/L氯化钯溶液150μL,分别用0、0.5、1、1.5和2mol/L盐酸定容至1mL,放置30min,吸取反应液100μL至酶标板,以不含林可霉素空白溶液为对照,在380nm波长处测定其吸光度。
1.5.5 标准曲线的建立
分别吸取用蒸馏水和发酵培养基制备的5mg/mL林可霉素工作液(I、II)50、100、150、200和250μL,按优化后的方法在380nm波长下酶标仪检测吸光度值,绘制标准曲线1、2。比较标准曲线1和2差异。
1.5.6 精密度试验
取已知质量浓度的发酵液,分为2份,分别加入5mg/mL林可霉素工作液75和225μL,制备待测溶液,按优化后的方法在380nm波长下酶标仪检测吸光度值,计算林可霉素含量。
1.5.7 稳定性试验
吸取5mg/mL林可霉素工作液150μL,置于1.5mL EP管中,按优化后的方法,放置0、0.5、1.0、1.5、2.0、2.5和3.0h,在380nm波长处测定其吸光度。
1.5.8 加标回收试验
取已知质量浓度的发酵液,分为5份,分别加入5mg/mL林可霉素工作液25、75、125、175和225μL,制备待测溶液,按优化后的方法在380nm波长下酶标仪检测吸光度值,计算回收率。
1.5.9 两种方法的拟合验证
按优化后的方法在380nm下,分别使用酶标仪和紫外可见分光光度计测定由ARTP诱变所获得的25株突变株经48孔板发酵后其中的林可霉素含量,并用Origin 8.6软件对两种方法进行拟合分析。
2 结果与讨论
2.1 检测波长的选择
按方法“1.5.1”项所测得的结果见图1。由图1可见,林可霉素与氯化钯形成的络合物在380nm波长处有最大吸收,故选择380nm为检测波长。
2.2 氯化钯溶液添加量的影响
按方法“1.5.3”项所测得的结果见图2。如图2所示,当林可霉素浓度为250~1250μg/mL时,A值随着氯化钯溶液量的增加而递增,当氯化钯溶液的添加量达到150μL时,A值达到最大,继续增加氯化钯溶液的量,A值保持不变,因此当林可霉素浓度为250~1250μg/mL时,实验确定添加0.02mol/L氯化钯溶液150μL。

图1 林可霉素紫外吸收图谱Fig.1 UV absorption spectra of lincomycin

图2 氯化钯溶液添加量对吸光度的影响Fig.2 The in fluence of palladium chloride on absorbance
2.3 盐酸添加浓度的影响
按方法“1.5.4”所测得的结果见图3。如图3所示,含相同浓度林可霉素的反应体系中,反应后的吸光度随着盐酸添加浓度的增加而增大,当盐酸添加浓度为1mol/L时,吸光度达到最大,继续增大盐酸添加浓度,吸光度几乎保持不变,因此在反应体系中可直接用1mol/L盐酸定容。
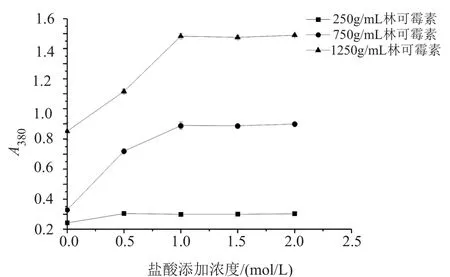
图3 盐酸添加浓度对吸光度的影响Fig.3 The in fluence of hydrochloric acid on absorbance
2.4 标准曲线的建立
按方法“1.5.5”绘制林可霉素浓度的标准曲线1和2,结果见图4。由标准曲线1和2可知,林可霉素的浓度在250~1250μg/mL范围内,测定的吸光度与浓度线性关系良好,可以用于林可霉素浓度的测定;且由表1可知,含相同浓度林可霉素的水溶液与培养基溶液,其A380差值均小于0.1,表明培养基成分干扰较小。
2.5 精密度试验
按方法“1.5.6”所测得的精密度结果见表2。由表2可知,各组在低浓度和高浓度的RSD均小于0.5%,表明该方法测定林可霉素含量精密度高。

图4 林可霉素标准曲线1与2对比Fig.4 Comparison of lincomycin standard curve 1 and 2

表1 标准曲线1与2差异比较Tab. 1 Comparison of lincomycin standard curve 1 and 2

表2 精密度试验Tab. 2 Accuracy examinations
2.6 稳定性试验
按方法“1.5.7”项所测得的稳定性结果见表3。从表3可知,林可霉素工作液在3.0h内吸光度基本保持不变,稳定性良好。
2.7 加标回收试验
按方法“1.5.8”项所测得的回收率结果见表4。从表4可知,平均回收率为96.84%,RSD为0.91%。结果表明,采用酶标仪法测定林可霉素加样回收率较高。
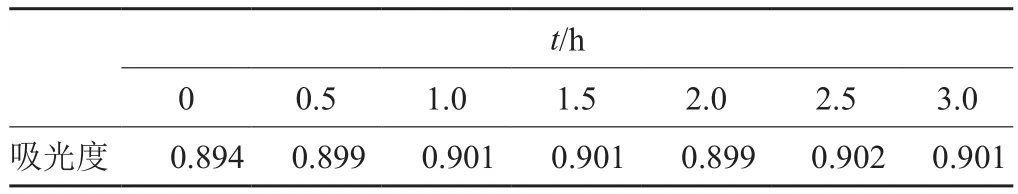
表3 林可霉素工作液的稳定性试验结果Tab. 3 The stability test of lincomycin working solution
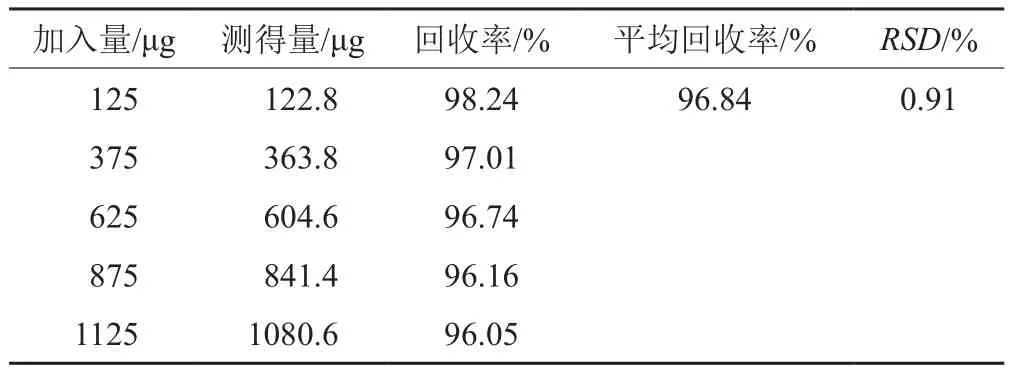
表4 加标回收率Tab. 4 Recoveries of spiked sample
2.8 拟合曲线的建立
按“1.5.9”项优化后的方法在380nm下,分别使用酶标仪和紫外可见分光光度计测定25株突变株孔板发酵液中林可霉素的含量,并利用Origin 8.6软件验证两种方法的相关性,结果如图5所示。

图5 酶标仪法与分光光度计法的拟合曲线Fig.5 Thefitting curve of the enzyme-labelling and spectrophotometer measuring instrument
相关强度由相关系数的绝对值决定,相关系数的正负系数是相关方向。根据经验,统计学家提出了相关性强度的判断标准,将R2=0.7000作为一个较高的相关关系[13]。由图5可知,拟合曲线的R2=0.9551,表明酶标仪法与分光光度计法具有很好的正相关性,可以利用酶标仪法快速、高效的测定较多发酵样品中林可霉素的含量。
3 结论
本实验采用酶标仪法检测微孔板发酵液中林可霉素的含量并优化了该方法的主要影响因素,同时检测了该方法的精密度,结果显示该方法对于检测微孔板发酵液中林可霉素的含量具有很好的可靠性;本实验还利用Origin 8.6软件对酶标仪法与分光光度计法测定发酵液中林可霉素的含量进行曲线拟合,显示两种方法具有很好的相关性;酶标仪法可以用于大批量样品的快速检测,为后续高通量选育林可霉素高产菌株奠定了基础。
