绵羊FSTL3 基因g.40674542C>T 位点多态性与产羔数的关联分析
2019-01-30陈炜昊田志龙储明星
陈炜昊,田志龙,孙 伟,储明星
(1.中国农业科学院北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193;2.扬州大学动物科学与技术学院,江苏 扬州 225009;3.河南科技大学动物科技学院,洛阳 471003)
绵羊产羔性状遗传力只有0.05~0.15,常规育种手段难以满足现代畜牧业对于产羔性状改良的需求[1]。标记辅助选择能够极大地提高如绵羊产羔性状这样低遗传力性状的选择效率,而找到与产羔性状位点相连锁的标记,则是实现标记辅助选择的基础[2]。研究表明,绵羊属于季节性繁殖动物,在光照逐渐缩短的秋冬季节开始性腺活动,在冬春之交时结束[3]。绵羊季节性繁殖活动受下丘脑-垂体-性腺轴(HPG)系统的调控[4],与生殖激素的变化密切相关。促性腺激素释放激素(GnRH)的释放与卵巢生殖活动的季节性变化联系紧密,乏情期下丘脑GnRH 对雌激素的负反馈响应迅速增加,进而调控绵羊的季节性繁殖[5]。
卵泡抑素样蛋白3(Follistatin-like protein 3,FSTL3),又名卵泡抑素相关基因蛋白(Follistatin related-gene,FLRG)。绵羊FSTL3基因定位于5 号染色体上,共编码263 个氨基酸,包含5 个外显子[6]。FSTL3基因大量表达于胎盘、睾丸、心脏和胰腺等组织中,与生殖功能的调控密切相关[7]。FSTL3基因在维持妊娠方面也扮演了重要角色[8],在大鼠怀孕后期,子宫和蜕膜中的FSTL3表达水平显著升高,并且胎盘中FSTL3的mRNA 水平显著高于卵巢[9],在女性月经周期和怀孕初期,子宫内膜的基质细胞FSTL3表达水平显著升高[10],分娩时血清中FSTL3表达水平显著增长[11]。因此,推测FSTL3基因可能同样对于绵羊的繁殖性状有一定的影响。本研究针对不同发情模式的绵羊品种(季节性发情和常年发情),通过对绵羊FSTL3基因的测序,探讨其多态位点与绵羊产羔数的关联性,寻找新的多态位点,为进一步开展绵羊产羔机理的研究和分子标记辅助育种提供参考。
1 材料与方法
1.1 血样及数据采集
21 只苏尼特羊血液样本采自内蒙古巴彦淖尔市乌拉特中旗民羊牧业有限责任公司,22 只滩羊血液样本采自宁夏盐池县宁夏朔牧盐池滩羊繁育有限公司,161只草原藏羊血液样本采自西藏当雄县,101 只湖羊血液样本采自江苏省徐州申宁羊业有限公司,52 只策勒黑羊血液样本采自新疆和田市策勒县,380 只小尾寒羊血液样品采自山东省郓城县诚联小尾寒羊种羊场。所有羊只均采用颈静脉采血,柠檬酸葡萄糖抗凝,-20℃保存。同时记录小尾寒羊产羔季节、胎次与产羔数。
1.2 DNA 提取
使用TIANGEN(天根)血液DNA 试剂盒提取试验绵羊血液样本DNA,Nano Drop2000 检测DNA 样本浓度,并使用1.5%琼脂糖凝胶电泳检测DNA 质量。
1.3 基因分型
对FSTL3基因g.40674542C>T 位点在常年发情和季节性发情绵羊品种中进行基因分型,采用Sequenom MassARRAY®SNP 技术对该位点进行基因型检测[12]。分型样品为DNA,每个样品需要量20 μL,DNA 浓度40~80 ng/μL。
1.4 数据处理
使用Microsoft Excel 2016 软件统计绵羊FSTL3基因g.40674542C>T 位点的基因型频率、等位基因频率、多态信息含量、杂合度和有效等位基因数。随后进行Hardy-Weinberg 平衡检验。
使用最小二乘法进行小尾寒羊FSTL3不同基因型之间的分析,建立的线性模型为:

式中,yijkl为产羔数的记录值;μ 为群体平均值;LSi为第i个产羔季节的固定效应;Pj为第j个胎次的固定效应;Gk为FSTL3基因第k种基因型的固定效应;eijkl为随机残差效应。使用SPSS 19.0 软件进行小尾寒羊基因型与产羔表型数据关联分析,所有数据以平均值±标准误表示。
2 结果与分析
2.1 FSTL3 基因多态性分析
由图1 可知,FSTL3基因g.40674542C>T 位点在季节性发情、常年发情绵羊品种中均存在CC、TC 和TT三种基因型。
从表1 可知,绵羊FSTL3基因g.40674542C>T 位点基因型频率和等位基因频率在季节性发情、常年发情绵羊品种间差异均不显著(P>0.05),且在季节性发情、常年发情绵羊品种中C 均为优势等位基因。
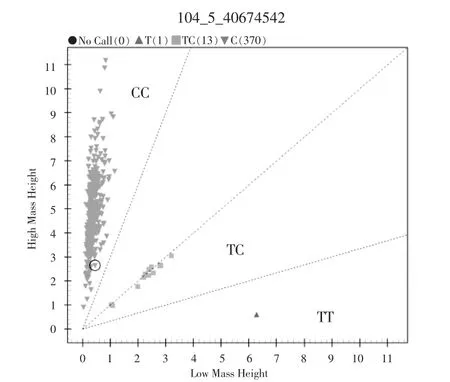
图1 FSTL3 基因g.40674542C>T 位点分型结果

表1 FSTL3 基因g.40674542C>T 位点在季节性发情、常年发情绵羊品种中的基因型频率和等位基因频率
从表2 可知,绵羊FSTL3基因g.40674542C>T 位点在6 个绵羊品种中均表现为低度多态(PIC<0.25)。卡方适合性检验结果表明,该位点在小尾寒羊、湖羊和草原型藏羊中处于哈代温伯格平衡状态(P>0.05),在其余3个绵羊品种中处于哈代温伯格不平衡状态。

表2 FSTL3 基因g.40674542C>T 位点在不同绵羊品种中的群体遗传学分析
2.2 FSTL3 基因g.40674542C>T 位点与小尾寒羊产羔数的关系
从表3 可知,FSTL3基因g.40674542C>T 位点不同基因型与小尾寒羊不同胎次产羔数之间均无显著关联(P>0.05)。

表3 FSTL3 基因g.40674542C>T 位点各基因型小尾寒羊产羔数 只
3 讨论
卵泡抑素样蛋白3(FSTL3)广泛分布在哺乳动物生殖系统各个组织器官中,在胎盘中表达最高,其次是睾丸、胰腺和心脏。FSTL3基因属于TGF-β 超家族,能够与BMPs、肌生成抑制素和活化素等进行特异性结合,使其近乎被全部裂解,无法与相应受体结合[13-14],抑制Smad 蛋白介导的细胞内信号转导,影响TGF-β 超家族成员靶向调控基因转录[15],进而抑制TGF-β 的生物学功能。BMPs 家族中的许多成员参与调节卵泡的发生及排卵[16],并且BMP-Smad信号通路中的许多信号分子基因都与动物繁殖相关,参与调控产羔数、排卵数等性状[17]。研究表明,BMP4可以诱导原始生殖细胞(PGCs)的形成、增殖和定向迁移[18],Smad1基因敲除小鼠表现为胚胎死亡,不产生或极少形成PGCs[19],Smad5基因敲除小鼠表现与Smad1基因敲除小鼠相似[20]。由此可知,FSTL3基因通过介导调控BMP-Smad 信号通路,进而影响动物排卵。FSTL3基因在动物生殖调控上也有着重要的地位。研究表明,FSTL3基因在卵巢储备功能下降综合症患者的卵巢中表达量与正常相比显著下降[21],也可作为妊娠早期早发型先兆子痫的生物标志物[22],其敲除小鼠相比于正常小鼠表现为成年时睾丸增大和生殖细胞数量增加[23],在FSTL3基因系统性过表达小鼠中,胰岛素和胰高血糖素敏感性显著增加[24],在小鼠性腺轴中过表达FSTL3基因后,雄性小鼠性腺重量、精子数和生育力显著降低,雌性小鼠产仔数显著减少[25]。综上所述,FSTL3基因在动物繁殖中的作用至关重要,但目前FSTL3基因对于绵羊繁殖的影响鲜有报道,因此探索FSTL3基因对于绵羊繁殖的影响尤为重要。
群体遗传学分析发现,FSTL3基因g.40674542C>T位点在6 个绵羊品种中均表现为低度多态(PIC<0.25),表明该位点在6 个绵羊品种中的遗传多样性相对贫乏,另外,FSTL3基因g.40674542C>T 位点在滩羊、苏尼特羊和策勒黑羊中处于哈代温伯格不平衡状态,可能是因为自然选择或人工选择对该位点分布影响较大,也可能与选择的绵羊品种数量较少有关。关联分析结果显示,FSTL3基因g.40674542C>T 位点CC 型各胎产羔数均高于TC 型,推测该位点突变在一定程度上降低了小尾寒羊的产羔能力。
研究表明,突变能显著改变动物表型。1982 年Davis 等在澳大利亚布鲁拉绵羊品种发现的FecB 突变,就是在BMPRIB基因的第746 位发生A>G 突变导致的,最终显著提高了布鲁拉绵羊的排卵数和产羔数[26]。本研究在FSTL3基因上发现1 个多态位点g.40674542C>T,发生于第2 外显子,没有引起氨基酸的改变,属于同义突变,同义突变不会造成对应氨基酸的改变,但单核苷酸的替换会改变mRNA 的剪切效率或准确性,从而影响蛋白质表达水平[27],同义突变还可通过改变mRNA的构象,从而降低mRNA 的稳定性,影响多肽链的三维折叠及修饰加工的过程,进一步改变蛋白质的结构或功能,最终对动物表型产生影响[28]。因此,FSTL3基因g.40674542C>T 位点可能对于绵羊产羔数有一定的影响。
4 结论
本研究筛选出绵羊FSTL3基因新的突变位点g.40674542C>T,其与小尾寒羊各胎次产羔数之间没有显著关联(P>0.05),FSTL3基因g.40674542C>T 位点不适合用于小尾寒羊产羔性状的选育。
