受体色谱:中药靶向活性成分高效筛选技术*
2019-01-29刘嘉君贾晓妮曾凯竹赵新锋
刘嘉君,贾晓妮,2,王 静,曾凯竹,李 倩,赵新锋**
(1.西北大学药学院 西安 710069;2.西安市精神卫所中心 西安 710100)
中医药是我国的民族特色和宝贵财富,为防治重大疾病做出了重要贡献。作为中医临床主要用药形式,中药复方具有组成复杂、辩证灵活、化学成分多样及作用机理复杂等特点[1],使得其活性成分筛选发展成为复杂性科学问题。目前,中药活性成分筛选方法主要包括整体动物模型、细胞模型、酶和受体模型、基因芯片、传统生物色谱和计算机模拟等技术。上述方法为中药活性成分筛选做出了重要贡献,但在筛选速度、特异性和效率等方面尚需进一步的工作[2]。因此,中药活性成分筛选依然是中医药现代化研究领域的热点之一,迫切需要在理论、原理和方法方面进行突破,推动以中药为源泉的创新药物研发进程。
1 受体色谱的内涵及外延
1.1 受体色谱概念
众所周知,G-蛋白偶联受体为人体内最大一类细胞膜受体,介导多种重要生理功能,是药物发挥药效的主要靶点。药物进入体内后与受体通过亲和作用形成稳定复合物,启动下游级联式信号转导通路发挥药效。针对传统中药活性成分筛选方法在药物活性成分筛选方面周期长、准确率低和后期临床研究风险大等问题,笔者课题组通过归纳分析体内药物与受体作用过程的特点和传统色谱技术的优缺点,发现体内药物-受体作用过程与色谱系统溶质的吸附-解离行为极为相似,将受体识别药物的高特异性和色谱技术的高分离能力相结合,提出了受体色谱新概念[2-10]。其内涵是将药物靶蛋白识别药物的特异性作为色谱保留行为的本质,延续了色谱技术的高分离能力,凸显了药物识别的靶向性特征,减少了药物筛选的盲目性,提高了药物筛选的准确性。其外延可将任意靶蛋白、DNA等大分子或生物分子固载于色谱填料表面,应用于复杂体系中其特异性配体的分离分析,服务于中药及其复方关键功效物质解析。
1.2 受体色谱的特点
由于受体色谱集成了受体识别药物的高特异性和色谱技术的高分离能力,具有高灵敏度、高特异性、高稳定性和高靶向预测能力,已成为药物-受体相互作用在线分析和复杂体系药物活性成分高效筛选的重要方法之一[3-10]。其概念的提出,拓展了亲和色谱研究范畴,更明确地表达了亲和色谱的功能性特征。与传统色谱技术相比,受体色谱具有以下优势:①受体分子通过温和的固定化方法键合在固定相表面,可保证较高的柱效;②受体经固定化后所处的膜脂质微环境与在细胞膜上微环境相似,稳定性好,可多次重复使用;③可采用色谱学方法对固定化受体的构象及取向进行梳理、调控、优化,最大程度模拟体内受体-药物的相互作用;④可用于中药复杂体系药物活性成分高效、靶向筛选及药物-受体相互作用快速分析。
1.3 受体色谱的发展
历经十余年的发展,笔者课题组以呼吸系统疾病药物靶点β2-肾上腺素受体(β2-AR)及心脑血管疾病药物靶点α1-肾上腺素受体(α1-AR)、血小板受体P2Y12(P2Y12R)、内皮素受体(ETA和ETB)、血管紧张素II受体I型和II型受体(AT1和AT2)为例,建立了系列受体色谱模型(图1)。利用上述色谱模型,建立了系列受体-药物快速和精准分析色谱方法,开展了系列固定化受体-药物相互作用研究,筛选了系列中药单体和复方活性成分,证明受体色谱可成功应用于受体-药物相互作用研究和中药活性成分靶向筛选。该方法为受体-药物相互作用高通量分析和复杂体系药物活性成分高通量和高内涵筛选提供了可靠方法。
2 受体色谱模型的建立
2.1 受体固定化方法
受体固定化方法包括物理吸附、随意固定和定向固定三类。物理吸附法操作简便,蛋白质固载量大,但受体与固体材料通过吸附作用结合较弱,易流失;随意固定化法利用受体自身氨基、羧基及巯基与固体材料表面醛基等发生共价反应,反应效率高,但无位点特异性,受体构象杂乱不易,活性位点损失严重;定向固定化法利用受体结构中融合生物素、谷胱甘肽S-转移酶和组氨酸标签(His-tag)等分别与亲和素、谷胱甘肽和镍离子修饰的固体材料发生亲和作用进行固定化,能统一固定化受体取向,减小活性位点损失,但仍存在耐盐程度低和稳定性差等不足。
2.1.1 受体高容量定向固定化法
为解决受体键合量问题,笔者课题组通过原子转移自由基聚合反应对固定相表面进行接枝改性,通过重氮盐反应和镍离子螯合反应将His-tag融合受体定向固载于改性修饰后的色谱填料表面,建立了高密度His-tag功能蛋白质定向固定化色谱固定相制备方法[5,10]。该方法不仅确保了固定相表面受体取向和构象的一致性,而且减少了活性位点损失,显著提高了受体固载量。
2.1.2 受体密度可控一步固定化法
传统受体固定化方法实施的前提是获得高纯度受体,主要通过三步柱色谱法实现。为了避免受体分离纯化过程导致的活性损失,笔者课题组受生物正交反应启发,分别将О6-鸟嘌呤-DNA-烷基转移酶(SNAP-tag)和脱卤素酶(HALO-tag)融合至受体末端,利用两种酶与其底物的特异性共价反应,将受体固载于底物修饰的固体填料表面,建立了密度可控、高特异性和单层均一的受体一步固定化方法[2]。由于此类反应特异性高,可直接将目的蛋白从细胞裂解液中以共价键捕获至固体填料表面,最大限度减少了受体活性损失,具有快速、可靠、选择性强和固定化效率高的独特优势。
2.2 受体色谱固定相表征
固定化受体的生物活性是成功构建受体色谱模型的重要依据之一,其表征方法是分析化学和药物分析领域面临的难点问题之一,目前尚未检索到有效的方法。围绕该问题,笔者课题组分别从形态学和生物活性方面开展了较为系统的工作,建立固定化受体色谱固定相形态学、取向、构象和活性综合表征方法学。
2.2.1 形态学表征
形态学表征主要表征固定化受体色谱固定相的物理化学性质,可用经典的化学表征方法实现。具体而言,用光电子能谱表征固定化色谱固定相的内部和外部元素组成[2],用透射电子显微镜和扫描电子显微镜表征其内外部形貌。
2.2.2 取向及构象表征
以受体特异性抗体为分子探针,建立了以容量因子、结合常数和热力学参数为指标的固定化受体取向及构象表征方法;创新性地将激光共聚焦显微镜应用于固定化受体位点特异性取向及构象变化活性表征中,以Cy5等荧光染料为探针,以荧光信号强弱为指标,发现固定化受体具有配体诱导的构象变化活性[2]。
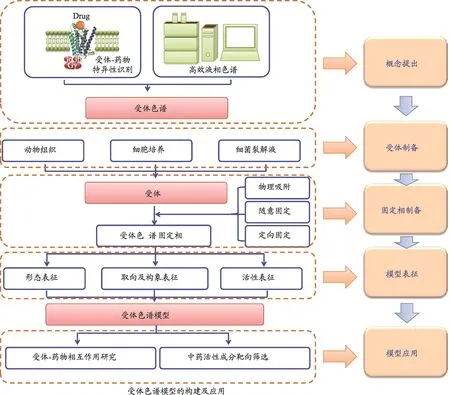
图1 受体色谱模型的构建及应用
2.2.3 活性表征
以受体激动剂、部分激动剂和拮抗剂为工具药,研究其与固定化受体相互作用的热力学和动力学,对受体配体识别活性进行表征;以受体下游偶联蛋白Gs,Gi和Go等及其相关活性短肽为探针,获得其与固定化受体相互作用过程的熵变,对受体下游信号转导活性进行表征,建立了固定化受体配体识别活性和信号转导活性表征方法,为在线表征固定化受体色谱双元活性提供了方法[2]。
3 受体色谱模型的应用
3.1 受体-药物相互作用研究
受体-药物动态识别行为及其介导的信号转导过程对于阐明受体结构与功能、揭示药物体内作用机制、发现药物新靶标、指导后期临床用药和开发创新药物具有重要意义。笔者课题组通过系列研究,证明受体色谱在受体-药物相互作用快速分析方面具有广阔的应用前景。
3.1.1 经典前沿分析和竞争置换法
从作用机理分析,受体色谱系统受体-药物相互作用推动力为弱分子间作用力,笔者认为,经典的前沿分析与竞争置换法同样适用于受体色谱。据此,笔者以α1A-AR和β2-AR为例,分别采用前沿分析和竞争置换法研究了不同工具药与两种受体的相互作用,测定了不同工具药在两种受体色谱柱上的热力学平衡常数等参数,与放射性配体免疫法所得结果高度一致,证明受体色谱法可用于受体-药物相互作用研究[6,8]。
3.1.2 直接进样法
针对经典前沿分析法和竞争置换法分析时间长和配体用量大的不足,笔者建立了基于配体进样量与容量因子依赖关系的直接进样法数学模型,该模型不需用大量配体饱和色谱柱,只需进样不同浓度的配体,即可快速分析受体-配体的相互作用,获得其相互作用参数,特别适用于来源困难或珍贵配体的分析[4,5]。
3.1.3 非线性色谱法
受体-配体相互作用的热力学参数主要探讨结合反应发生的可能性,而动力学参数主要判断配体成药的可行性。为了克服前沿色谱法等方法缺乏受体与药物相互作用热力学参数的不足,笔者将非线性色谱法引入至受体-药物相互作用研究,证明该方法不仅能准确测定平衡常数,而且能同步获得受体与配体的结合速率参数,为蛋白质-药物相互作用参数的全面测定提供了借鉴[6,7]。此外,该方法同样不需用大量配体饱和色谱柱,能有效弥补前沿分析和竞争置换在分析时间长和药物用量大等方面的不足。
3.1.4 吸附能量分布模型
吸附模型的正确选择对受体-药物相互作用精准分析意义重大。笔者课题组将吸附能量分布模型(AED)引入至β2-AR与药物的相互作用研究,通过系统的AED计算,对直接前沿分析和位点特异性竞争前沿分析色谱-质谱所得吸附数据进行了分析,获得最佳吸附模型,准确测定受体-药物相互作用参数[3]。结果发现,该方法所得结果更接近于放射性配体免疫法,结果的准确性和精确度均高于竞争置换法和前沿分析法等传统方法。其原因可能在于色谱固定相的改进、方法灵敏度的提高以及数学模型的优化。更为重要的是,药物在受体色谱柱上的保留时间变化率可用于预测药物与受体的作用力。方法只需单次进样,即可同时鉴定竞争剂与受体的结合位点并预测竞争剂的受体结合活性,能够精准分析G-蛋白偶联受体-药物相互作用。
3.2 中药复方活性成分筛选
3.2.1 单靶点活性成分筛选模型
受体色谱法兼具色谱技术的高分离能力和受体与药物识别过程的高特异性,在活性成分筛选的同时进行分离鉴定。笔者课题组采用β2-AR色谱柱对多种中药提取液进行分析,筛选了可与该受体特异性结合的活性成分,利用反相高效液相色谱-离子阱质谱联用法对活性成分进行了在线分离与鉴定。结果发现2,3-亚甲基二氧-9-甲氧基-原小檗碱、黄连素、巴马汀和药根碱为黄连中可与β2-AR相互作用的活性成分,芥子碱硫氰酸盐和芥子酸胆碱为白芥子中与β2-AR靶向活性成分,证明受体色谱法可用于筛选中药中的活性成分[9]。
3.2.2 多靶点活性成分筛选模型
上述筛选研究证明,受体色谱可用于中药活性成分筛选。然而,从筛选机理分析,一类受体色谱仅能发现中药中的一种或一类生物分子,无法满足多种类、多靶点中药活性分子的筛选。如果能将不同受体色谱柱在线组合,就能建立多维受体色谱模型[9],应用于中药多种类、多靶点活性成分筛选。据此,笔者将α1-AR和β2-AR色谱柱在线串联,当药物供试品进入α1-AR柱后,在α1-AR柱上不保留成分可切换至β2-AR色谱柱进行分析,从而实现筛选作用于两类受体的活性成分;另一方面,在α1-AR柱上保留的成分,也可以再次切换至β2-AR柱,获得同时作用于2种受体的多靶点成分。利用该方法,笔者证明黄连中小檗碱、巴马汀和药根碱为同时作用于2种受体的活性成分。
3.2.3 热病理状态活性成分筛选
生物医学研究表明,蛋白质空间构象异常变化是众多疾病的发病机制之一,而疾病引起的体温改变会调控蛋白质的构象。笔者以固定化β2-AR为例,采用受体色谱模型研究了温度诱导的受体构象变化,证明探针药物手性对映体麻黄碱和伪麻黄碱在色谱柱上的分离度可用于表征热病理状态下固定化受体的构象,为体内热病理状态下药物活性成分高效筛选提供了新的思路[10]。
3.2.4 位点特异性竞争活性成分筛选模型
受体色谱筛选药物活性成分的本质是固定化受体-药物结合解离行为,缺乏目标成分激动或拮抗活性的直接信息。笔者课题组采用位点特异性竞争前沿色谱-质谱技术对6种药物混合物进行了筛选[3]。结果发现,芍药苷和甘草苷与沙丁胺醇竞争性结合受体上同一类位点,提示2种成分具有β2-AR激动活性,证明该方法在复杂体系药物活性成分筛选的同时,能有效判定目标成分的激动或拮抗活性及准确作用位点,为建立基于受体色谱-质谱联用法的高内在活性药物成分筛选提供了依据。
4 展望
自受体色谱概念提出至今,笔者课题组围绕受体色谱在受体-药物相互作用和中药活性成分筛选方面开展了大量工作,取得了一定的研究结果。然而,作为一种以广泛应用为导向的新方法,受体色谱尚需进一步完善和提升:①多靶点协同起效是中药主要作用特征。以中药为源泉进行靶向活性成分筛选,亟需增加受体种类,发展多维色谱系统,以满足多种类和多靶点筛选要求;②配体的受体识别结合参数仅是药物活性的判定指标之一。受体色谱柱中的保留成分是否具有内在活性,尚需发展多元化的指标加以探讨。若药物在色谱柱上的保留行为与受体下游信号转导通路关联,有望通过色谱法获得活性成分更丰富的活性信息;③发展新型受体制备、固定化和药物成分筛选方法,实现药物活性成分智能筛选,以降低受体色谱对人员技术的要求,达到广泛推广的目标。
