基于气质联用的保元汤抗缺氧作用代谢组学研究*
2019-01-29黄荣清肖炳坤杨建云
杨 茜,黄荣清,肖炳坤,杨建云
(军事医学研究院放射与辐射医学研究所 北京 100850)
保元汤由人参、黄芪、甘草、肉桂四味中药材组成,其中人参、黄芪为我国传统滋补养生的名贵药材,具有大补元气、复脉固脱、生津养血等功效[1]。甘草可补脾益气、缓急止痛,调和诸药[2,3]。肉桂引火归元,温肾助阳,是一味性大热的中药材[4,5]。保元汤方以人参、黄芪大补元气,扶助心气;甘草炙用,甘温益气,通经利脉,行血气;肉桂辛热补阳,温通血脉,是常用的补气名方之一[6]。《张氏医通·祖剂》中对此方高度评价,将此方称为补气诸方之首[7]。后世医家也以保元汤方剂为本,形成诸多衍化方,其影响力可见一斑。
代谢组学是近年来快速发展的一门新学科,它的研究对象是代谢组在某一时刻或某种状态下细胞内所有的代谢物变化情况等,通过考察生物体受到外界刺激或给药前后时点状态,研究代谢产物图谱动态变化的整体情况[8]。通过了解这些代谢组小分子物质在不同条件不同时点下的量变,有助于理解整个动态生理变化过程,以此来研究一些疾病发展、药物治疗以及毒理机制等[9-11]。代谢组学将代谢组作为一个整体来进行研究,与中药方剂中整体性和动态性原则十分相似,对于成分复杂的中药方剂来讲,代谢组学的研究方法无疑为方剂研究提供了全新研究思路[12,13]。
本实验以代谢组学为基本思路,利用气相色谱质谱(GC-MS)联用技术,对保元汤在KM小鼠常压耐缺氧模型中的干预作用进行研究,探讨并阐述保元汤在该模型中的作用和机制。
1 材料与方法
1.1 药材
保元汤全方:红参(北京同仁堂(亳州)饮片有限公司,批号701002387A),黄芪(北京同仁堂(亳州)饮片有限公司,批号170510),炙甘草(北京同仁堂(亳州)饮片有限公司,批号170510),肉桂(北京同仁堂(亳州)饮片有限公司,批号160116)
1.2 实验动物
选取雄性昆明种小鼠体重18~20 g,购自军事医学科学院实验动物中心,合格证号SCXK-(军)2012-0004。
1.3 实验仪器与试剂
1.3.1 实验仪器
旋转蒸发器(上海亚荣生化仪器厂),LGJ-25C冷冻干燥机(北京四环科学仪器有限公司);Media Water Purifier净水机(佛山市美丽清湖净水设备有限公司);DL-1-15高级台式封闭电炉(天津市泰斯特仪器有限公司);SHZ型循环水真空泵(上海亚荣生化仪器厂);恒温水浴槽(上海亚荣生化仪器厂);QL-901Vortex型涡旋仪(其林贝尔仪器制造有限公司);BP211D型天平(德国Sartorius公司);NV-15G型氮吹仪(成都赛斯特仪器仪表有限公司);IDZ5-2型离心机(上海安亭科学仪器厂);GC/MS—QP2010SE气相-质谱联用仪(日本岛津公司);BC-2600全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司)。
1.3.2 试剂
乙腈(赛默飞世尔科技(中国)有限公司);甲醇(赛默飞尔科技(中国)有限公司);甲氧氟盐酸盐(sigma公司);BSTFA+TMCS(99:1)(sigma公司);吡啶(天津市博迪化工有限公司);庚烷(梯希爱(上海)化工生产发展有限公司);
1.4 实验方法
1.4.1 保元汤煎剂制取
取红参150 g,黄芪225 g,甘草(炙用)75 g,肉桂37.5 g,加入10倍量水浸泡过夜后煎煮1 h,用纱布过滤后收集滤液,第二次和第三次煎煮分别加入5倍量水和3倍量水,煎煮30 min,同样以纱布过滤收集滤液,合并三次滤液,旋蒸浓缩后置于冻干机进行冻干,获得保元汤煎剂冻干粉末。
1.4.2 保元汤对小鼠抗缺氧能力干预
将64只小鼠随机分为6组,分别为空白组、模型组、阳性对照组(普萘洛尔灌胃给药0.520 mg·kg-1)、保元汤低剂量组(水煎液84.5 mg·kg-1)、保元汤中剂量组(水煎液254 mg·kg-1)、保元汤高剂量组(水煎液507 mg·kg-1),每组8只。每日灌胃1次,连续12 d。末次灌胃1 h后,将各组小鼠分别放入盛有15 g钠石灰的250 mL具塞广口瓶内,用凡士林涂抹瓶塞密闭瓶口后,立刻开始计时,直至小鼠呼吸停止时间。以该时间为指标,比较各组小鼠的常压抗缺氧能力。将呼吸停止后的小鼠进行腹主动脉取血,12000 rpm·min-1离心后获得血清待衍生化后进行GC-MS分析。
1.4.3 血常规分析
将呼吸停止后的小鼠立即腹主动脉取血10 μL,放入血液分析仪配套稀释液中稀释并摇匀,直接使用血液分析仪进样分析,得到血常规分析数据。
1.4.4 GC-MS分析
前处理(衍生化):吸取血清100 μL至2 mL EP管中,加入1200 mL甲醇,涡旋1 min后超声15 min,放入离心机以12000 rpm·min-1离心15 min,去除血清中蛋白。取200 μL上清液至2 mL玻璃小瓶后放入氮吹仪,60℃温度下进行氮气吹干。吹干后加入50 μL的20 mg·mL-1甲氧氟吡啶试剂,涡旋30 s复溶,随后放入70℃水浴加热1 h进行肟化处理。水浴后冷却至室温,加入硅烷化试剂BSTFA+TMCS(99∶1)试剂75 μL,涡旋30 s混匀后,再次放入70℃水浴中加热1h进行衍生。水浴后再次冷却至室温,加入100 μL庚烷,涡旋30 s混匀,过0.2 μm滤膜后得到衍生样品,待GC-MS上机分析。
GC-MS条件参数设定:仪器使用自动调谐方式进行调谐。设定参数:接口温度:280℃;离子源温度:230℃;电离方式为EI源,轰击能量70 eV;倍增电压:1.0 kV;扫描方式:全扫描。色谱柱:RESTEK RX-5 Ms(30 m×0.25 mm×0.25 mm);载气:氦气;流速:1.0 mL·min-1,分流进样;进样口温度:280℃;进样体积:1 μL;升温程序:80℃(0 min)→80℃(5 min)→300℃(60 min)→300℃(70 min)。
1.4.5 代谢标志物寻找及代谢通路分析
将正常组与模型组GC-MS数据使用XCMS预处理后,导入SIMCA-P11.5进行变量权重分析(VIP值),筛选VIP值>1.5的变量。结合荷质比与保留时间参数,导入GC-Solution(NIST2008质谱数据库)中确认潜在标志物化学结构,并通过检索Kyoto Encyclopedia of Genes and Genomes(KEGG)和 Human Metabolome Data-base(HMDB)在线数据库确认代谢标志物结构。同时,将筛选出的代谢标志物使用SPSS 22.0进行t检验,排除不具有显著性差异(P>0.05)的变量。最终确认生物标志物后,将其导入MetaboAnalyst在线分析代谢通路。
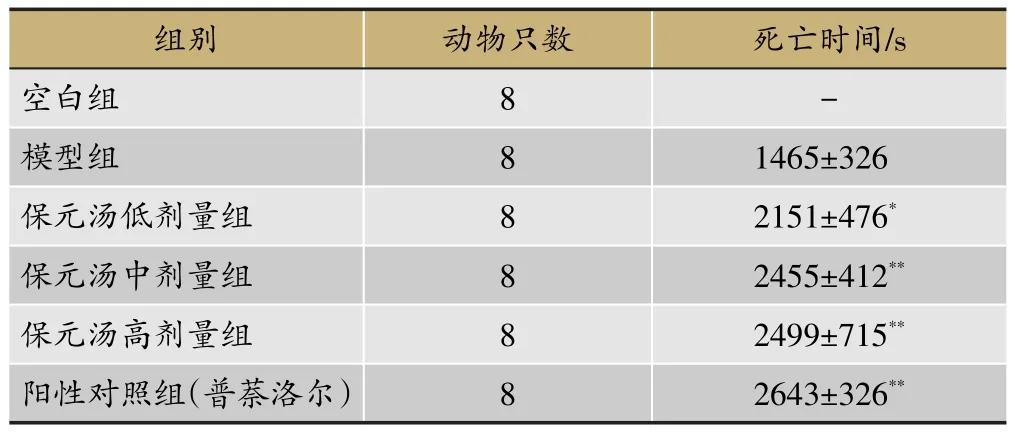
表1 保元汤对常压缺氧小鼠死亡时间影响表(x±s,n=8)

表2 RBC、HBC、HCT分析结果对比表

图1 正常组、模型组、高剂量给药组及阳性对照组TIC图
2 结果与分析
2.1 常压抗缺氧实验不同组别小鼠死亡时间
各组别小鼠死亡时间如表1所示,对各组小鼠常压抗缺氧死亡时间进行分析,与模型组相比较,保元汤低剂量组具有显著差异(P<0.05),保元汤中剂量组和高剂量组、阳性对照组具有极显著差异(P<0.01),保元汤不同计量组死亡时间有上升趋势,但组间无显著性差异。同时保元汤各个剂量组与阳性对照组无显著性差异,即保元汤与普萘洛尔具有相同常压抗缺氧作用,造模成功。
2.2 血常规分析
通过血液分析仪对白细胞数目WBC、淋巴细胞数目Lymph#、单核细胞数目Mon#、中性粒细胞数目Gran#、红细胞数目RBC、血红蛋白HBC、红细胞压积HCT、血小板数目PLT进行分析比较,其中RBC、HBC、HCT三项空白组和模型组出现显著性差异,同时模型组与不同剂量给药组间出现差异,结果如表2所示。
分析各组小鼠在RBC、HBC、HCT数据差异,保元汤低剂量组虽出现数值上升,但与模型组相比,无显著性差异。而给药中剂量和高剂量组与模型组相比,则分别体现出显著性差异和极显著性差异,阳性对照普萘洛尔在该项目中变化不大。

图2 正常组与模型组OPLS-DA分析结果
2.3 GC-MS分析结果
按照1.4.4所述方法,将各组小鼠血清衍生前处理后,使用GC-MS进行分析,正常组、模型组、高剂量给药组及阳性对照组总离子流图(Total Ion Current,TIC)(图1)。
2.4 代谢组学分析
2.4.1 正常组与模型组OPLS-DA分析结果及潜在代谢标志物寻找

图3 不同计量组PLS-DA分析结果
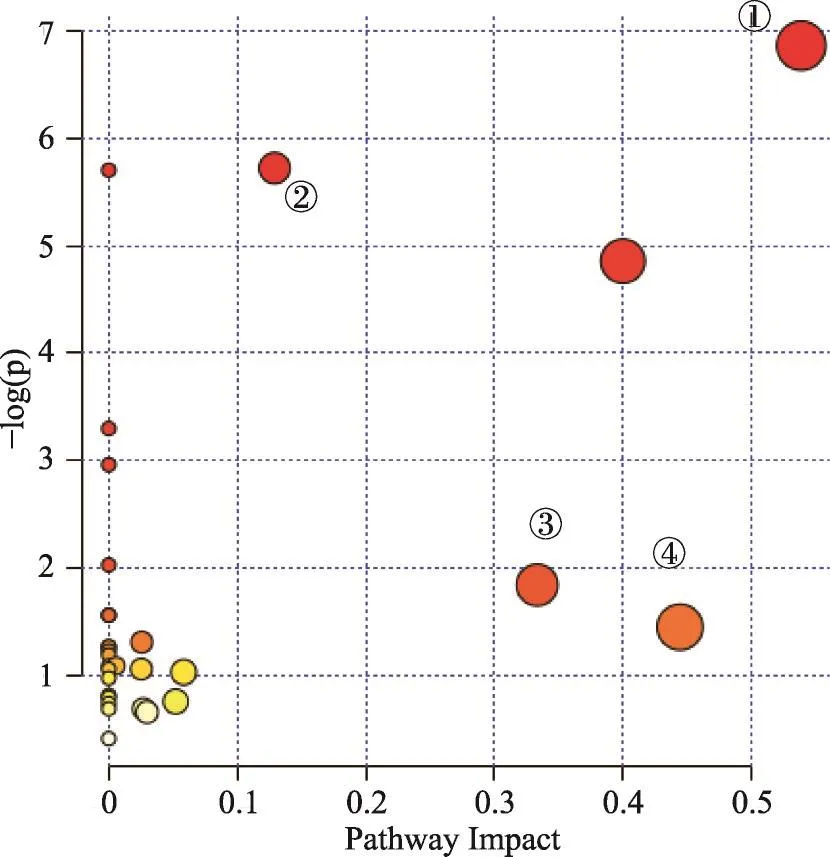
图4 代谢分析影响值图
正常组与模型组血清样品GC-MS分析结果经XCMS处理后,将数据导入SIMCA-P11.5分离分析,R2X=0.689,R2Y=0.991,Q2=0.907,排除过渡拟合现象。正常组与模型组分开(图1),根据VIP值大于1.5初步筛选确认47个潜在的标志代谢物。
2.4.2 保元汤对小鼠常压抗缺氧作用
保元汤各剂量组干预小鼠常压抗缺氧模型后,将GC-MS分析数据导入MetaboAnalyst4.0进行PLS-DA分析,(图2)。保元汤三个剂量组有交叉部分,但高剂量组明显与空白组更为接近,证明保元汤剂量与小鼠常压抗缺氧作用相关,高剂量给药组干预作用最强。

表3 代谢标志物及峰面积比较表
2.4.3 代谢物标志物获取及峰面积比较
在2.4.1初步分析基础上,进一步对潜在代谢标志物进行筛选。通过比对GC-MS的总离子流图(TIC图),同时通过SPSS软件筛选具有统计学差异的峰,最终共发现25个内源性代谢标志物,分别为丙氨酸、乳酸、1-苯乙胺、甘氨酸、β-丙氨酸、异亮氨酸、乙酰甘氨酸、氨基丁酸、二甲基甘氨酸、丝氨酸、二乙胺、乙醇胺、酪胺、色胺、乙胺、苏氨酸、2,3-丁二醇、琥珀酸、苏糖酸、β-甘油磷酸、N-乙酰-L-赖氨酸、丁胺、赤藓糖、岩藻糖、肌醇-1-磷酸。该25个代谢标志物在正常组、模型组、对照组和高剂量给药组峰面积变化表如表3所示,模型组与正常组相比,代谢标志物峰面积均存在显著性差异(P<0.05)或极显著性差异(P<0.01)。高剂量给药组与正常组相比,除异亮氨酸与二甲基甘氨酸显著性升高外,其余各代谢标志物均无显著性差异,意味着高剂量给药组已恢复至正常水平。
2.4.4 代谢通路分析
将2.4.3中发现的代谢标志物导入MetaboAnalyst4.0中进行代谢通路在线分析,得到29条通路分析详细结果,通路分析影响值如图3所示。综合Impact>0.1及相关文献分析,保元汤干预小鼠常压抗缺氧模型最密切的4条代谢路径分别为①甘氨酸、丝氨酸和苏氨酸代谢路径(Glycine,serine and threonine metabolism),②氨酰-tRNA合成(AminoacyltRNA biosynthesis),③缬氨酸、亮氨酸和异亮氨酸代谢路径(Valine,leucine and isoleucine biosynthesis 2),④β-丙氨酸代谢路径(beta-Alanine metabolism)。
3 讨论
小鼠常压抗缺氧实验建立在将小鼠置于密闭环境下,随着小鼠对氧气的消耗和瓶中二氧化碳体积分数的增加,最终造成小鼠缺氧后呼吸中枢抑制而死亡,同时脑和心脏缺血也是死亡的重要原因[14]。本实验以保元汤灌胃给药干预后,各剂量给药组小鼠死亡时间均有显著性延长,对其可能机制进行分析如下:
首先,在血常规分析中可明显看到保元汤中、高剂量给药组在红细胞数目RBC、血红蛋白HGB、红细胞压积HCT上的明显升高。红细胞是哺乳动物体内血液运送氧气的主要媒介,其数量的增多必然有利于增加血液的运氧能力[15]。红细胞中含有的血红蛋白是由珠蛋白和亚铁血红素结合而成,同样在血液的气体运输中起到重要作用[16]。红细胞、血红蛋白的增高,整体上均有利于血液携氧,是保元汤具有显著抗缺氧效应的原因之一。
其次在血清GC-MS代谢组学分析中,最终得到的代谢标志物主要集中在氨基酸类小分子物质变化上。根据周军利[17]等的研究,甘氨酸对缺氧大鼠心肌细胞具有一定保护作用,可能机制为甘氨酸与心肌细胞内受体结合,减轻心肌细胞膜去极化,从而减少Ca2+通道开放使Ca2+内流减少,发挥保护作用。在空白组与模型组对比中也发现,模型组血清中甘氨酸浓度明显下降,可能也与这一作用有关。
氨酰-tRNA合成通路变化则提示了氨基酸体内合成的变化情况。在生物体内转录翻译过程中,tRNA分子会与相应的氨基酸结合,然后将其运送至核糖体进行蛋白质合成。在连接反应中,首先在酶的作用下,ATP与氨基酸结合并消耗能量释放焦磷酸,形成氨酰-AMP复合物,接下来该复合物与对应tRNA结合并运输。氨基酸与tRNA之间形成被称作氨酰-tRNA键的高能键,在蛋白质合成的转运过程中发挥重要作用[18]。因此,如果氨酰-tRNA合成发生障碍,则必然会影响到蛋白质合成。本研究中甘氨酸、苏氨酸、异亮氨酸等多种氨基酸代谢产物变化,提示常压抗缺氧模型中可能存在涉及蛋白质翻译过程的变化。
此外,代谢标志物中的β-丙氨酸是牛磺酸转运体抑制剂,可与Tau-T竞争性结合,抑制牛磺酸转运。而牛磺酸作为人体一种具有特殊生理功能的氨基酸,有一定对心肌细胞的保护能力[19,20],在抗缺氧能力中也发挥着一定作用。
