基于血清代谢组学探究玄参对脾虚水湿不化大鼠的利水作用机制*
2019-01-29李自辉赵洪伟刘树民
李自辉,张 宁,赵洪伟,庞 牧,刘树民
(黑龙江中医药大学药物安全性评价中心 哈尔滨 150040)
脾虚水湿不化为现代中医常见病证,患病人数逐年增加,其与现代人们生活不规律,不节饮食,过度劳累等因素密不可分,最终导致重伤脾胃而诱发各类疾病[1-3]。脾气不足则气化无权,水谷不能布散,水液不能运化,故祖国传统医学所认为脾为气机与津液之枢纽[4,5]。近年来研究表明,中药玄参多用于凉血滋阴,泻火解毒作用的相关疾病治疗,但医学古籍明确记载玄参具有利水之功效,且又归胃经,而现代中医对于此作用的临床应用鲜有报导[6,7]。本课题组前期依托国家重点基础研究发展计划(973计划),已验证玄参对脾虚水湿不化具有一定的治疗作用,故本实验运用血清代谢组学技术,对其利水功效的机制进行深度探究,同时找寻潜在生物标志物,通过关键性靶点寻找相关联代谢通路,为玄参治疗或缓解这类疾病做出理论支撑,也为今后新药研发与临床的安全应用提供有力的科研依据。
1 材料
1.1 仪器
AcquityTHUPLC超高液相色谱与Q-TOF-MS质谱仪(Waters公司);KQ-SOB超声仪(昆山市超声仪器有限公司);MassLynx V3.1(Waters公司);QI 3.0软件(Waters公司);KDC-160HR高速冷冻型离心机(科大创新有限公司);AL204电子天平(瑞士梅特勒-托利多公司);MS-3 digital蜗旋仪(德国IKA公司)
1.2 药品与试剂
高脂低蛋白饲料(自制,成分为蔗糖47.5%,氯化胆碱0.2%,纤维素5%,蛋氨酸0.3%,酪蛋白7%,淀粉15%,玉米油5%,多矿3.5%,猪油15%,多维1%,胆固醇0.5%)、AIN-76A正常纯化饲料(北京澳协力饲料厂)、乙睛(美国Fisher公司)、甲酸(美国Dikma科技公司)均为色谱级、蒸馏水(屈臣氏公司);胃泌素酶联免疫试剂盒(北京方程生物公司,批号:20150701);白蛋白(ALB)、总蛋白(TB)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、总胆固醇(CHOL)、D-木糖酶联免疫试剂盒(南京建成生物研究所,批号:20150706)、蓝色葡聚糖(DB-2000,法玛西亚公司)。
1.3 实验动物
SD大鼠,SPF级,雄性,体重220± 20 g,购自辽宁长生生物技术有限公司,许可证编号:SCXK(辽)2015-0001。饲养地点:黑龙江中医药大学药实验动物中心屏障系统内。室内温度(22±1)℃,湿度为45%。适应性喂养7 d后进行实验,所有实验大鼠的使用和喂养严格遵照动物保护协会所规定的有关条款。
1.4 药物制备
玄参饮片购自黑龙江省药材公司(批号:20120623012),经本校中药资源与开发教研室王振月教授鉴定为玄参科植物玄参(Scrophularia ningpoensis Hemsl.)的干燥块根。玄参生药经适量粉碎后,分别用10倍和8倍量的蒸馏水恒温加热进行提取(水煎煮法),两煎液均冷凝回流1.5 h,合并药液,过滤,减压浓缩加工,得到呈棕褐色,甜腻芳香气味,略带苦味的水煎液,再经低温干燥机中冻干,得到冻干粉末,提取后计算其出膏率为30.7%[8]。
2 方法
2.1 实验动物造模与给药
SD雄性大鼠30只,随机分为空白组、模型组、玄参组,每组10只。空白组大鼠饲以正常饲料喂养;模型组与玄参组饲以高脂饲料喂养,且每日进行尾部负10%体重游泳(水温15-20℃,水深40-45 cm),大鼠力竭为止(大鼠鼻尖没入水中10 s以上,即判断为大鼠力竭)。连续6周后,玄参组按人体临床上限的2倍剂量折算后给予大鼠(即2.9 g生药材·kg-1),空白组和模型组i.g.给予10 mL·kg-1·d-1生理盐水,连续2周[9]。
2.2 尿液D-木糖含量的测定
实验结束前两天,禁食12 h,灌胃4 mL的3%D-木糖溶液,试验期间禁食且自由饮水,收集给予D-木糖后5 h的尿液,按照酶联免疫试剂盒说明进行含量测定。
2.3 水负荷指数的测定
实验结束前一天,禁食12 h,称量体重,作为基本值,即水负荷前体重,控制实验温度25℃,每只大鼠用10%生理盐水腹腔注射,水负荷后分别称量0、1、2、4、6 h的体重。实验期间禁水禁食,按体重下降比=(水负荷时体重-水负荷前体重)/水负荷前体重×100%,分别以水负荷差值描记曲线,曲线下面积积分即为水负荷指数。故水负荷指数越大表明水液在体内留存时间越长,水潴留情况越严重。
2.4 血清蛋白、胃泌素及胃排空率的测定
实验结束当天,末次给药后,禁食12 h,每只大鼠灌胃0.4 mL的2%DB-2000溶液,30 min后将大鼠麻醉处死,腹主动脉取血,将取出的血液常温下静置40 min,4℃下,3500 r·min-1离心10 min,取上清液,-80℃冰箱存储备用。严格遵照试剂盒说明的指示操作,对血清中ALB、TB、HDL-C、LDL-C、CHOL及胃泌素进行含量测定。取出大鼠的胃,沿胃大弯处剪开,残留物溶于4.0 mL水中,12000r·min-1离心5 min,取上清液于620 nm处测定吸光度A,A1为大鼠胃内DB-2000的吸光度,A2为基准DB-2000的吸光度,按照1-A1/A2计算胃排空率。
2.5 代谢组学血清样品的处理
将部分-80℃冰箱存储血清样本取出解冻,加入9倍体积冰冷的甲醇,混匀后4℃13000 r·min-1离心15 min,取上清液存于离心管,重复上述条件离心一次,最后取上清液储存于-80℃冰箱备用,进行代谢组学分析。
2.6 UPLC与MS的实验条件
WATERS ACQUITYTHUPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm)流动相0.05%甲酸乙睛溶液(A)-0.05%,甲酸水溶液(B),洗脱梯度:0-4 min 5-30%A,4-7 min 30%-50%A,7-11 min 50%-70%A,11-14 min 70-100%A,14-15 min 100%A,15-16 min 100%-5%A,16-18 min 5%A。进样量2 μ L,流速0.4 mL·min-1,柱温40℃[10]。MS条件采用电喷雾离子源(ESI),正离子与负离子模式下检测,Lock Mass采用全扫描方式,质量扫描范围为质荷比m/z 100~1500,喷雾频率为10 s,根据Waters公司在线系统,进行亮氨酸脑啡肽质量校正,正离子m/z 556.2771[M+H]+,负离子m/z 556.2615[M-H]-,其余质谱条件见表1。
2.7 大鼠血清样本潜在标志物的代谢组学分析
应用UPLC-TOF-MS手段针对所得离子产生的质谱峰进行分析,制得总离子流色谱图并同时开展对离子峰的提取、对齐和匹配,通过QI与MarkerLynx XS软件的帮助可明确数据中代谢物的分子质量,并将所获数据在筛除外源性的干扰成分后进入EZinfo 2.0软件处理分析,对大鼠血清血清样本数据进行PCA处理(principal components analysis,主成分分析),采用Scores plot图说明组间的离散程度,以此判断大鼠血清样本各组轨迹的相似度情况及是否呈现出聚类效应。结合S-plot图所选出潜在生物标志物的组间变化趋势,采用离子变量(VIP)>1作为投射筛选条件,找出重要性生物标志物,同时联合人类代谢组学数据库(HMDB)和京都基因与基因组百科全书数据库(KEGG)及相关文献的收集整理,最终得出对鉴定出的代谢产物及其相关代谢通路的分析结果[11]。
2.8 数据处理
各组实验数据均用SPSS 20.0统计软件做统计学处理,结果以xˉ±s表示,对数据进行单因素方差分析,组间比较用最小显著差异(LSD)进行检验,P<0.05为有显著性差异。
3 结果
3.1 玄参对脾虚水湿不化大鼠药效学指标的影响
与空白组相比,模型组ALB、TB、HDL-C、LDL-C、CHOL、胃泌素、胃排空率、D-木糖排泄率及水负荷指数均有极显著性差异的改变(P<0.01);与模型组相比,给予玄参干预后,大鼠ALB、TB、HDL-C的含量及D-木糖排泄率与水负荷指数极显著性回调(P<0.01),LDL-C、CHOL、胃泌素及胃排空率具有显著性的改善(P < 0.05)(图1,表2)。
3.2 大鼠血清代谢总离子色谱图
应用MarkerLynx XS对大鼠血清样品的离子峰进行识别与匹配,得到空白组、模型组和玄参组的总离子流色谱图(TIC)(图2)。通过观察可说明三组数据代谢产物分离,轮廓清晰。
3.3 大鼠血清数据的分析
通过对UPLC-TOF-MS产生的数据进行分析,应用非监督性3D-PCA和多维与降维的处理,以此表现大鼠血清样本代谢轮廓的状态。结果表明空白组与模型组明显分开,提示两组之间存在显著性差异且造模成功(图3);模型组相对远离玄参组,显示出给药后大鼠血清发生了明显的变化(图4);空白组、模型组与玄参组同时比较可发现,3组均呈现出各自聚类且玄参组存在向正常给药组回调的趋势,说明玄参可改善模型组大鼠代谢的偏离(图5)。观察S-plot图可知,大多数代谢产物离子在原点周围聚集,偏离原点的离子占少数,说明两组之间存在差异(图6);执行VIP>1的筛选条件,可得到VIP-plot图并预选出潜在生物标志物(图7)。
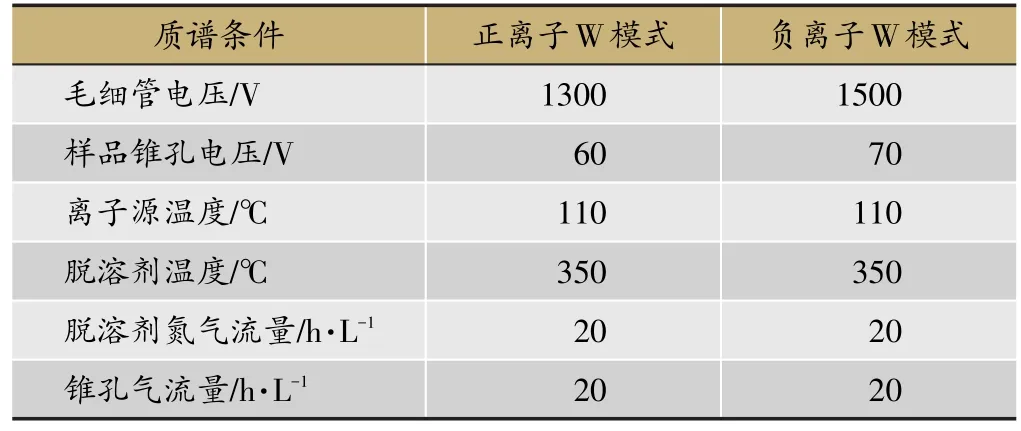
表1 样本分析方法的MS条件
表2 玄参对脾虚水湿不化大鼠药效学指标的影响(± s,n=10)

表2 玄参对脾虚水湿不化大鼠药效学指标的影响(± s,n=10)
注:*表示与空白组比较*P<0.05,**P<0.01;#表示与模型组比较#P<0.05,##P < 0.01
玄参组31.35±3.14##51.36±3.68##31.76±4.26##12.48±3.29#2.08±0.49#67.44±13.06#50.52±10.59#30.49±6.68##92.97±9.62##ALB/mg·L-1 TB/g·L-1 HDL-C/ng·L-1 LDL-C/mmol·L-1 CHOL/mmol·L-1胃排空率/%胃泌素/ng·L-1 D-木糖排泄率/%水负荷指数/%空白组34.08±3.50 58.06±4.58 34.84±3.73 11.17±2.86 1.61±0.35 70.79±11.41 53.82±7.74 31.21±6.92 75.74±11.29模型组27.12±2.71**46.03±4.28**24.65±4.88**16.02±4.01**2.74±0.75**53.16±11.28**40.76±8.40**22.84±4.97**107.90±12.34**
3.4 大鼠血清数据的潜在生物标志物
通过对大鼠血清代谢产物变化的预测,寻找符合VIP>1,fold change>1.2或<0.8及q-value>0.5的代谢产物,对空白组与模型组进行比较发现46个差异代谢产物(图8),模型组与玄参组比较发现31个差异代谢产物(图9),两者取交集共得到29个差异代谢物,即为共同潜在生物标志物(表3);经过离子强度的比较发现,与空白组相比,模型组17个生物标志物极显著性上调(P<0.01),6个生物标志物显著性上调(P<0.05),3个生物标志物极显著性下调(P < 0.01),3个生物标志物显著性下调(P<0.05);给药干预后,指标全部发生回调,玄参组13个生物标志物极显著性下调(P <0.01),10个生物标志物显著性下调(P <0.05),3个生物标志物极显著性上调(P<0.01),3个生物标志物显著性上调(P <0.05)(图10)。

图1 玄参对脾虚水湿不化大鼠药效学指标的影响

图2 不同组别大鼠血清代谢的正离子(A)和负离子(B)TIC图
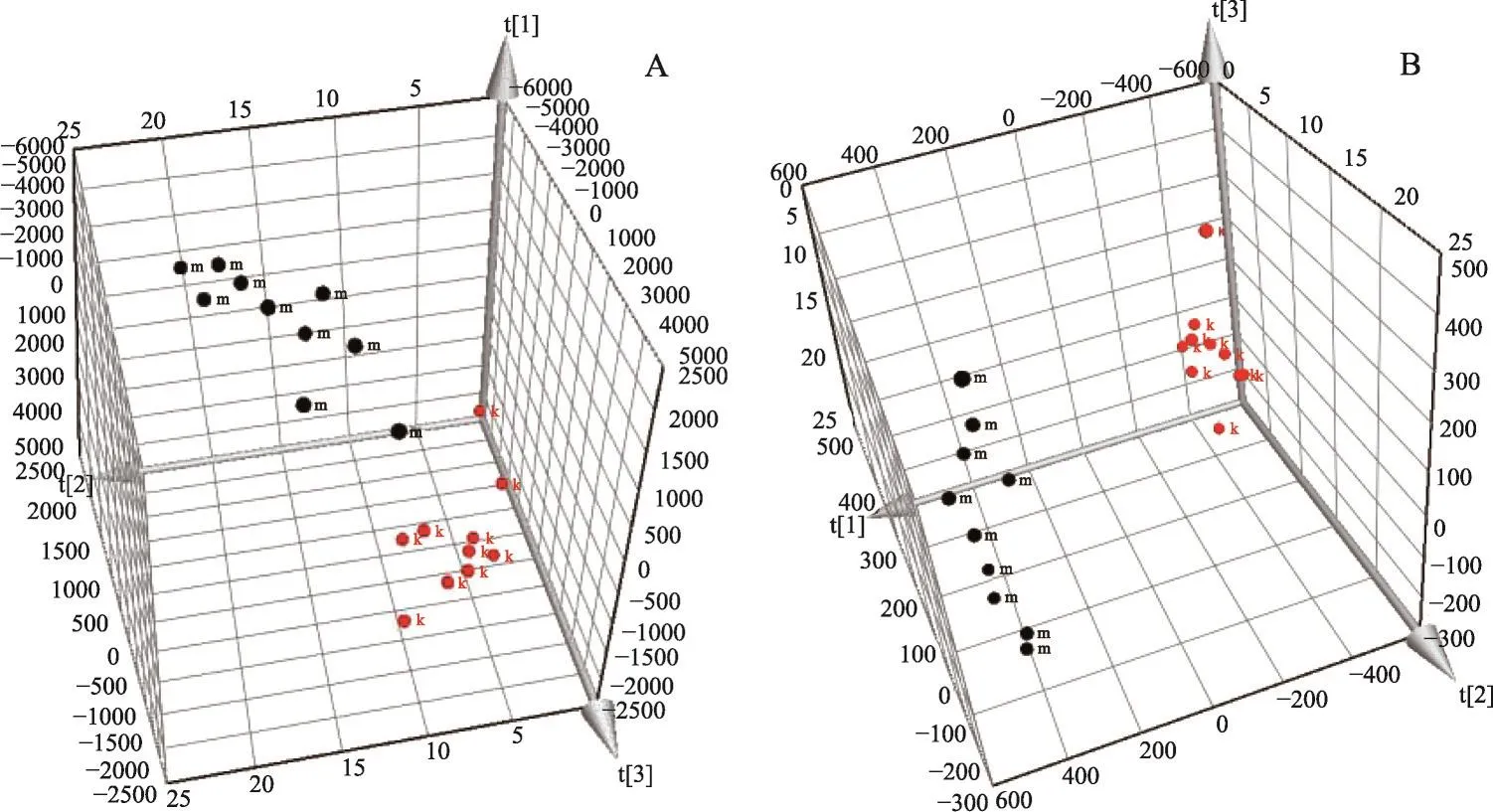
图3 来源于正离子(A)和负离子(B)模式下的模型组与空白组3D-PCA图

图4 来源于正离子(A)和负离子(B)模式下的模型组与玄参组3D-PCA图

图5 来源于正离子(A)和负离子(B)模式下UPLC分析三组3D-PCA图

图6 来源于正和负离子模式下模型组对正常(A,B)与玄参给药大鼠(C,D)的S-plot图

图7 来源于正和负离子模式下模型组对正常(A,B)与玄参给药大鼠(C,D)的VIP-plot图

图8 大鼠血清代谢产物模型组与空白组互作相关及聚类分析热图

图9 大鼠血清代谢产物模型组与玄参组互作相关及聚类分析热图
3.5 血清中潜在生物标志物的分类
针对被筛选出的潜在生物标志物,应用HMDB数据库进行分类,可知在细胞位置中,大约32%属于细胞质(Cytoplasm),36%属于细胞外基质(Cytoplasm extracellular),9%属于线粒体(Mitochondria),16%属于细胞外模(Membrane),7%属于细胞核(Nucleus);在生物功能上,大约10%属于能量源(Energy source),17%属于燃料和能量存储(Fuel and energy storage),6%属于细胞信号(Cell signaling),20%属于燃料或能量源(Fuel or energy source),25%属于膜组成(Membrane component),22%属于膜完整性(Membrane integrity);在化学成分上,大约28%属于脂类(Lipids),45%属于氨基酸和肽类(Peptides and Amino acid),7%属于核苷酸类似物(Nucleosides acid analogues),13%属于有机酸及其衍生物(Organic acids and derivatives),7%属于芳香化合物(Aromatic compounds)(图11)。
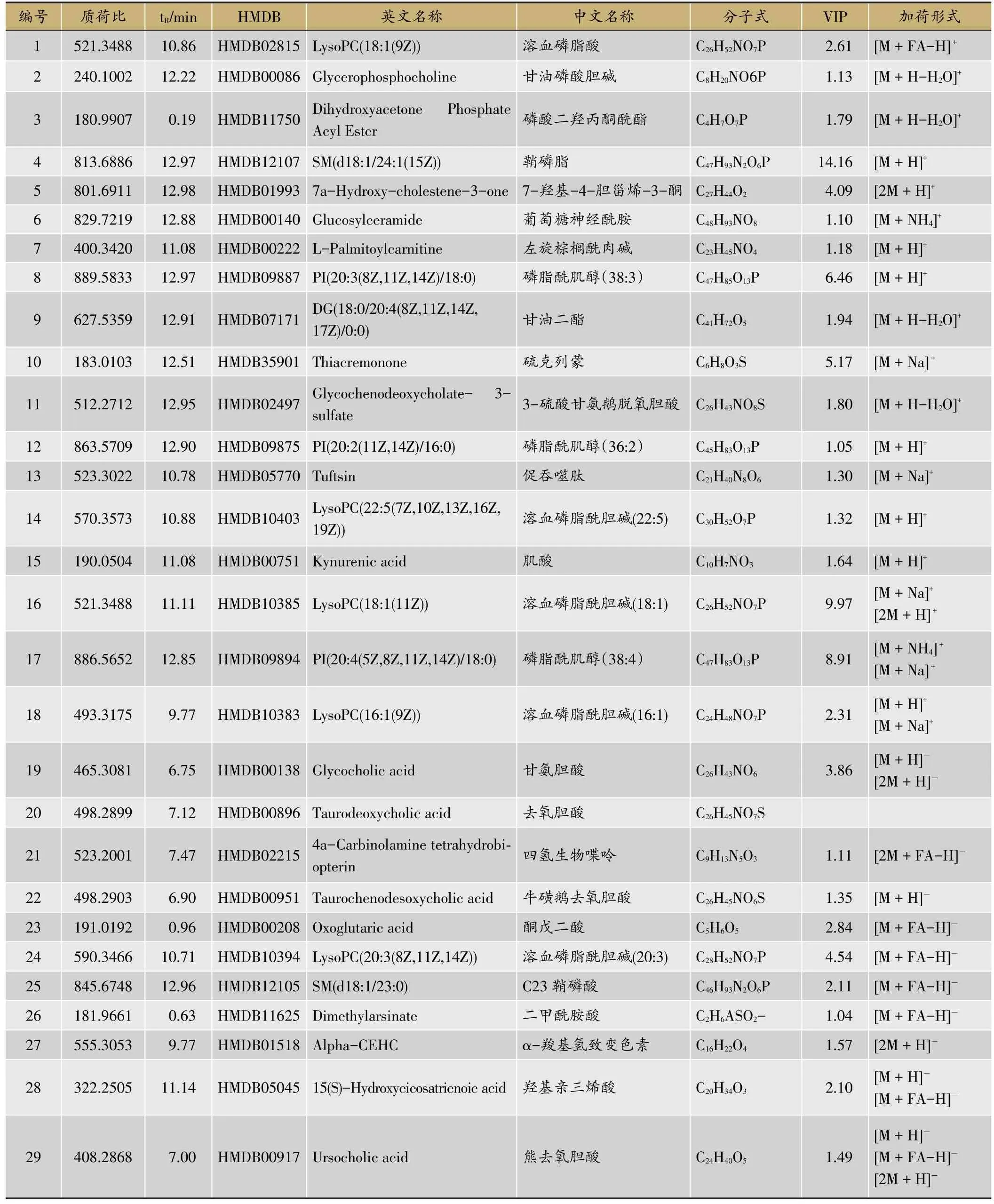
表3 在正负离子模式下玄参对脾虚水湿不化大鼠血清中共同潜在生物标志物的信息
3.6 血清中潜在生物标志物的通路分析
将被筛选出来的生物标志物进行富集,以此作为玄参对脾虚水湿不化大鼠血清代谢组学中的标志性生物标志物,通过通路分析来寻找相关的代谢途径。潜在代谢通路的临界值应大于0.10,结果显示出共作用于13个代谢通路。关键代谢途径主要富集于原发性胆汁酸生物合成(Primary bile acid biosythesis)、叶酸合成(Folate biosythesis)、鞘 脂 类 代 谢(Sphingolipid metabolism)和甘油磷脂代谢(GlycerophoSphingolipid metabolism)。在玄参给药干预后,代谢通路紊乱的现象明显改善,代谢产物的含量出现回调趋势,在代谢通路的水平上,显示出玄参对脾虚水湿不化大鼠的血清代谢有明显的治疗与缓解的作用(图12,13),(表4)。
4 讨论
4.1 原发性胆汁酸合成

图12 玄参调节代谢通路的分析图
原发性胆汁酸合成,又可称为初级胆汁酸代谢,其主要通过胆固醇的形式在肝脏细胞与微粒体中进行合成,并由胆酰辅酶A与甘氨酸调控肝脏中胆汁酸的代谢[12]。研究发现,胆汁酸具有消化及乳化胶束的膳食脂肪和油脂的功能,降低食糜对食物胶体过度的存储,体现出胆汁酸能充分发挥出表面活性剂的能力;同时,初级胆汁酸分泌量提高可促进胆汁流量的增加,改善并提升机体的消化系统对食物及脂肪的代谢功能,促进消化或代谢后能量平衡分配[13,14]。本实验研究发现,玄参可促进胆固醇通路的7-羟基-4-胆甾烯-3-酮的含量增加,直接调节胆固醇合成的速度加快;此外,去氧胆酸及牛磺鹅去氧胆酸的含量在药玄参干预后,出现下调的现象,从而抑制甘氨酸的合成增加,导致肝脏对胆汁酸的合成加快并促进胆汁的分泌,充分缓解脾虚不化大鼠胆汁酸代谢功能异常的现象。本研究也发现,玄参对胆酰辅酶A代谢的多个产物均具有下调作用,提示玄参药性微寒,对于物质及能量代谢常处于抑制的作用,故对生物标志物多为下调,但其具体原
因,需要进一步的探讨。

表4 利用MetPA分析玄参调节的代谢通路

图13 玄参对共同潜在生物标志物及主要代谢通路的影响
4.2 叶酸合成
叶酸合成,亦可称叶酸代谢,主要作为机体的甲基提供者,参与细胞中脱氧核糖核酸的合成及一系列的甲基化反应[15]。叶酸主要由谷氨酸、喋啶核和对氨苯甲酸这3种化学成分组成,其生物功能一般为一碳单位合成的供体、胸腺及嘌呤嘧啶的参与者、氨基酸代谢及血红蛋白的载体等[16]。近来研究表明,叶酸代谢存在的个体差异性较大,其对机体内部的改变及外部环境的影响具有灵敏的反应,因此,叶酸含量是衡量机体是否处于健康的一个关键因素,故普遍认为机体叶酸缺乏是疾病发生的重要诱因[17,18],但机体内叶酸过量常会导致食欲不振、消化不良等症状,其与脾虚水湿不化反应相似。本研究结果显示,给与玄参干预脾虚水湿不化模型大鼠后,导致四氢生物喋呤及四氢生喋呤醇氨的分泌量减少,减慢体内细胞对叶酸合成的速率,改善机体叶酸的水平;提示研究还发现对于四氢喋呤的同分异构体,例如:乳酰四氢喋呤、6-丙酮酰四氢喋呤及7,8-二氢喋呤等,均具有一定的下调作用,说明玄参对叶酸合成代谢的影响可能体现出中药多靶点的特性。
4.3 鞘脂类代谢
鞘脂类代谢是一种存在于机体神经细胞膜或脑组织中,主要通过已鞘氨醇为基础化合物的复杂反应[19]。鞘脂类代谢主要代谢产物有脂肪酸、鞘氨醇及磷酸胆碱等,其中神经酰胺是代谢过程中最为重要的中间产物,也是近年来对鞘脂类代谢对于疾病预防与治疗方面研究关注的重点[20]。本实验给药后发现,鞘磷脂与葡萄糖神经酰胺均出现下调的趋势,两种物质均与神经酰胺具有紧密的联系,表明玄参通过神经酰胺来影响鞘磷脂代谢通路,改善脾虚不化模型大鼠脂类代谢异常的现状,从而提升机体对病机的免疫调控能力。
4.4 甘油磷脂代谢
甘油磷脂代谢是广泛存在于机体内一种特殊性的水解反应,其主要通过各种磷脂酶的水解作用,维持与平衡新陈代谢的运作,从而保证机体内能量与各种代谢的正常进行,故磷脂酶的含量减少,将会产生大量磷脂胆碱类化合物并导致严重的肝脾功能紊乱,发生各种精神障碍及代谢异常的疾病[21]。实验结果显示,玄参干预后溶血磷脂胆碱与甘油磷酰胆碱的含量降低,导致磷脂胆碱的分泌量减少,可促进磷脂酶含量的增多并提升机体的免疫能力,确保各项代谢能平稳进行。
本研究通过血清代谢组学方法,寻找出29个具有生物学意义的差异潜在生物标志物,初步探究玄参治疗脾虚水湿不化的代谢通路,主要的四条分别是:原发性胆汁酸生物合成、叶酸合成、鞘脂类代谢和甘油磷脂代谢。故表明玄参对脾虚水湿不化病证具有一定的治疗作用,从而为玄参古存今失的利水功效提供理论依据的支撑,为进一步临床的合理安全应用提供科学的论证。
