荧光免疫分析法检测食品中黄曲霉毒素的研究进展
2019-01-29左晓维雷琳刘河冰陶晓奇
左晓维,雷琳,刘河冰,陶晓奇, 3*
1(西南大学 食品科学学院,重庆,400715) 2(北京维德维康生物技术有限公司,北京,100095) 3(重庆市特色食品工程技术研究中心,重庆,400715)
20世纪中叶,英国爆发了大量火鸡突然死亡事件,研究者们在喂养的饲料中发现了黄曲霉毒素(aflatoxin,AFT)。AFT是食品感染了寄生曲霉或黄曲霉后在高温高湿(温度为25~30 ℃,水分>15%)的环境中,产生的一类次级代谢产物。目前已发现的AFT有20多种,主要以4种天然毒素(B1、B2、G1、G2)和2种代谢产物(M1和M2)的形式存在。AFM1多发现于牛奶中,是因为牛食用了含有AFB1的饲料,在体内酶的催化下生成了羟基化代谢物。AFT是由1个毒性结构(二呋喃环)和1个与致癌有关的结构(氧杂萘邻酮)组成的共同结构[1],表现出极强的毒性和明显的致癌作用。早在1993年,国际肿瘤研究机构(International Agency for Research on Cancer,IARC)就将AFT认定为I类致癌物[2]。其中危害最大的AFB1属于特剧毒物质,致癌能力也最强,其次是AFG1和AFM1,其余的毒性较弱。
黄曲霉毒素毒性大,污染范围广,在粮食及粮食制品、油脂、乳及乳制品、调味品、坚果、茶叶等100多种食品中均有发现[3]。为此,各国相继出台了严苛的法律法规,制定了食品中AFT含量的限量标准,如表1所示。
准确、快速、便捷地检测出食品中的AFT,是科学有效地处理已污染食品的必要前提。目前,检测AFT的方法分为化学分析法、生物鉴定法、仪器分析法和免疫分析法等。化学分析法中的薄层层析法曾于1990年被美国分析化学家协会定为检测AFT的标准方法[7],但它是1种半定量的检测方法,灵敏度低,需与标准品直接接触,危险性高,其应用在近年来受到限制。生物鉴定法为定性分析,通常只作为佐证[8]。仪器分析法是国标检测方法之一,结果准确可靠、重复性好,但仪器购买和维护昂贵,前处理复杂,分析时间长,不适合现场大量样本的快速检测,难以在基层大范围推广[9]。中国地域宽广、人口众多、食品需求量大,但食品的贮存条件、加工水平、检测技术相对落后,开发特异性强、灵敏度高、简便快捷、经济安全的免疫学方法是解决食品中AFT污染问题的突破口之一。目前,用于AFT检测的免疫学方法有:酶联免疫吸附法[10]、胶体金免疫层析技术[10]、荧光免疫分析法[11]、化学发光免疫分析法[12]、免疫传感器等[13]。
1941年,CONS和KAPLAN用荧光素标记抗体,来定位组织中的抗原,第一次提出了荧光免疫分析法(fluorescence immunoassay,FIA)的概念[14]。FIA在高特异性免疫学反应的基础上,结合了荧光技术的灵敏性,具有灵敏度高、准确性好,易实现高通量、自动化检测等优势,在医学、生物学和环境学等领域得到了迅速的发展。近几年,随着人们对食品安全的重视程度不断加深,FIA逐渐被应用于食品检测领域。由于AFT在食品中存在的广泛性和极大的危害性,成为研究者们关注的热点,并依据FIA原理研发出各种新型的检测技术。本文综述了4类主要的荧光标记物,并重点阐述了5类荧光免疫分析法的原理及其在食品中AFT检测方面的研究进展,以期为食品安全监控和更深入的科学研究提供有益参考。

表1 中国、美国和欧盟对食品中黄曲霉毒素的限量标准
1 荧光标记物
某些物质能够在紫外光的激发下辐射出各种颜色、不同强度的可见光,这种光线会随着激发光的消失,存在短于1 s的时间后消失,辐射光被称作荧光[15],荧光产生的本质是随着电子从高能态跃迁回基态,能量以光的形式被释放出来。将这些物质作为荧光标记物应用到FIA中,根据检测原理和检测形式的不同,通过功能性基团或亲和素-生物素,将荧光标记物与抗原、抗体或核酸等生物识别分子偶联,形成荧光标记复合物,作为荧光探针,具有示踪和反映免疫反应进程的特性。目前在AFT检测中常用的荧光标记物有荧光素、量子点(quantum dots,QDs)、上转换纳米粒子(upconversion nanoparticles,UCNPs)和稀土离子螯合物(表2)。
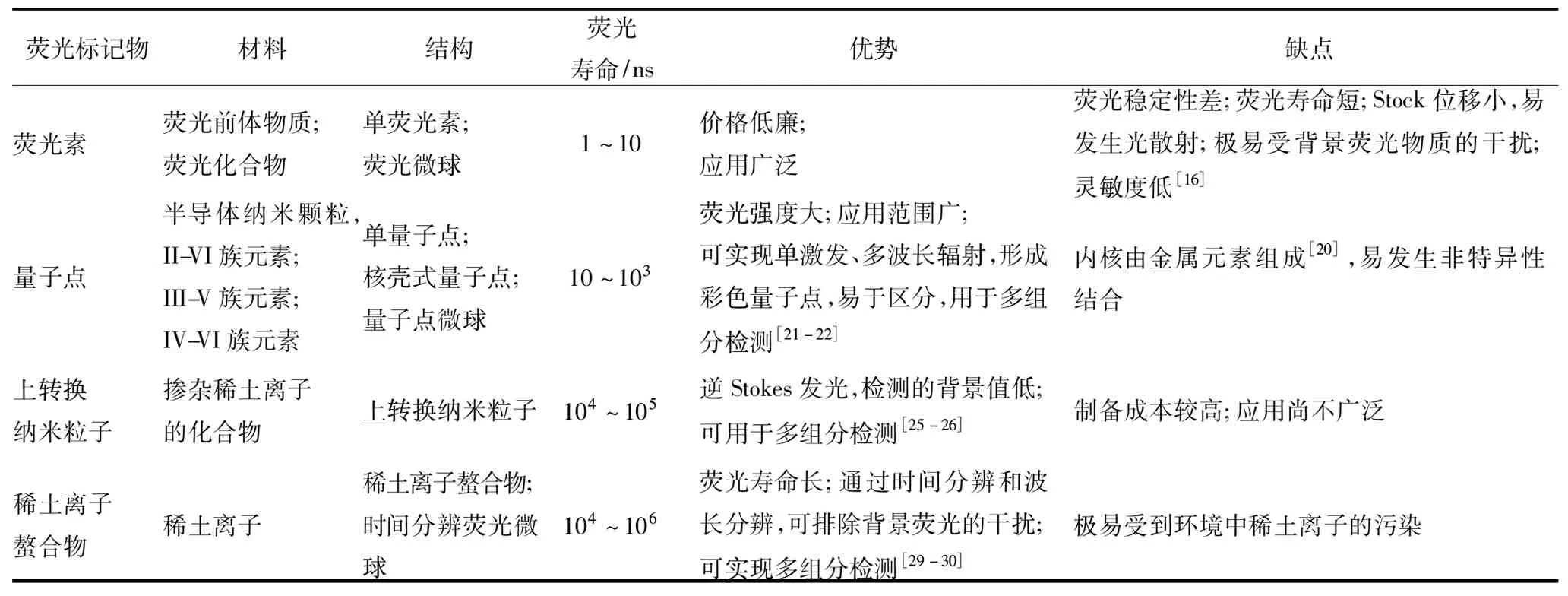
表2 荧光标记物的主要特点
1.1 荧光素
荧光素是一类具有荧光特性的化合物,在紫外光的照射下,比其他颜色标记物的溶剂变色效应更显著。荧光素中含有能与多肽共轭连接的基团,标记蛋白质、核酸、多肽、小分子待测物等各种生物识别物质,用作荧光探针。目前,FIA中使用的荧光素主要有两类,一类是需要经酶催化的荧光前体物质,包括4-甲基伞酮磷酸盐(碱性磷酸酶的底物)、4-甲基伞酮-β-D半乳糖苷(β-半乳糖苷酶的底物)和对羟基苯乙酸(辣根过氧化物酶的底物)等。另一类是可被紫外光直接激发的荧光物质,如异硫氰酸荧光素、有机荧光染料(罗丹明类、香豆素类)、β-藻红蛋白、伞形酮衍生物和德克萨斯红等。
大部分荧光素光化学稳定性差,光照时易分解,易被光漂白,高浓度下易淬灭[16],故近几年在检测食品中AFT的研究中常用二氧化硅、聚苯乙烯、聚乙烯等材料包裹荧光素,制成球形的、表面多孔的荧光微球,再在微球表面修饰用于标记的羧基或氨基等基团。荧光微球的结构更稳定、发光效率更高,检测的准确性和灵敏度更高[17-19]。
1.2 量子点
QDs是准零维的半导体纳米颗粒,目前研究较多的是由II-VI族元素(CdSe、CdTe、CdS、ZnSe、ZnS等)和III-V族元素(InP、InAs等)组成的[20],也有少数是由IV-VI族元素(PbS、PbSe等)组成的核壳式结构。QDs是理想的荧光标记物,它的发射光谱窄,激发范围宽,荧光量子产率高,荧光发射可测量,稳定性好,信噪比高,能够准确地检测和量化其荧光强度[21],荧光寿命长于背景荧光的寿命(1~10 ns),已被广泛用于提高FIA的检测灵敏度。不同尺寸的QDs可实现单激发、多波长辐射,形成彩色QDs,在标记多种真菌毒素的抗体后,可以实现同步检测食品中的AFT和其他毒素,能够有效提高检测效率[22]。但QDs易在光氧化作用下释放出有害的重金属离子,在某些缓冲液或极端化学环境中发生荧光淬灭[23]。在AFT的检测中,研究者们通过将数以万计的QDs包裹于二氧化硅等无机材料中,制成量子点微球(quantum dot beads,QBs),改善了QDs的光性质,提高了其稳定性和安全性[24]。
1.3 上转换纳米粒子
上转换发光也称逆Stokes发光,与荧光素、QDs和背景物质的荧光激发和发射相反,是将长波长的激发光(近红外光)转换成短波长的发射光。其特殊的发光机理使UCNPs成为一种优越的生物标记材料,具有可用于复杂生物样本;不易被光漂白;检测的背景值低;对生物组织穿透性好(>10 mm)、无损伤;改变掺杂元素的种类和比例,实现单激发、多谱带发射,可用于多组分同时检测等优点[25-26]。目前研究较热的上转换发光材料有NaYF4∶Yb/Er(NaYF4是目前上转换发光效率最高的基质材料,Er是激活剂,Yb是敏化剂)、Y2O3∶Yb/Er和LaF3∶Yb/Ho,是检测食品中AFT的一种新型荧光标记物[27]。
1.4 稀土离子螯合物
稀土离子是指从元素镧到元素镥的15种元素,也称镧系离子,其中应用最广泛的是铕(Eu3+)。当其与高吸光系数的配体结合形成螯合物时,本身发光能力较差的稀土离子,可发出高强度的特征荧光[28]。稀土离子螯合物的Stokes位移较大,可避免激发光的干扰;荧光寿命较长,通过延迟检测时间,能最大程度地降低本底信号;体积小且不影响被标记物的结构和稳定性,可多位点标记,实现对多种目标物质的同时检测[29-30]。也可用溶胀法或包覆法将稀土离子螯合物制备成时间分辨荧光微球(time-resolved fluorescent microspheres,TRFM),使每个生物分子上偶联的稀土离子的平均数增加,且不需要加入增强液即可直接进行荧光测定[31-32]。因其独具时间分辨和波长分辨的特点,稀土离子螯合物已成为检测食品中AFT的新技术研发热点。
2 荧光免疫分析法在黄曲霉毒素检测中的应用
荧光免疫分析法的原理是当制备好的荧光探针在发生特异性的免疫反应后,其荧光强度或与待测物质的量相关,或因大小、距离的变化而发生改变。根据检测原理的不同,荧光免疫分析法分为荧光免疫吸附法(fluorescence-linked immunosorbent assay,FLISA)、荧光免疫层析法(fluorescent immunochromatographic assay,FICA)、荧光偏振免疫分析(fluorescence polarization immunoassay,FPI)、荧光共振能量转移免疫分析(flurescence resonance energy transfer immunoassay,FRET)和时间分辨荧光免疫分析(time-resolved fluoroimmunoassay,TRFIA)(表3)。其中FPIA和FRET是均相反应体系,TRFIA既适用于均相体系,也可用于非均相体系。FIA的形式多样、灵敏度高、高通量、可定量,丰富了食品检测技术的多样性,已逐渐成为检测食品中AFT的重要方法。

表3 检测食品中AFT的荧光免疫分析法比较
2.1 荧光免疫吸附法
FLISA采用免疫吸附的检测形式,用荧光标记物取代酶、化学发光物质、放射性核素等传统的标记物。经过包被、封闭、反复洗涤等操作,直接激发荧光标记物,荧光信号强度与待测物的量成正比或反比。该方法比酶联免疫吸附法的检测灵敏度高,可满足检测食品中微量或超微量AFT的需求,是目前使用最广泛的技术。
ZHANG等[33]成功地将碲化镉QDs标记到AFB1的单克隆抗体上,建立了直接竞争FLISA,该方法的检测限为0.016 ng/mL,在空白花生基质中添加AFB1标准品,回收率为85%~117%。BELOGLAZOVA等[34]用脂质体包裹水不溶性的QDs,使其在水性介质中仍保持较高的发光产率,用作荧光标记物标记AFB1和AFM1的抗原,与微孔中预包被的AFB1抗体发生特异性免疫反应,检测牛奶中AFM1的检测限为0.002 5 μg/kg。FLISA通常使用96孔微孔板作为固相载体,搭配彩色QDs,更易于实现多组分的检测,BELOGLAZOVA等[22]又利用彩色QDs开发了2种不同形式的多重FLISA,可同时筛选谷类中的多种真菌毒素。在第1种形式中,同一平板的不同微孔可以同时检测多种毒素,称做单一分析物的多重检测,第2种形式叫做双分析物的多重检测,用2种颜色的QDs分别标记玉米赤霉烯酮和AFB1,再将其2种不同的特异性抗体固定在同一个微孔中。这2种不同的模式丰富了检测形式的多样性,为食品样本中有毒有害物质的高通量筛选提供了更多可能。
磁性纳米颗粒(magnetic nanoparticles,MNPs)具有易于分离的特点,替代微孔板成为更优的固相载体。WU等[26]以人工抗原修饰的MNPs作为免疫传感探针,以抗体偶联的多色UCNPs作为荧光探针,建立了同时检测玉米中AFB1和赭曲霉毒素A(ochratoxin A,OTA)2种毒素的新型FLISA。这种方法结合了UCNPs多组分检测的特性和MNPs的磁性分离效应,在保证高灵敏度的基础上实现了AFB1和OTA的多组分同时检测,节约了一半的检测时间,且AFB1和OTA的检测限均低至0.01 μg/kg。ATANASOVA等[35]创新地用荧光素标记由AFM1转化成的AFM1-肟,与原料乳中的AFM1竞争结合MNPs上偶联的抗体,在磁性分离去除免疫复合物后,通过检测上清液的荧光强度进行定量分析,检测限为2.9 pg/mL,定量范围为3.0~100 pg/mL。并对比发现灵敏度在分析不同品种的原料乳时存在差异,样本为高脂肪浓度的羊乳时最低。
FLISA在AFT检测方面发展了多种多样的形式,利用QDs和UCNPs可实现单组分和多组分的检测,结合MNPs既可以作为固相载体增加抗原抗体反应效率,也可以作为免疫传感探针的特性,提高了食品中AFT检测的灵敏度和自动化程度。
2.2 荧光免疫层析法
传统免疫层析技术以胶体金为标记物,通过条带显色或读取灰度值对目标物进行定性分析或半定量检测,但其灵敏度较差,难以准确定量。FICA既保留了传统胶体金免疫层析技术可用于现场快速检测的优点,又具有FIA高灵敏度的特点,是一种新型的膜检测技术,能够快速、简便、准确测量食品中的AFT。
REN等[24]采用微乳液技术制备QBs,标记AFB1的单克隆抗体,用制备的荧光定量试纸条检测玉米样本中的AFB1,检测限为0.42 pg/mL,使用QBs所能达到的灵敏度是使用QDs的39倍。ZHANG等[17]选用羧酸盐修饰的聚苯乙烯荧光微球作为荧光标记物。在最优条件下,牛奶样本中AFM1检测限为4.4 ng/L,整个检测过程可在30 min内完成。刘晓等[36]基于UCNPs开发了检测奶粉和牛奶中AFM1的快速FICA,能够在20 min内完成定性及定量检测,奶粉和牛奶中的检测限分别为0.1、0.3 μg/kg,检测限和检测时间均优于ZHANG等[17]的报道,但不同的原料特性和检测条件会影响比较的结果。WU等[18]在相同条件下对比了基于荧光微球和QDs 2种荧光标记物的FICA,检测牛奶中的AFM1,使用荧光微球时的检测限更低(42.3 pg/mL),准确性更好,精确度更高,方法的可靠性强;使用量子点时总的检测时间更短(15 min),消耗的抗体量更少(0.01 μg),该研究方法可作为筛选适当荧光标记物的重要参考。FICA除用于检测常见的粮食、牛奶等样本外,也可用于深色食品的检测。LIU等[19]首次用基于荧光微球的FICA定性检测酱油中AFB1,10%甲醇溶液稀释酱油样品后直接用于检测,省略了提取程序,大幅度降低前处理的复杂性。此方法定性分析AFB1的检测限为2.5 μg/L,低于国标规定的最高限量5 μg/L。
FICA的建立和其多样性的发展依赖于多种荧光标记物的合成,尤其是近几年使用较多的各种荧光材料微球的制备。在食品中AFT的检测方面,应用最多的标记物是QBs和UCNPs,借助这2种荧光材料的特点,多组分同时分析成为检测食品中AFT和其他有毒有害物质的发展趋势。
2.3 荧光偏振免疫分析
FPIA是一种均相的、快速的、高通量的免疫学检测方法。其检测原理是当荧光探针发生特异性免疫反应后,分子质量变大,自旋速度变慢,偏振荧光强度增强。整个过程无需分离和洗涤等步骤,经过短暂的温育后便可直接测量。FPIA主要用于小分子物质的测定,在检测AFT的报道中,常采取竞争的反应模式,偶联有荧光标记物的AFT与样本中的AFT竞争结合特异性抗体,偏振荧光强度与样本中AFT的量呈反比[37]。
NASIR等[38]报道了一种基于FPIA的便携、快速的分析仪,检测玉米、高粱、花生油、花生酱等11种真实样本中的AFB1,与高效液相色谱的相关性为0.97。但该方法不适用于检测添加回收的爆米花样本,回收率较低。SHENG等[39]也建立了FPIA检测AFB1的方法,检测限为13.12 ng/mL。AFB1、AFB2、AFM1、AFM2、AFG1和AFG2与制备的AFB1的单克隆抗体的交叉反应率分别为100%、65.7%、111.4%、2%、143%和23.5%,表明该方法可以用于除AFG2和AFM2之外的AF总量的检测。在1个微孔板上分析96个样品所需的总时间少于5 min,有效地减少了检测时间。ZHANG等[40]开发的双波长FPIA,也能够检测玉米中AFT的总量,同时还能检测6种玉米赤霉烯酮类似物的总量,用不同的荧光素标记AFB1和玉米赤霉烯酮,然后与相应的特异性抗体结合。玉米样本中AF总量和6种玉米赤霉烯酮类似物的总量的检测限分别为4.98 μg/kg和11.03 μg/kg,平均回收率为78.6%~103.6%,变异系数在19.2%以下。整个检测过程,包括样品制备,总时长不超过30 min,很大程度上提高了检测的效率。FPIA也适用于特殊样本的检测,BELOGLAZOVA等[41]利用FPIA快速筛选啤酒中的AFB1。因为啤酒样品的基质特殊,在分析之前需用含有1% PEG 6000的硼酸盐缓冲溶液稀释,再通过装有NH2-衍生二氧化硅的净化柱,AFB1的检测限为1 ng/mL。但此种前处理方法只适用于贮藏啤酒,不适用于麦芽啤酒和黑啤。这是为数不多的使用FIA检测啤酒样本的研究,为之后检测各种食品基质中的AFT提供参考。
FPIA在检测食品中AFT方面的报道较少,主要是因为其相对于其他方法的灵敏度和准确性低,不能满足实际AFT检测中的低限量要求。但双波长FPIA检测技术的报道,为实现多组分同时分析提供了一定的技术支持。
2.4 荧光共振能量转移免疫分析
1948年,科学家FÖRSTER首先提出了FRET的理论,当2个荧光基团足够靠近时(1~10 nm),通过双偶极相互作用,激发态的供体分子和基态的受体分子之间发生非辐射性的能量共振转移,供体分子跃迁到基态而不激发荧光,受体分子由基态跃迁到激发态,再跃迁回基态的同时发射荧光或发生荧光淬灭。FRET的效率主要由供体与受体的距离、光谱的重叠度和偶极间的相对方向决定[42]。FRET具有均相反应高效、简便、快速,无需额外的洗涤和分离步骤等优点。在AFB1的检测中,需要根据不同的荧光光谱特征,选择合适的能量供受体,QDs因为其吸收光谱宽,通常被用作受体。
ZEKAVATI等[43]分别用CdTe QDs标记抗体,荧光素罗丹明123标记抗原,作为能量供受体,利用CdTe量子点的荧光发射光谱(最大发射波长为505 nm)与罗丹明123的荧光激发光谱(最大激发波长为510 nm)有重叠,建立FRET检测AFB1,检测限可以达到2×10-11mol/L。
ASWANI等[44]用Cd/Se QDs标记核酸适配体作为能量供体,同时采用新型的高效淬灭剂-氧化石墨烯(graphene oxide,GO)作为能量受体。利用核酸适配体分别与GO和抗原之间的π~π堆积作用和特异性反应,缩小或拉大供受体之间的距离,使QDs的荧光发生淬灭或恢复的变化。在玉米和小麦中AFB1的检测限为4 μg/mL,线性范围为2~200 μg/mL。SABET等[45]同样也用核酸适配体代替抗体,创新地将免疫学方法与生物传感器技术相结合,开发了一种基于FRET的免疫传感器,检测花生和大米中AFB1的含量。在空白样本中,QDs标记的核酸适配体会吸附到胶体金纳米颗粒(Au nanoparticles,AuNPs)的表面,导致QDs的荧光淬灭。当样本中含有AFB1时,特异性的核酸适配体结合AFB1,拉大了与AuNPs之间的距离,荧光恢复。该方法的检测限为3.4 nmol/L,与常见的干扰物质,如AFB2、AFG2和AFM2,均未有显著的交叉反应。XU等[46]在FRET免疫传感器基础上,使用2种辐射波长的绿色QDs和红色QDs,分别标记AFB1的多价半抗原和单克隆抗体,作为供体和受体,考察不同标记比率对FRET效率的影响。在pH 7.4,含10 mmol/L NaCl和10%体积分数甲醇的磷酸盐缓冲液作为最优工作液,检测时间为加样后20 min的条件下,通过分析傅里叶红外光谱、荧光光谱和透射电子显微镜的图像,得到荧光信号强度与AFB1浓度之间的依赖关系,定量检测大米中AFB1的含量。该检测方法的灵敏度高,检测限为0.13 pmol/L,定量检测的线性范围为0.19~16 pmol/L。
FRET的建立除了可以使用荧光标记物,也可利用AFB1抗体的内荧光淬灭现象,AFB1的抗体中含有的内在荧光物质-色氨酸残基,在与抗原结合时会发生荧光淬灭。LI等[47]巧妙地利用了这一原理,建立了大麦样品中AFB1的定量检测方法,检测限为0.85 ng/mL。进一步研究表明,结构完整的抗体的辐射光只有部分被淬灭,改用抗体的Fab片段作为受体,其荧光几乎被完全淬灭,检测限为0.09 ng/mL,提升9.4倍。利用改造后的抗体作为淬灭材料是提高检测方法灵敏度的一种新思路。
检测小分子物质的竞争性免疫分析方法,信号强度和分析物浓度呈负相关,这限制了竞争法的灵敏度。基于FRET的荧光淬灭法使信号强度和分析物浓度呈正相关,在一定程度上提高了检测的灵敏度。大量的研究将FRET和免疫传感器技术结合,推动了AFT和其他有毒有害物质的检测向微量化、高通量和自动化的方向发展。
2.5 时间分辨荧光免疫分析
1983年,SOINI和KOJOLA等首次用稀土离子螯合物作为标记示踪物,结合时间分辨荧光测量技术,开创了一种新的非放射性微量分析技术-TRFIA[48]。其中,铕(Eu3+)、钐(Sm3+)和铈(Ce3+)及其螯合物是最常使用的荧光标记物。相比于其他的FIA,借助稀土离子螯合物荧光寿命长的特点,在每个激发光脉冲后延迟测量时间,待短寿命的荧光淬灭后再选择性测定稀土离子螯合物的荧光,以达到消除背景荧光干扰的目的,实现时间分辨和波长分辨,具有更高的灵敏度和更低的干扰性,一直是研究的热点。在AFT等小分子检测领域常用间接竞争、直接竞争模式。
不同的镧系元素有着激发波长相同,发射波长不同的特点,如Eu3+和Sm3+的激发光的波长均为340 nm,发射光的波长分别为613 nm和610 nm。利用这一特点,HUANG等[30]报道了一种用于同时定量测定AFB1和OTA的双标记TRFIA。首先用2种抗原包被微孔板,随后添加标准品和样品,最后加入已稀释的抗体、Eu3+和Sm3+分别标记的山羊抗鼠IgG,读数前加入增强液。结果表明,AFB1的检测限为0.02 μg/L,定量范围为0.021~100 μg/L,AFB1和OTA的检测互不干扰,一次操作可同时得到两种目标物质的检测结果,节省了近一倍的检测时间。双标记TRFIA和单标记TRFIA与高效液相色谱的相关系数分别0.972和0.981,结果一致。
TRFIA的检测形式多样,既可建立上述的时间分辨免疫吸附法,也可利用TRFM建立时间分辨荧光免疫层析法(chromatographic time-resolved fluoroimmunoassay,CTRFIA)。张兆威等[31]成功利用乳胶包裹Eu3+的TRFM,检测花生、稻米、植物油中AFB1,检测限是0.3 μg/kg,线性范围分别是0.8~25.0 μg/kg、0.8~15.0 μg/kg和0.8~30.0 μg/kg。同年,TANG等[32]也利用TRFM建立了一种高灵敏度的CTRFIA,无需任何样本前处理过程,可在6 min内准确检测出原料乳中AFM1的含量。使用TRFM标记AFM1的单克隆抗体2C9,在竞争模式下,该方法的检测限为0.03 ng/mL,灵敏度比之前报道的胶体金免疫层析法提高了10倍。一方面是因为2C9和AFM1之间的亲和力较高,另一方面因为每个直径190 nm的TRFM中包裹了约20亿个EU3+,且能标记更多的抗体,提高了免疫测定探针的荧光强度。TRFM的成功制备和在侧向流层析体系的迅速应用,丰富了AFT的检测形式,降低了检测时间,提高了检测效率。
TRFIA同样也可以与生物传感器技术相结合,2015年,ZHANG等[49]又开发了一种超灵敏的、便携式的CTRFIA的免疫传感器,用于现场快速测定食品中的AFB1。在时间分辨模式下,没有激发光源引起的信号干扰,具有放大的正向信号和较低的信噪比。其检测范围宽,为0.20~60 μg/kg,检测限低,从0.06 μg/kg到0.12 μg/kg,不同食品基质中(花生、玉米、酱油、植物油)的回收率为80.5%~116.7%。
TRFIA兼具时间分辨和波长分辨的特点,可以有效地减少样本的背景干扰,大幅度提高检测的灵敏度。近几年,为适应定量、便捷和快速检测的要求,建立了真菌毒素检测的时间分辨多组分分析法,并且相继开发了检测AFT的CTRFIA和时间分辨免疫传感器等方法,为现场大通量快速筛选食品中的AFT打下了坚定的技术基础。
3 展望
自放射免疫分析技术之后涌现了很多非放射性的免疫分析方法,用于食品中黄曲霉毒素的检测,其中荧光免疫分析法的形式多种多样,灵敏度高,操作简便,高通量,准确性高,符合现代检测领域快速、定量和便捷的发展趋势。荧光物质的稳定性差是荧光检测技术发展的瓶颈。用有机材料将数以万计的荧光物质包裹成纳米微球,有增加稳定性,减少非特异性吸附,提高荧光强度的作用,可以有效增加荧光检测方法的灵敏度和适应性。多组分物质的同时检测是检测技术新的发展趋势。荧光免疫分析法在多组分析方面有着无可比拟的优势,除稀土离子螯合物可实现多位点标记之外,彩色量子点和上转换纳米颗粒均有着单激发、多谱带发射的优点,在多组分分析中占据着重要地位。除此之外,食品中AFT的荧光免疫分析还可以从以下3个方面进一步研究和发展。
3.1 荧光标记物
荧光标记物是荧光免疫分析法的核心之一,其特性与检测的灵敏性和稳定性直接相关。在检测食品中AFT的进一步研究中,一方面需优化现有荧光标记物的制备工艺。增强荧光的稳定性,提高对基质的耐受性,防止发生荧光淬灭,例如镧系离子(除Eu3+之外)的稳定性仍不能达到准确定量检测的要求;提高荧光强度,放大荧光信号;减少荧光标记物与其他物质的非特异性结合。另一方面是开发新材料,例如使用近红外的荧光材料,可最大限度避免背景荧光物质的干扰。研发多种颜色的荧光标记物,不仅易于区分辨别,更有利于实现多组分的同时检测。
3.2 新型分子识别物
抗体是荧光免疫分析法的另一个核心。虽然抗体的灵敏度高、特异性强,但传统地通过ELISA筛选出的抗体适应相差,并不适用于所有的荧光免疫分析法,用待建方法筛选抗体,成本较高。因此,可使用基因重组抗体、多肽片段、分子印记聚合物等具有抗体功能的生物识别大分子代替抗体应用于检测食品中的AFT。基因重组抗体的制备是利用分子生物学去除或减少抗体的无关和产生副作用的结构,其制备周期短,分子量小,可操作性强。已证明羊驼基因重组抗体的使用能够提高检测玉米和玉米制品中的AFB1和ZEN的灵敏度[50],分别比使用单克隆抗体的灵敏度高18.3倍和20.3倍。
3.3 荧光免疫分析法的优化
可从样本的前处理、新型荧光读取仪和与其他技术联合使用等方面优化荧光免疫分析法。用免疫亲和柱或磁珠对样本的待测物质进行富集,去除基质干扰,使后续的荧光免疫反应具有高度特异性。研发信噪比高、读取稳定、可设置读取范围和数量、可携带的新型的荧光读取仪,搭配内置的标准曲线和云储存空间,实现多组分检测和现场的快速高通量定量检测。将荧光免疫分析法与其他技术,如信号循环放大技术、芯片技术相结合,进一步提高检测的灵敏度和方法的集成化。
本文综述了4类荧光标记物的特点和5种荧光免疫分析法的检测原理,重点阐述了荧光免疫分析法应用于检测食品中黄曲霉素时的多样化发展现状。研发基质耐受性强、荧光强度高、可用于多组分检测的荧光标记物,方法适用性更强的新型分子识别物替代抗体和样本前处理方法、新仪器、技术联用将是荧光免疫分析法的3个发展趋势,以期为食品中AFT等毒素快速检测的未来研究提供参考。
