顶空固相微萃取-气相色谱串联质谱结合保留指数分析杭白菊挥发性成分
2019-01-29张鹏云李蓉李浩洋龙春霞杨璐齐张峰
张鹏云,李蓉,李浩洋,龙春霞,杨璐齐,张峰
1(广东药科大学 公共卫生学院,广东 中山,528458) 2(中山出入境检验检疫局 检验检疫技术中心,广东 中山,528400) 3(中国检验检疫科学研究院 食品安全研究所,北京,100176)
菊花(Chrysanthemiflos)是菊科菊属宿根性草本植物的干燥头状花序,根据产地和加工方法主要分为“亳菊”、“滁菊”、“贡菊”、“杭菊”和“怀菊”等[1]。2009年卫生部把菊花加入“药食同源”物品名单[2]。杭白菊产于浙江桐乡,在我国有悠久的栽培历史,具有抗炎、抗肿瘤、抗氧化、保护心血管等多方面的生物活性[3],而挥发油在抗肿瘤、解热镇痛、抗病毒、抗炎及促进药物吸收等方面也具有药理活性[4],所以菊花中所含的挥发油与其生理活性密切相关。
目前,国内外对挥发油的提取多采用溶剂浸提[5]、水蒸汽蒸馏[6-7]、超临界CO2流体萃取[8-9]、超声波辅助萃取[10]、顶空-固相微萃取[11]等方法,再利用气相色谱质谱串联技术(gas chromatography-mass spectrometry,GC-MS)检测其成分。顶空-固相微萃取技术(head space-solid phase micro-extraction,HS-SPME)是近些年发展起来的前处理方法,它集采样、萃取、浓缩、进样于一体,操作简便、使用样品量少、易实现自动化,大大加快了分析检测的速度[12]。对挥发性未知物定性分析时,通常根据谱图检索的匹配度高低来确认化合物,但是在高匹配化合物较多时,容易出现定性错误。而保留指数也是色谱的一个定性参数,在对同分异构体、同系物和结构特征相似的化合物进行定性分析时起到更加重要的作用[13-14]。
本实验以杭白菊为研究对象,采用顶空固相微萃取-气相色谱-三重四极杆串联质谱技术,检测杭白菊的挥发性成分,对萃取条件进行优化,对检测出的挥发性成分进行定性分析。利用自动质谱退卷积定性系统(AMDIS)识别拆分共流色谱峰,得到更纯净的质谱图,再结合Kováts保留指数(retention index,IR)使质谱检索结果更为准确。
1 材料与方法
1.1 材料与试剂
杭白菊药材:干花(含水量18.1%),采自浙江桐乡;氯化钠:分析纯,广州化学试剂厂;正构烷烃混合标准品(C7~C40),美国O2si公司。
1.2 仪器与设备
TSQ 8000气相色谱-三重四级杆串联质联仪(GC-MS/MS,配电子电离源及Xcalibur数据处理系统)、TRIPLUS RSH自动进样器、20 mL顶空样品瓶、固相微萃取自动进样手柄,美国Thermo公司;固相微萃取头(65 μm PDMS/DVB、85 μm CAR/PDMS、85μm PA、50/30 μm DVB/CAR/PDMS),美国Supelco公司。
1.3 实验方法
1.3.1 顶空固相微萃取条件
称取杭白菊碎片0.3 g,置于20 mL顶空瓶中,加入1.0 g NaCl和8 mL蒸馏水,萃取温度70 ℃,萃取时间50 min,平衡时间10 min,解吸时间5 min,萃取头为50/30 μm DVB/CAR/PDMS。
1.3.2 GC-MS/MS分析条件
色谱条件:TR-5MS弹性石英毛细柱(30 m×0.25 mm,0.25 μm);升温程序:初始温度40 ℃,保持1 min,然后以13 ℃/min的速率升温至100 ℃,以3 ℃/min的速率升温至110 ℃,保持1 min,再以5 ℃/min的速率升温至150 ℃并保持1 min,以2 ℃/min的速率升温至180 ℃,保持1 min,最后以15 ℃/min的速率升温至250 ℃并保持2 min;分流比10:1;进样口温度为250 ℃;载气:99.999% 高纯度氦气;流速1.2 mL/min。
质谱条件:EI离子源;离子源温度:280 ℃;传输线温度:280 ℃;电子轰击能量:70 eV;扫描方式:全扫描;质量扫描范围m/z33~350。
1.3.3 保留指数的测定
采用相同的气相色谱条件测定正构烷烃(C7~C40)的保留时间,自动质谱退卷积定性系统(AMDIS)根据正构烷烃的保留时间,自动计算出杭白菊中各挥发性化合物的保留指数。保留指数的计算如公式(1):

(1)
式中:IR为待测化合物的保留指数;n为正构烷烃的碳原子数;Tx为待测化合物的保留时间,min;Tn和Tn+1分别为碳原子数为n、n+1的正构烷烃的保留时间,min,且Tn+1>Tx>Tn。
1.3.4 数据处理
数据处理由Xcalibur系统软件完成,应用自动质谱退卷积定性系统(AMDIS)对总离子流图(TIC)自动进行反卷积处理,所分辨的质谱在NIST2.2标准谱库中检索,根据匹配度、保留指数和文献已报道物质进行核对,只记录正匹配和反匹配均大于800的物质,并用峰面积归一化法计算杭白菊挥发油成分的相对含量。
2 结果与分析
2.1 固相微萃取条件的优化
据相关文献[6,15]报道,杭白菊挥发油的主要成分是萜烯类及其含氧衍生物。因此,本研究用峰面积代表萃取物质的量,出峰数代表萃取物质的种类,选择杭白菊挥发性成分的总峰面积、主峰面积(萜烯类及其含氧衍生物)、总峰数和主峰数4个参数来评价萃取效果,确定HS-SPME萃取杭白菊挥发性物质的最佳条件。
2.1.1 萃取头的选择
称取杭白菊碎片0.3 g,置于20 mL的顶空样品瓶中,加入8 mL蒸馏水,萃取温度为40 ℃,萃取时间为20 min,平衡时间为10 min,分别考察已老化好的不同萃取头(85 μm CAR/PDMS、65 μm PDMS/DVB、50/30 μm DVB/CAR/PDMS、85 μm PA)对杭白菊挥发性物质的萃取效果,每个样品重复做3次。结果见图1。

图1 萃取头对杭白菊挥发性成分萃取效果的影响
Fig.1 Effect of SPME fiber on the extraction of volatile compounds from Chrysanthemum moriflium Ramat
由图1可以看出,4种萃取头的萃取效果有明显差异。当用50/30 μm DVB/CAR/PDMS萃取头时,总峰面积、总峰数、主峰面积和主峰数均为最大;当用85 μm PA萃取头时,峰面积和出峰数均为最小。综合比较,4种萃取头对杭白菊挥发性物质的萃取效果依次为DVB/CAR/PDMS >PDMS/DVB>CAR/PDMS>PA。这是因为不同型号的萃取头具有不同极性的固相涂层,根据相似相溶原理其对化合物的吸附能力也不同[16]。PDMS/DVB萃取头适用于醇类、醛类、酮类等双极性化合物; CAR/PDMS萃取头对于小分子化合物具有较好的吸附能力;DVB/CAR/PDMS萃取头具有3种涂层,对非极性和混合极性化合物具有较好的吸附性[17];PA是极性萃取头,适用于极性半挥发性化合物。本研究中杭白菊挥发油成分较复杂,混合涂层更加有利于分析,所以本研究选用50/30 μm DVB/CAR/PDMS。
2.1.2 萃取温度的选择
将杭白菊样品分别在40、50、60、70、80 ℃下,用50/30 μm DVB/CAR/PDMS萃取头萃取20 min,检测挥发性成分,每个样品重复3次。结果显示,随着萃取温度的升高,总峰面积和主峰面积都不断增加;当温度超过70 ℃时,虽然总峰面积略有增加,但是主峰面积却有所减少(见图2)。从图2中还可以看到,总峰数和主峰数随着萃取温度升高呈先上升后降低趋势,在70 ℃时达到最大值,说明在高温下可能有部分不稳定化合物发生分解。据EZQUERRO等[18]报道,萃取温度对萃取效果影响较大,当温度升高时,加快了挥发性物质的分子运动速率,使其在气相中的含量增大,有利于萃取头对目标物的吸附。但萃取是一个放热过程,高温会降低挥发性物质在萃取头和样品之间的分配系数,使萃取效果降低[19]。而且高温下,样品中的不稳定物质易分解,影响研究结果。综合考虑各方面因素,本研究将萃取温度设定为70 ℃。

图2 萃取温度对杭白菊挥发性成分萃取效果的影响
Fig.2 Effect of extraction temperature on the extraction of volatile compounds from Chrysanthemum moriflium Ramat
2.1.3 萃取时间的选择
样品萃取温度为70 ℃时,用DVB/CAR/PDMS萃取头分别萃取20、30、40、50 min,检测挥发性成分,每个样品重复做3次。结果显示,当萃取时间在20~40 min之间时,随着萃取时间的增加,总峰面积和主峰面积都逐渐增大,总峰数和主峰数变化不明显。当萃取时间超过40 min时,虽然总峰面积和主峰面积变化不大,但是总峰数变化明显。当萃取时间为50 min时,总峰数和主峰数都达到最大值,而萃取时间为60 min时,总峰数和主峰数却显著降低,说明有挥发性成分从萃取头上解吸出来(见图3)。不同萃取时间对低分子量挥发性物质和高分子量挥发性物质的峰面积影响不大。萃取头吸附挥发性化合物是一个动态平衡过程,当分析物在萃取头、顶空和溶液3相中达到平衡时的萃取效果最好,所需时间即为萃取时间[20]。当萃取时间不足时,挥发性化合物不能充分被萃取头吸附;而萃取时间过长时,某些化合物可能会从萃取头上解吸下来[21]。而且,萃取时间过长可能会导致性质不稳定,化合物发生氧化分解等副反应[22]。综合考虑,本方法将萃取时间设定为50 min。
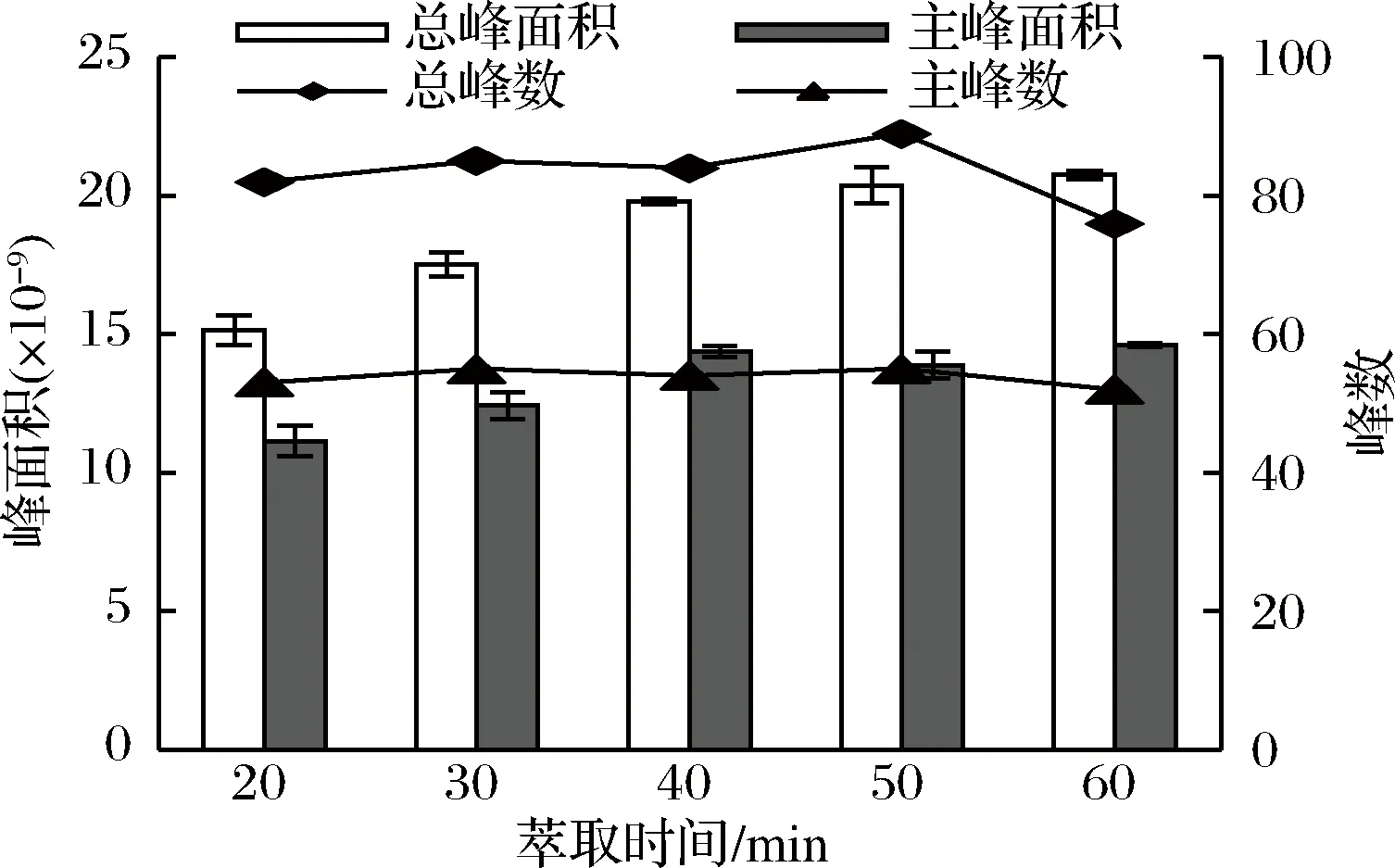
图3 萃取时间对杭白菊挥发性成分萃取效果的影响
Fig.3 Effect of extraction time on the extraction of volatile compounds from Chrysanthemum moriflium Ramat
2.1.4 氯化钠(NaCl)的加入量
据LEE[23]、艾对[21]等报道,在样品中加入氯化钠可利用盐析效应降低挥发性成分在水中的溶解度,使挥发性成分充分逸出,尤其利于小分子化合物挥发,增加其在顶空瓶上空的浓度,提高萃取灵敏度。但当NaCl添加过量时,基质黏度增加,影响挥发性成分从水中的逸出,降低萃取效率[24]。实验将杭白菊样品分别添加0.0、0.5、1.0、1.5、2.0、2.5、3.0 g NaCl,在70 ℃下用DVB/CAR/PDMS萃取头萃取50 min,检测挥发性成分,结果显示,随着NaCl添加量的增加,总峰面积、总峰数、主峰面积和主峰数都呈先上升后下降的趋势,且当添加量为1.0 g时,4个指标都达到最大值。当加盐量超过2.5 g时,总峰面积、主峰面积和主峰数基本保持不变(见图4)。说明添加少量NaCl有利于挥发性成分析出,提高萃取效果。因此,本研究选择加入1.0 g NaCl。

图4 NaCl添加量对杭白菊挥发性成分萃取效果的影响
Fig.4 Effect of NaCl addition on the extraction of volatile compounds from Chrysanthemum moriflium Ramat
2.1.5 解吸时间的选择
萃取头吸附完成后,要在气相进样口进行解吸,解吸时间决定着挥发性化合物是否能够完全进入气相色谱柱。当解吸时间不足时,挥发性化合物在萃取头上有残留,不但影响最终检测结果,还会影响后续进样,而当解吸时间过长时,使萃取头在高温下遭到损害,影响其寿命,还会使部分物质发生热解反应,降低检测效率[25-26]。实验将杭白菊样品中添加1.0 g NaCl,在70 ℃下,用DVB/CAR/PDMS萃取头萃取50 min,然后分别在进样口解吸3、4、5、6 min,检测挥发性成分,结果显示,当解吸时间从3 min增加到4 min时,总峰面积和主峰面积变化不大,总峰数和主峰数都有所增加;而当解吸时间为5 min时,总峰面积急剧增大,总峰数、主峰面积和主峰数均达到最大值,而解吸时间为6 min时,总峰面积又显著降低,且其余3个参数均为最小值(见图5)。说明在5 min时,已经解吸完全。因此,本研究将解吸时间设定为5 min。
2.2 实际样品分析
称取0.3 g杭白菊碎片于顶空样品瓶中,加入8 mL蒸馏水,添加1.0 g NaCl,用DVB/CAR/PDMS萃取头在70 ℃下萃取50 min,解吸5 min来检测杭白菊中的挥发性成分。通过气相色谱-三重四级杆串联质谱仪对分离得到的色谱峰进行定性分析,共鉴定出88个组分,并用峰面积归一化法得到各组分的相对含量(表1),其总离子流图见图6。
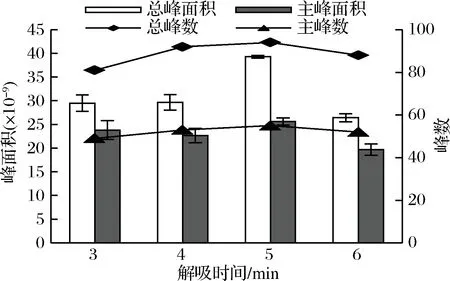
图5 解吸时间对杭白菊挥发性成分萃取效果的影响
Fig.5 Effect of desorption time on the extraction of volatile compounds from Chrysanthemum moriflium Ramat

表1 杭白菊的挥发性化学成分
续表1
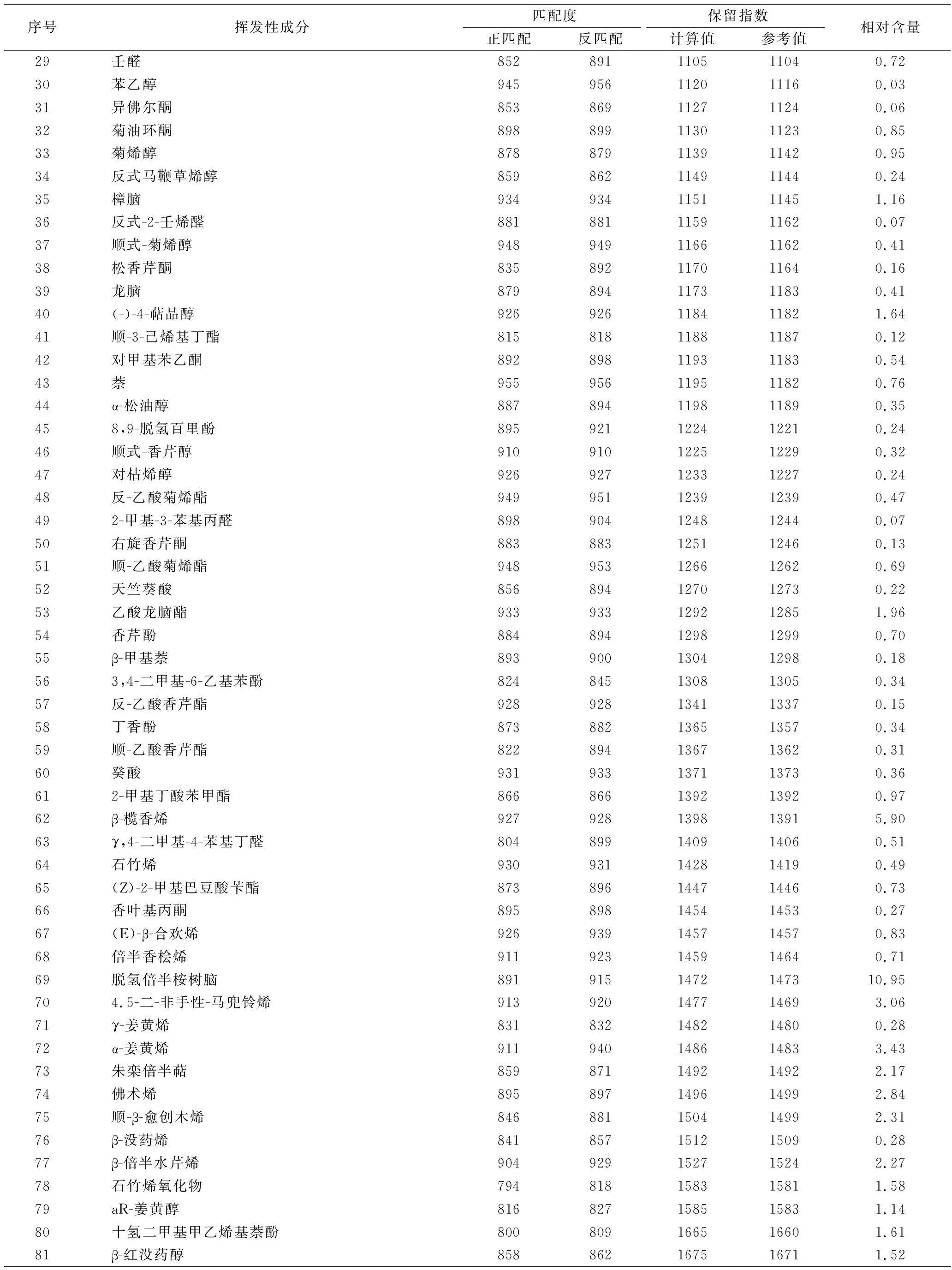
序号挥发性成分匹配度保留指数正匹配反匹配计算值参考值相对含量29壬醛852891110511040.7230苯乙醇945956112011160.0331异佛尔酮85386911271124 0.0632菊油环酮898899113011230.8533菊烯醇878879113911420.9534反式马鞭草烯醇859862114911440.2435樟脑934934115111451.1636反式-2-壬烯醛881881115911620.0737顺式-菊烯醇948949116611620.4138松香芹酮835892117011640.1639龙脑879894117311830.4140(-)-4-萜品醇926926118411821.6441顺-3-己烯基丁酯815818118811870.1242对甲基苯乙酮892898119311830.5443萘955956119511820.7644α-松油醇887894119811890.35458,9-脱氢百里酚895921122412210.2446顺式-香芹醇910910122512290.3247对枯烯醇926927123312270.2448反-乙酸菊烯酯949951123912390.47492-甲基-3-苯基丙醛898904124812440.0750右旋香芹酮883883125112460.1351顺-乙酸菊烯酯948953126612620.6952天竺葵酸856894127012730.2253乙酸龙脑酯933933129212851.9654香芹酚884894129812990.7055β-甲基萘893900130412980.18563,4-二甲基-6-乙基苯酚824845130813050.3457反-乙酸香芹酯928928134113370.1558丁香酚873882136513570.3459顺-乙酸香芹酯822894136713620.3160癸酸931933137113730.36612-甲基丁酸苯甲酯866866139213920.9762β-榄香烯927928139813915.9063γ,4-二甲基-4-苯基丁醛804899140914060.5164石竹烯930931142814190.4965(Z)-2-甲基巴豆酸苄酯873896144714460.7366香叶基丙酮895898145414530.2767(E)-β-合欢烯926939145714570.8368倍半香桧烯911923145914640.7169脱氢倍半桉树脑8919151472147310.95704.5-二-非手性-马兜铃烯913920147714693.0671γ-姜黄烯831832148214800.2872α-姜黄烯911940148614833.4373朱栾倍半萜859871149214922.1774佛术烯895897149614992.8475顺-β-愈创木烯846881150414992.3176β-没药烯841857151215090.2877β-倍半水芹烯904929152715242.2778石竹烯氧化物794818158315811.5879aR-姜黄醇816827158515831.1480十氢二甲基甲乙烯基萘酚800809166516601.6181β-红没药醇858862167516711.52
续表1

序号挥发性成分匹配度保留指数正匹配反匹配计算值参考值相对含量82(2)-氧化香橙烯8318321679167810.7283α-红没药醇899942169016845.1784(Z)-Tibetin spiroether859883193319261.0185二十碳烷901901199820000.2086二十一碳烷938943209721004.0387二十二碳烷901903219722000.4788二十三碳烷855855229523003.39

图6 杭白菊挥发性成分总离子流图
Fig.6 Total ion chromatogram of volatile components fromChrysanthemum moriflium Ramat
杭白菊挥发性成分复杂,各组分的相对含量差异较大,主要有烯烃类26个(26.48%)、醇类15个(23.55%)、酮类11个(5.86%)、醛类10个(2.05%)、酯类7个(5.23%)、酚类6个(3.29%)、酸类2个(0.58%)、烷烃类4个(8.09%)、芳香烃类3个(1.24%)。其中含量较高的有脱氢倍半桉树脑(10.95%)、(2)-氧化香橙烯(10.72%)、β-榄香烯(5.90%)、α-红没药醇(5.17%)、α-姜黄烯(3.43%)等。大量研究表明,β-榄香烯具有良好的抗癌活性,对多种癌细胞的增殖具有抑制作用,并且引诱细胞凋亡[27]。除此之外,β-榄香烯还具有抑制新生血管的作用,可应用于眼部疾病的治疗[28]。α-红没药醇具有止痛、消炎、抑菌、抗癌、抗突变、抑制遗传损伤和去黑色素等作用[29-30]。α-姜黄烯有助于内分泌调节,而且具有抗病毒、抗肿瘤、抑癌、抑菌等生理活性[31]。另外,还测得乙酸龙脑酯(1.96%)、樟脑(1.16%)、龙脑(0.41%),据报道,乙酸龙脑酯具有镇痛抗炎作用[32];樟脑、龙脑是挥发油抗菌作用的主要成分[33]。
3 结论
本研究以浙江桐乡的杭白菊为研究对象,建立了HS-SPME-GC-MS/MS结合保留指数测定其中88种挥发性成分的分析方法,结果具有良好的重现性。该方法利用AMDIS的自动解卷积功能得到更加纯净的质谱图进行谱库检索,再参考保留指数对组分精准定性,提高了定性分析的准确度和效率,使结果更加可靠,同时也对其他样品的分析具有借鉴作用。
