煎炸肉制品中杂环胺的控制技术及体内代谢调控研究进展
2019-01-26温荣欣秦泽宇孔保华
温荣欣,陈 倩,秦泽宇,刘 骞,孔保华
(东北农业大学食品学院,黑龙江哈尔滨150030)
杂环胺类化合物(Heterocyclic aromatic amines,HAAs)是富含蛋白质的食物在烹饪加工过程中形成的,主要出现在经过高温加热的肉制品中。不同烹饪方式对HAAs的生成量具有不同的影响,煎炸相对于其他热加工方式温度偏高,并且伴随着油的使用,热油与肉制品之间会发生成分迁移,形成一个复杂的反应体系,因此HAAs在煎炸肉制品中生成量较多[1]。HAAs已被证实具有致癌、致突变作用,经常食用含HAAs多的食物会对身体产生不良影响[2]。为减少HAAs对人体的危害,不仅需要研究其影响因素,还要探讨其控制方法。对于HAAs的控制方法可从两方面进行:一是控制HAAs的生成过程,以减少生成量;二是对已摄入的HAAs,通过调控其在人体中的代谢过程,减少对人体的危害。本文从煎炸肉制品出发,深入探讨影响其中HAAs生成的因素,并对控制HAAs生成的方法进行了综述,最后根据其消化吸收及代谢规律对其进行体内调控。通过对HAAs的产生到体内代谢进行全面的分析,为降低HAAs带来的相关健康风险提供理论基础和方法。
1 HAAs的概述
1.1 HAAs的结构及分类
HAAs的生成过程具有温度依赖性,不同温度条件下生成的HAAs种类及数量都有所不同。在100~300℃的加热条件下形成的HAAs属于氨基咪唑氮杂芳烃类(Aminoimidazoazaren,AIA),通常被称为热反应HAAs,这类HAAs是由糖类、氨基酸、肌酸进行美拉德反应生成的。在高于300℃的温度下形成的HAAs属于氨基咔啉类(Amino-carbolin congener),被称为热解HAAs,是通过蛋白质或者色氨酸、苯丙氨酸、赖氨酸等氨基酸热解生成的[3]。煎炸肉制品中常见 HAAs 的类型见表 1[4-5]。
1.2 HAAs的生物毒性
HAAs具有致癌和致突变性,它的摄入量与DNA损伤水平呈正相关[2]。目前我国制定的关于食品中杂环胺类物质的标准较少,现有GB 5009.243-2016《食品安全国家标准高温烹调食品中杂环胺类物质的测定》及SN/T4140-2015《出口鱼肉香肠和香精中多种杂环胺的测定 液相色谱-质谱/质谱法》,其中没有提出杂环胺在食品中的限量要求,国际上也未制定关于杂环胺在食品中的最大残留限量的标准。但有研究报道,HAAs可以诱发动物如啮齿动物和非人灵长类动物的多器官(包括肝、肺、胃、结肠、前列腺和乳腺)肿瘤。另外,PhIP是HAAs中最常见的一种,不仅可致小鼠患淋巴瘤,还可使大鼠患乳腺癌。流行病学研究表明,高HAAs摄入量可能增加人类患癌症(如结肠癌和直肠癌)的风险[6],HAAs的代谢具有个体依赖性,癌症风险主要与遗传易感性相关。鉴于其生物毒性,降低其在食品中的含量成为亟待解决的问题。HAAs不会单独积累在身体组织中,因此不可直接检测体液或组织中 HAAs含量。但HAAs在人体中经过代谢之后形成的最终代谢产物能够与DNA形成加合物,可以通过检测加合物来研究HAAs对人体健康的影响,但是加合物的检测技术还有待进一步开发[7]。
2 影响煎炸肉制品中HAAs生成的因素
2.1 原料肉中的成分
热反应HAAs的前体物质为糖类、蛋白质和肌酸,而热解HAAs的前体物质为蛋白质或者氨基酸。由于煎炸过程中温度一般在300℃以下,生成的HAAs主要是热反应HAAs。可用于煎炸的原料肉种类众多,不同原料肉所含的碳水化合物、蛋白质、氨基酸和肌酸等物质的比例及数量都有所差异,而且脂肪含量及水分含量也各不相同。即使用相同的加工方式进行处理,不同原料肉生成HAAs的数量和种类也不尽相同。有研究表明,糖类的浓度对HAAs生成的影响具有双重性。就糖类与肌酸的比例而言,糖类浓度较低时,HAAs的生成量较多,过量的糖类则会影响美拉德反应,与HAAs的生成途径进行竞争,从而抑制 HAAs 的生成[8-9]。
蛋白质不仅参与热反应HAAs的生成,而且是热解HAAs的重要前体物质。但有研究显示,向肉制品中添加某些蛋白质或氨基酸对HAAs的生成具有抑制作用。Wang等[10]发现,大豆浓缩蛋白可以减少牛肉饼中HAAs的生成量,主要是因为增强了牛肉的持水能力。Weisburger等[11]发现,色氨酸和脯氨酸等氨基酸可以捕捉HAAs生成过程中的中间物质活性醛,并且对其与肌酸酐的结合过程形成竞争作用,从而抑制 HAAs的生成,Kikugawa等[12]运用模拟体系,证实了半胱氨酸和乙酰半胱氨酸可以抑制HAAs的生成,可能是因为它们对美拉德反应的中间产物吡嗪阳离子自由基具有清除作用。
脂肪是一种高效的传热剂,可以快速地将热量运送到肉中,使肉类在较短的时间内达到熟制状态。Knize等[13]发现,含30%脂肪的牛肉比含15%脂肪的牛肉形成的AαC少,主要是因为脂肪传热效率高,导致加热时间缩短。然而脂肪在煎炸过程中会产生一系列化学反应,形成过氧化物、醛、酮、有机酸等物质,其中有一些已经被证明对人体有害,而且脂肪在过氧化反应期间会形成自由基,促进美拉德反应进行,从而有助于HAAs的生成[1]。对于每种原料肉,都有最优的脂肪含量,可以使HAAs的生成量较低,这方面还需进一步研究。
煎炸过程中肌肉的持水能力亦会影响HAAs的生成,Borgen等[14]在模拟体系中发现较为干燥的条件有利于一些HAAs的形成,可能是因为在烹饪过程中水分会从肉的内部向表面迁移,而HAAs的前体物质都是水溶性的,在这个过程中会随着肌肉纤维的收缩和水分的迁移集中到肉类表面。而肉在烹饪过程中表面温度较高,导致HAAs主要在肉类表面生成,所以水分的迁移会增加HAA的生成量,因此,需要提高肌肉的持水能力。Kanithaporn等[15]发现,向猪肉中注射0.5%氯化钠和0.35%三聚磷酸盐的混合溶液可以明显降低HAAs生成量,其中PhIP降低42.7%、MeIQx降低79.0%、DiMeIQx降低75.0%。主要是因为氯化钠和三聚磷酸盐可以提高肌肉持水能
力,抑制肌肉中的水和水溶性前体物质(肌酸/肌酸酐、葡萄糖和氨基酸)向肉表面迁移。氯化钠中的氯离子可以渗入到肌丝中,通过增加静电排斥力使其膨胀,降低肌肉细丝蛋白之间的内聚力,增加肌原纤维体积,保留更多的水。磷酸盐可以调节肌原纤维蛋白的p H,使其更加远离等电点,从而暴露出更多的带电位点与水结合。它还可以螯合肉中的金属离子,使肌肉蛋白中的羟基游离,由于羟基之间静电力的作用,使蛋白质结构松弛,从而使更多的水截留在肌肉蛋白网络中[16]。
2.2 煎炸工艺及方式
2.2.1 煎炸用油 在煎炸过程中,HAAs的生成量通常受到油中脂肪的类型、氧化状态和油中抗氧化剂含量以及油的循环利用情况的影响。油在炸制过程中会发生脂质过氧化反应,所产生的自由基会加速美拉德反应的进程,从而导致HAAs的增多。因此应该控制煎炸期间油的氧化反应,选择相对不饱和脂肪酸含量少的油,或者向油中添加抗氧化剂。随着油循环使用次数的增加,煎炸过程中产生的肉渣残留量越来越多,使油的成分变复杂,有害物质增多,部分HAAs也会残留在油中。Skog等[17]发现肉制品经煎炸之后,锅内残渣中的HAAs含量与肉制品相当,甚至还要多。为防止再次煎炸时这些有害物质会迁移到肉制品中,应在循环使用前将油中的残渣去除,及时向其中添加新油,并减少油脂的循环使用次数[1,18]。
2.2.2 煎炸温度和时间 HAAs的生成与煎炸时间和温度有较强的相关性。Knize等[19]将牛肉在230℃条件下煎炸6、10 min,发现其中PhIP的生成量分别为7.8和32 ng/g,MeIQx为5.6和7.3 ng/g。将肉丸在275℃条件下煎炸5、10和15 min,分别生成2.7、4.2和12.3 ng/g的 MeIQx,说明 HAAs的生成量与时间成正比。HAAs的生成量随煎炸温度的升高和煎炸时间的延长呈明显增加趋势,不过煎炸时间对HAAs生成量的影响要小于煎炸温度[20]。
2.2.3 煎炸设备 煎炸设备中的金属离子类型对HAAs生成也具有明显的影响。于迪等[21]发现,Fe2+和Fe3+可以使IQx、MelQx和DiMelQx的生成量明显增加,可能是这两类金属离子会促进自由基的生成。但是Fe2+和Fe3+会导致PhIP的生成量降低,主要原因在于它们会与肌酐结构中的氨基反应,从而阻碍了肌酐与苯乙醛之间的反应。Ca2+和Mg2+均会导致PhIP的生成量增加,可能是因为Ca2+和Mg2+可以促进苯乙醛与肌酐反应生成丁间醇醛,并且催化丁间醇醛脱水产物与NH3和甲醇反应生成PhIP。因此在选择煎炸设备时应注意其材质。煎炸过程产生的油烟中也会有 HAAs 的存在,Thiébaud 等[18]发现煎炸培根的烟雾中含有3 ng/g的HAAs,煎炸牛肉的烟雾中含有0.37 ng/g。在煎炸过程中应使用抽油烟机,减少人体对油烟的吸入量,从而减少油烟中HAAs对人体的伤害。
3 煎炸肉制品中HAAs的控制技术
通过对原料肉进行预处理,可以有效地改变前体物质的种类与含量,进而达到控制成品中HAAs含量的目的。有效的预处理方法主要有在肉品表面裹上涂层,在煎炸前进行微波处理,以及用合适的腌料进行腌制等。
3.1 表面涂层
对于煎炸肉制品,在其表面进行涂层包裹可以减少HAAs生成。涂层可以减少肉品和油脂之间的直接接触,降低油脂对肉品的传热效能,使得肉品表面温度不会过高,还可以使肉品与油脂中的化合物不能随意迁移,从而减少许多不利的化学反应。表面涂层减少了肉制品中的水分迁出,使得HAAs前体物质在肉的表面聚集减少。在煎炸肉制品中最常用的表面涂层是面糊,面糊可以减少肉制品的吸油量,降低水分损失,还可以提升煎炸肉制品的脆性[22]。另外,新兴的水胶体涂层主要是由蛋白质或多糖以及脂质组成的单一膜或复合膜,具有可逆热凝胶性能,可以更有效地减少物质的迁移,并且对煎炸食品的感官特性没有负面影响[23]。鉴于水胶体涂层降低煎炸肉制品水分损失及减少物质迁移的能力,其对于减少煎炸肉制品中HAAs的生成量具有巨大潜力。
3.2 微波预处理
微波预处理可以使HAAs的生成量减少。Felton等[24]发现对牛肉饼进行2 min的微波预处理之后,再进行250℃的煎炸可以使PhIP的生成量降低86%。原料肉经过微波预处理后会产生一部分肉汁,其中含有HAAs的重要前体物质(如肌酸、氨基酸和葡萄糖),移除这部分肉汁之后可使HAAs前体物质减少,而且原料肉经微波预处理后可以缩短煎炸时间,使HAAs的生成量明显降低[25]。
3.3 腌制
腌制是抑制HAAs生成的重要手段,在腌制过程中原料肉中的肌酸扩散到腌制剂中,降低了其在肉品表面的浓度,而且腌制可以提高肉的保水性。此外,在腌制过程中使用的外源物质,特别是抗氧化剂,可清除HAAs生成过程中需要的自由基,或者与美拉德中间产物发生反应形成稳定加合物从而抑制HAAs的生成。
酚类是一种非常重要的抗氧化剂,可以分为类黄酮、儿茶素、酚萜类化合物。类黄酮是蔬菜和水果中普遍存在的多酚类化合物,例如红辣椒、葡萄籽、苹果皮中均富含类黄酮,作用是清除自由基[26];儿茶素主要存在于绿茶中,有研究表明,苯乙醛是生成PhIP的重要中间产物,儿茶素可以阻断苯乙醛与肌酸酐反应从而抑制PhIP生成[27];酚萜类化合物在黑胡椒和迷迭香中都有存在,向肉制品中加入黑胡椒和迷迭香都可以抑制HAAs的生成,主要是因为酚萜类化合物中的邻二苯酚基团可以清除阳离子自由基[28]。除了酚类化合物,还有许多天然化合物对HAAs具有抑制作用,例如维生素和一些香辛料等。Kikugawa等[29]在模拟体系中发现VC具有清除吡嗪阳离子自由基的能力。Balogh等[30]发现,VE能够抑制自由基生成或者与美拉德中间产物发生反应,从而显著减少牛肉饼中HAAs的生成。Wong等[31]研究了11种水溶性维生素在模拟体系中对HAAs的抑制作用,发现 VB1、VB3、VB6、VB7、VC均可抑制 HAAs 生成。硫代亚磺酸盐是生成热反应HAAs的关键中间物质,大蒜中的含硫化合物和大蒜素可以抑制硫代亚磺酸盐的生成,因此大蒜对HAAs具有显著抑制效果[32]。表2总结了一些外源物质对HAAs生成的抑制效果[33-39]。
4 HAAs在人体中的代谢调控
HAAs具有生物毒性,虽然通常生成量为ng/g级别,但长期摄入也可能对人体健康产生危害。虽然采取合理的烹调方式、对肉制品进行预处理以及合理添加一些外源物质可以有效减少其生成量,但在加工过程中仍不可避免HAAs的生成,因此,需要研究其体内消化吸收及代谢机制,减少人体对HAAs的吸收量,并且对其代谢过程加以控制。
4.1 控制HAAs的消化吸收
富含纤维类的制品可以有效降低HAAs的吸收率,Persson等[40]研究发现,马铃薯纤维、麦麸分别可以结合47%、38%的 PhIP。Funk等[41]发现,被纤维吸附的HAAs不会被小肠吸收,而会随纤维排出体外。因此木质纤维可以吸附大多数疏水性HAAs,如PhIP或AαC,降低人体的吸收率。尽管胃肠道动态模型的建立已经趋于成熟,但是由于其不能模拟在消化吸收过程中其他条件的干预,例如微生物菌群、免疫系统以及激素的释放,仍然需要进行体内动物实验进行验证,在该方向还需进一步的研究[5]。
4.2 调节HAAs的代谢过程
被人体摄入的HAAs经吸附作用后,可能还会有少量的残留,这部分被消化吸收后的HAAs,通过血液运输到肝脏,主要在肝脏进行代谢并产生毒性[5]。HAAs的代谢需要酶促活化,主要分为两步进行。首先,通过细胞色素P450依赖性单加氧酶(CYP)催化反应,使外环氨基的 N发生氧化,然后,生成的N-OH-HAA发生乙酰化或磺化反应产生酯,酯的高度不稳定性使其自发裂解形成具有活性的硝酸根离子,最终形成致癌物质。最终活性代谢物不仅可以与脂质和蛋白质结合,导致氧化应激、细胞损伤和生物功能性丧失[42],还可以与DNA发生共价结合生成HAA-DNA加合物,通常最终活性代谢物会优先结合到鸟嘌呤的C-8位上,所形成的加合物比与其他位点结合形成的加合物更具促突变性。HAAs的毒性很大程度上取决于代谢活化与解毒途径之间的平衡,如果加合物持久性增加,患癌症的风险也会增加[43]。Carvalho 等[2]研究表明,果蔬中的一些植物化学成分可以通过抑制DNA氧化来减少DNA损伤,从而控制HAAs的致癌性和致突变性,此外水果摄入量与DNA损伤水平呈负相关,低水果摄入量和高HAAs摄入量对DNA损伤水平具有累加效应。控制HAAs在人体中的代谢主要有四种途径:使其失活、抑制其活化、解毒和对加合物进行切除修复。
4.2.1 直接结合HAAs使其失活 可以通过采用某种物质直接与HAAs结合使其失去生物活性,Reis等[44]发现,一些益生菌可以减少HAAs与DNA的加合,原因可能是HAAs可以与这些益生菌细胞壁中的肽聚糖之间进行阳离子交换,从而结合在细胞壁上,使得生物代谢不能继续进行,与益生菌结合的HAAs会通过粪便排出体外。此外,Dashwood[45]发现,叶绿素可以与热反应 HAAs发生共价结合,从而限制HAA代谢。甘蓝产生的硫代葡萄糖苷可以被内源性黑芥子酶和修饰蛋白降解为异硫氰酸酯(ITC),ITC与HAAs的氨基结合产生硫脲,从而防止HAAs形成具有遗传毒性的 N-OH-HAA,减少癌症发生的几率[46]。
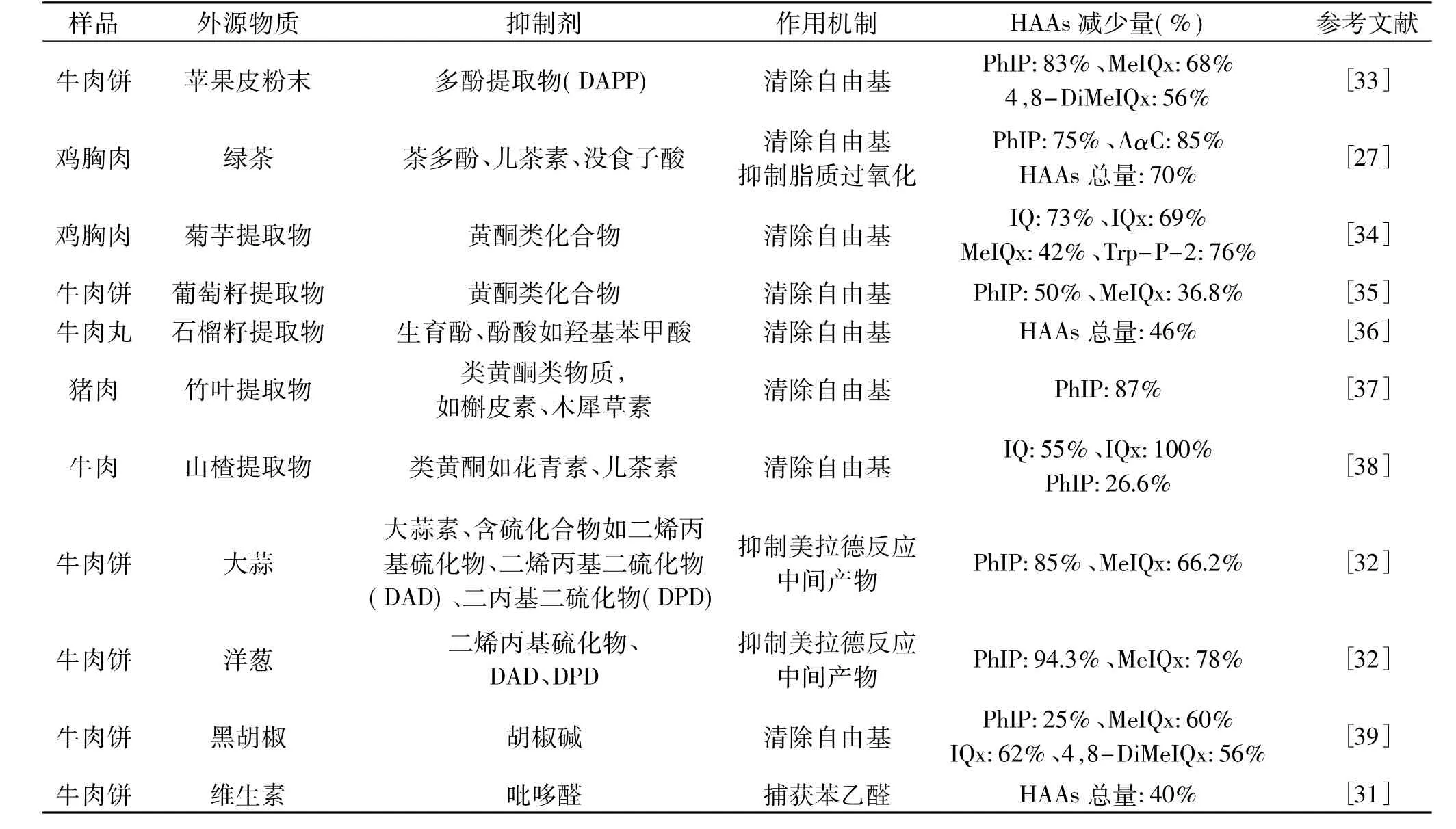
表2 不同外源物质对煎炸肉制品中HAAs生成的抑制效果Table 2 Inhibition of different exogenous substances on HAAs in fried meat products
4.2.2 抑制HAAs的活化过程 抑制HAAs的活化过程,主要是对负责活化的酶进行作用从而控制其代谢。例如0.5%的共轭亚油酸可以抑制41%的IQ-DNA加合物形成[47]。Platt等[48]研究了 3 种茶、2种葡萄酒、15种水果和11种蔬菜的汁液对IQ和PhIP的基因毒性的影响,发现甜樱桃对IQ的遗传毒性表现出最高的抑制效果,红葡萄酒、菠菜和李子对PhIP基因毒性的抑制较强。并且这些物质大多对这两种HAAs酶促活化的第二步有抑制作用,而只有酸樱桃、蓝莓和黑醋栗果汁抑制了第一步。一些肠道微生物如梭状芽孢杆菌、拟杆菌属、真杆菌属和大肠杆菌产生的β-葡萄糖醛酸酶,硝酸还原酶能够将HAAs转化为活性致癌物,可导致细胞生长异常、激活结肠细胞抗凋亡通路,从而促进结肠癌的发生。体外实验和临床研究已经证明,一些益生菌菌株可以降低这些酶的活性[44]。
4.2.3 利用酶对HAAs进行解毒 通过激活解毒酶抑制HAAs的代谢也是有效降低其毒性的方式,UDP-葡萄糖醛酸转移酶(UGT)和谷胱甘肽S-转移酶(GST)能够催化降解HAAs的遗传毒性,并诱捕其反应性代谢物。咖啡中的咖啡因等化合物可以通过激活某些HAAs解毒酶如UGT和GST,来减少HAADNA加合物,特别是 PhIP-DNA 加合物的形成[49]。Viegas等[50]发现啤酒可以抑制 MeIQx和 PhIP的致突变性,并且抑制效果与啤酒中啤酒花的含量有关,主要是因为啤酒花中存在黄腐酚(XN),它是一种由啤酒花衍生的异戊二烯类黄酮,以剂量依赖性方式诱导突变,通过对人肝癌HepG2细胞分析发现,XN可能会使UDP-葡萄糖醛酸转移酶增多,从而抑制HAAs的代谢。
4.2.4 对加合物进行切除修复 HAAs的最终代谢产物与DNA形成加合物后,可以通过对基因进行修复,切除基因中形成加合物的部分以有效控制其毒性。核苷酸切除修复(Nucleotide excision repair,NER)是对DNA加合物修复最有效的途径,因为NER通路可以去除导致DNA螺旋畸变的部分。主要修复过程如下:首先识别损伤部位,然后DNA通过解旋酶在加合物周边展开,形成单链区域,然后在这些单链区域切割损伤的DNA链,然后用DNA聚合酶填充剩余的缺口[51]。
5 总结与展望
随着人们对饮食健康越来越重视,提高煎炸肉制品的安全性是亟待解决的重要问题。本文综合分析了控制煎炸肉制品中HAAs产生的方法,讨论了其在人体中的消化吸收代谢过程,为全方面的降低其对人体的危害提出了一定的方法和措施。原料肉、煎炸工艺和煎炸过程中复杂的物理化学反应等均会影响HAAs生成的种类和含量,针对HAAs形成的影响因素,通过一些控制方法,包括对肉制品进行表面涂层、微波预处理、添加外源物质可以控制其生成。特别是一些食源性成分可以控制HAAs的消化吸收,调节其在人体中的代谢过程。本文虽然在HAAs生成的影响因素、抑制手段及代谢方法方面进行了论述,但是在HAAs的形成机理、消化吸收和代谢过程还应该进一步探讨,从而从根本上减少其对人体健康的威胁。
