1- MCP结合哈茨木霉菌对樱桃番茄贮藏的保鲜效果
2019-01-26巴良杰张兵兵马立志
曹 森,吉 宁,马 超,巴良杰,张兵兵,马立志,钟 梅,王 瑞,*
(1.贵阳学院食品与制药工程学院,贵州贵阳550005;2.贵州省果品加工工程技术研究中心,贵州贵阳550005;3.贵州向黔冲食品有限公司,贵州清镇551400)
樱桃番茄(Lycopersivonesculentum Mill.)又名珍珠果、小西红柿、圣女果,是一种呼吸跃变型果实,被联合国粮农组织列为优先推广的四大水果之一[1]。樱桃番茄色泽艳丽,形态诱人,酸甜可口,富含多种维生素和矿质元素以及多种对人体有益的氨基酸,深受消费者的喜爱[2]。但由于番茄属于皮薄汁多的浆果,采后生理代谢比较旺盛,并且果实易受到机械损伤以及微生物侵染,贮藏期间容易腐烂变质[3-4],这极大地限制了果实的销售期和销售半径。近年来,随着樱桃番茄种植面积和鲜果产量的逐年增加,生产上亟需适宜的樱桃番茄保鲜理论和技术。因此,寻找合适的樱桃番茄保鲜理论和贮藏技术是番茄产业健康可持续发展面临的重要问题。
1-甲基环丙烯(1-methylcyclopropene,1-MCP)作为一种乙烯抑制剂,能够抑制乙烯与受体的结合和信号传导,减缓果蔬组织对乙烯的敏感性,从而延缓果蔬的成熟与衰老[5-6]。1-MCP 具有使用剂量低和安全、高效等优点,被广泛应用于猕猴桃[7]、香蕉[8]、葡萄[9]等采后贮藏保鲜,但高浓度的 1-MCP 会影响部分果实的口感,并且乙烯的合成会影响一些与病害相关的蛋白的产生、细胞膜的通透性,影响活化酚类物质代谢以及活性氧的积累[10]。
木霉菌(Trichoderma)是一种对多种植物病原菌都有很强的拮抗作用的生防菌,由于木霉菌生长繁殖速度快,能够迅速占领营养空间、产生抗菌素,并具有广泛适应性、广谱性、多机制性及无毒等多种特点,所以它是一种应用潜力巨大的生防菌[11]。目前,木霉菌在果实贮藏保鲜中相关报道较少,采前喷施3.0×106CFU/mL的哈茨木霉菌能够有效地保持蓝莓贮藏期的贮藏品质和生物活性[11]。但关于1-MCP结合木霉菌处理的研究还未见过相关报道。因此,本研究选取纯微生物杀菌剂的哈茨木霉菌作为樱桃番茄的保鲜剂,研究采前喷施哈茨木霉菌结合采后1-MCP熏蒸对果实贮藏品质的影响,旨在延长樱桃番茄的贮藏期,为可规模化的樱桃番茄保鲜提供更为有效、安全、快捷的保鲜方法。
1 材料和方法
1.1 材料与仪器
荣耀F1代樱桃番茄 采自贵州向黔冲综合农业有限公司基地,法国最新育成黄色串收樱桃番茄品种,抗病性强,无限生长型;1-MCP(≥99%) 美国陶氏益农公司;哈茨木霉菌(叶部型 3×108CFU/g) 美国拜沃股份有限公司;厚度0.03 mm PE保鲜膜 国家农产品保鲜工程技术研究中心。
精准控温保鲜库(±0.5℃、90±5%) 国家农产品保鲜工程技术研究中心;TA.XT.Plus质构仪 英国SMS公司;TGL-16A台式高速冷冻离心机 长沙平凡仪器仪表有限公司;UV-2550紫外分光光度计 日本Shimazhu公司;pHS-25型数显酸度计 上海虹益仪器仪表有限公司;PAL-1型迷你数显折射计 日本ATAGO;PBI Dansensor残氧仪 丹麦丹圣公司;GC-14气相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 果实采收与处理 2017年8月20日9:00~11:00在贵州向黔冲综合农业有限公司基地,选择八到九成熟(樱桃番茄刚完全转黄色)的荣耀F1代樱桃番茄做好标记,用蒸馏水配置浓度为3.0×106CFU/mL哈茨木霉菌,通过手持喷雾器均匀喷布在果实表面,以樱桃番茄表面均着药液、开始滴液即可,对照处理(CK)喷洒相同量的蒸馏水,3 d后对处理的果实进行采摘,并立刻运回贵州省果品加工工程技术研究中心果蔬贮藏与保鲜研究室。选择大小及颜色基本一致、无病虫害、无机械损伤的果实,分成四组,每组15 kg果实(每个处理3个平行,每个平行5 kg),使用大功率工业风扇除去田间热,并愈伤24 h。然后分别置于两个低密度聚乙烯(厚度:0.08 mm,体积:1 m3)帐内;以0.5 μL/L的1-MCP分别对其中2组样品进行熏蒸处理24 h(25±2℃),为保证账内完全密封,熏蒸前将帐子搭好并仅留一处开口,立即将称量好的1-MCP放入盛装蒸馏水的烧杯里,然后立即使用封口胶将开口处密封,其他两组只放相同质量的蒸馏水进行熏蒸,熏蒸后经30μm的PE保鲜膜分装,分装后将不同处理(采前喷水+蒸馏水熏蒸处理记为S1;采前喷3.0×106CFU/mL哈茨木霉菌+蒸馏水熏蒸记为 S2;采前喷水 +0.5μL/L的1-MCP处理记为 S3;3.0×106CFU/mL哈茨木霉菌+0.5μL/L的1-MCP处理记为S4)的番茄樱桃放置在(11±0.5)℃的环境中预冷24 h后扎袋贮藏(贮藏温度为(11±0.5)℃,RH≥85%)。每隔12 d随机取样对样品各项指标进行测定,结果取平均值,测定周期为48 d。
1.2.2 腐烂率的测定 采用称重法来测定樱桃番茄的腐烂率,判断标准以局部长霉、腐烂、流水等全部计入腐烂果实质量,计算公式如下:
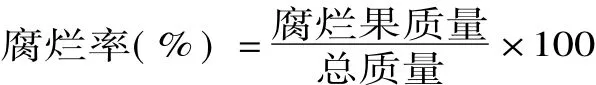
1.2.3 硬度的测定 采用物性仪测定,测试硬度参数如下:将樱桃番茄横向放置在质构仪上,有果蒂一头朝向质构仪左边,采用P/2N探头对其进行穿刺测试,穿刺深度为6 mm,测前速度2 mm/s,测中速度1 mm/s,测后速度2 mm/s,触发力5.0 g,各处理重复测定15次,取其平均值,单位为g。
1.2.4 呼吸强度的测定 采用静置法经残氧仪测定[12]。称取质量为(300±5)g番茄置于11.5℃密闭容器中3 h,然后测定氧气和二氧化碳浓度。计算
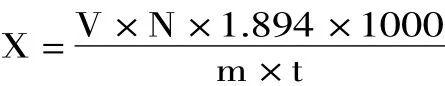
式中:X 为呼吸强度,mg CO2·kg-1·h-1;N 为二氧化碳体积分数,%;V为容器体积(干燥器体积-果实体积),L;m为样品质量,kg;t为放置时间,h;1.894 g/L为常压下二氧化碳的密度。
1.2.5 乙烯生成速率的测定 乙烯生成速率采用气相色谱仪程序升温法进行测定[13]。色谱柱条件:Agilent,DB-5(30 m ×0.25 mm ×0.25 μm);检测器:FID,温度 230℃;进样口:温度120℃;升温程序:80℃保持2 min。6℃/min升温至230℃,保持1 min。载气:N2,流速 24 mL/min;尾吹气:N2,流速30 mL/min,尾吹:30 mL/min。每次取(300±5)g番茄放入干燥器内,密封3 h,取样10 mL进行测定。
1.2.6 可溶固形物含量的测定 每处理随机取20个番茄果实,高速组织捣碎后10000 r/min离心10 min后,取上清液使用PAL-1迷你数显折射仪测定。
1.2.7 可滴定酸含量的测定 参照GB/T 12456-2008测定。
1.2.8 VC含量的测定 参照钼蓝比色法测定[14],略有改动。准确称取10.0 g樱桃番茄匀浆于容量瓶中,加入草酸-EDTA溶液并定容于100 mL容量瓶中,过滤。吸取10 mL滤液于50 mL容量瓶中,并加入1.0 mL的偏磷酸-醋酸溶液、5%的硫酸2.00 mL,摇匀后,加入4.0 mL钼酸铵溶液,以蒸馏水定容至50 mL,其中以蒸馏水为空白对照,于705 nm处测定吸光度,并计算含量。计算公式为:公式为:
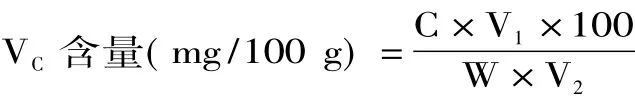
式中:C为测定用样液中VC的含量(mg);V1样液定容总体积(mL);V2测定用样液体积(mL);W为样品质量(g)。
1.2.9 超氧化物歧化酶(SOD)活性的测定 参考曹建康等[15]果蔬采后生理生化实验指导书的方法进行测定(规定0.01 A/min=1U)。
1.2.10 过氧化物酶(POD)活性的测定 采用愈创木酚法,参照张群等[16]的测定方法,略有改动。称取3 g樱桃番茄果肉组织(-78℃冰箱内液氮粉碎的样品),加入15 mL 50 mmol/L p H为5.5的磷酸钠缓冲液中,冰浴研磨,10000×g冷冻(4℃)离心15 min,取上清液用于 POD活性测定,取一支试管,加入3.0 mL 25 mmol/L的愈创木酚溶液和0.5 mL酶提取液,再加入0.5 mL质量分数1%的H2O2溶液迅速混合启动反应,同时开始计时。将反应混合液倒入比色杯中,以蒸馏水为参比,在反应15 s时测其在波长460 nm处的吸光值,并每间隔30 s记录1次,连续测定,至少获得6个点的数据,重复3次(规定0.01 A/min=1U)。
1.2.11 多酚氧化酶(PPO)活性的测定 采用邻苯二酚法,参照张群等[16]的测定方法,略有改动。取-70℃冰箱内液氮粉碎的样品3 g,酶液提取方法同POD提取法。取1支试管,加入1.5 mL 50 mmol/L、pH5.5的乙酸-乙酸钠缓冲液和1.0 mL 50 mmol/L邻苯二酚溶液,后加入1 mL酶提取液,以缓冲液为参比,同时开始计时。在反应15 s时测其在波长398 nm处的吸光值,并每间隔30 s记录1次,连续测定,至少获得6个点的数据,重复3次(规定0.01 A/min=1 U)。
1.2.12 脂氧合酶(LOX)活性的测定 参照张群等[16]的测定方法,略有改动。取-70℃冰箱内液氮粉碎的的样品3 g,加25 mL 100 mmol/L,p H8.0 Tris-HCl磷酸缓冲液,冰浴研磨,10000×g冷冻(4℃)离心15 min,取上清液用于LOX酶活的测定。反应液包括2.85 mL pH6.0的100 mmol/L磷酸钠缓冲液、50μL 10 mmol/L亚油酸钠和0.1 mL酶液,空白为2.95 mL pH6.0的100 mmol/L磷酸钠缓冲液和50μL 10 mmol/L亚油酸钠,30℃反应,在234 nm下测定吸光度(规定0.01 A/min=1 U)。
1.3 数据处理与分析
采用OriginPro 8.0软件对数据进行统计处理,采用SPSS 19.0软件的Duncan氏新复极差法进行数据差异显著性分析(p<0.05为差异显著)。
2 结果与分析
2.1 不同处理对樱桃番茄腐烂率和硬度的影响
腐烂率是樱桃番茄贮藏效果的直接体现,硬度是反映果实软化程度的重要外在指标。由图1(A)可知,樱桃番茄在贮藏12 d内的腐烂率没有显著差异(p>0.05),从贮藏12 d开始,S1组的腐烂率开始快速上升,而其他处理缓慢上升,贮藏24 d时,各个处理腐烂率的大小关系为S1组>S3组>S2组>S4组。从贮藏24 d开始,S2组腐烂率开始快速上升至贮藏末期(48 d),在贮藏48 d时,S1组、S2组、S3组、S4组的腐烂率分别为49.85%、37.89%、28.56%和19.81%,并且各个处理间均有显著差异(p<0.05),说明S4组能够更好地抑制果实腐烂率的上升,S3组次之。由图1(B)可知,番茄的硬度在贮藏期间呈现先上升后下降的趋势,不同处理的果实硬度均在贮藏12 d时达到峰值,从贮藏12 d开始,各个处理的硬度均呈现不同程度的下降。在贮藏末期(48 d)时,S4组显著高于其他处理(p<0.05),而其他处理与对照没有显著性差异(p>0.05),可能由于哈茨木霉菌的菌丝可以缠绕并且能够寄生疫霉菌或灰霉菌的菌丝使其断裂,从而延缓腐烂[11],而1-MCP抑制果实的呼吸作用,延缓果实采后衰老[4],两者结合效果最好,并且可以将果实贮藏期延长至48 d。因此,S4组能够更好地延缓果实硬度的下降,而S2和S3对果实硬度下降的抑制没有S4组效果好。
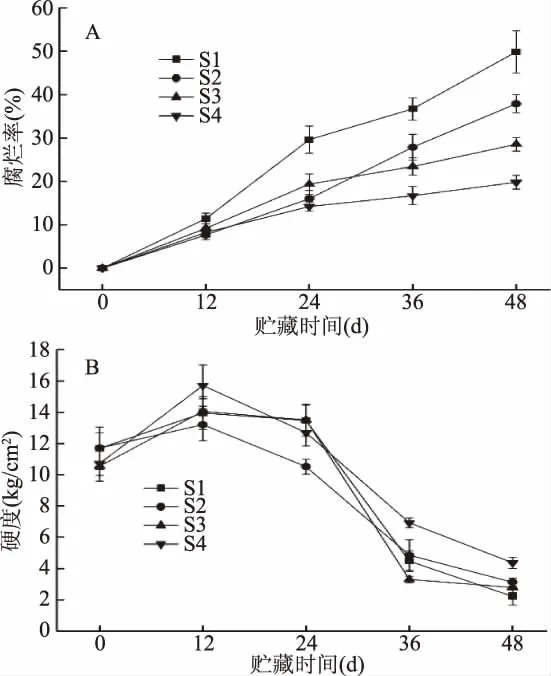
图1 不同处理对樱桃番茄腐烂率(A)和硬度(B)的影响Fig.1 Effects of different treatments on the rot ratio(A)and the firmness(B)of cherry tomato
2.2 不同处理对樱桃番茄呼吸强度和乙烯生成速率的影响
呼吸强度和乙烯生成速率是果实贮藏期间生理变化主要指标。由图2可知,果实的呼吸强度和乙烯生成速率在贮藏期间呈现先上升后下降的趋势,这与番茄果实属于呼吸跃变型果实结论一致[17]。由图2(A)可知,不同处理的呼吸强度在贮藏初期差异不显著(p>0.05),S1、S2组处理的呼吸强度在贮藏12 d时达到峰值,而S3、S4处理的呼吸强度在贮藏24 d达到峰值,说明S3、S4组处理能够推迟樱桃番茄呼吸峰的出现,在贮藏末期(48 d),不同处理的樱桃番茄呼吸强度大小关系为S1组>S2组>S3组>S4组,并且S4组与其他处理组比较均有显著差异(p<0.05)。由图2(B)可知,S1组和S2组处理的乙烯生成速率在贮藏12 d时达到峰值,S3、S4组处理的乙烯生成速率在贮藏24 d达到峰值,这与图2(A)果实呼吸强度的结果一致,说明S3、S4组均能够推迟呼吸峰的出现,说明1-MCP处理能够推迟果实呼吸峰的出现。在贮藏48 d时,S4组的乙烯生成速率显著(p<0.05)低于其他处理,而S3组与其他组没有显著性差异(p<0.05),原因可能是S3组在贮藏48 d时,由于致病菌侵染导致果实快速腐烂,从而加快呼吸和乙烯的上升,说明S4组能够保持果实较低的呼吸强度和乙烯生成速率。
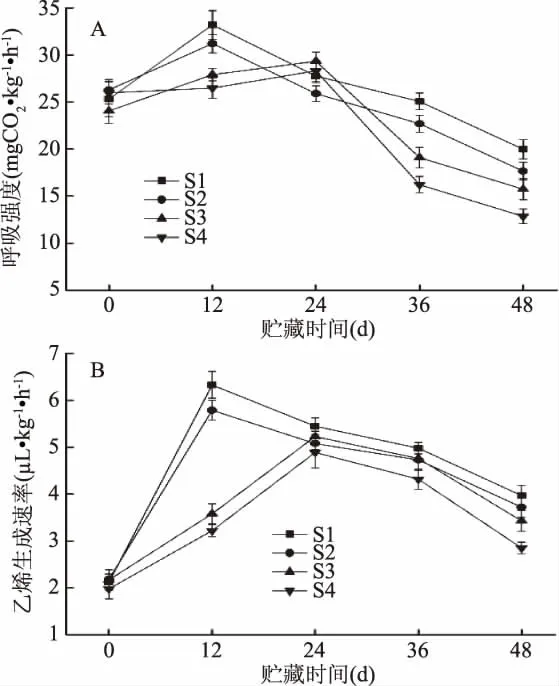
图2 不同处理对樱桃番茄呼吸强度(A)和乙烯生成速率(B)的影响Fig.2 Effects of different treatments on the respiration rate(A)and the ethylene production rate(B)of cherry tomato
2.3 不同处理对樱桃番茄可溶性固形物和可滴定酸含量的影响
可溶性固形物与可滴定酸含量是果实口感的直接体现。由图3可知,樱桃番茄的可溶性固形物和可滴定酸含量均呈现先上升后下降的趋势,并且均在贮藏12 d时出现峰值。由图3(A)可知,在贮藏12 d时,S4组显著(p<0.05)高于 S1、S2组,但与S3组没有显著性差异(p>0.05),在贮藏末期(48 d)时,S1、S2、S3、S4组的可溶性固形物含量分别为4.56%、4.87%、5.19%和5.45%,并且S2、S3、S4组与S1组有显著性差异(p<0.05),而S4组与S2、S3处理没有显著性差异(p>0.05)。由图3(B)可知,在贮藏12 d时,各个处理的可滴定酸含量均没有显著性差异(p>0.05),从贮藏12 d开始,不同处理的可滴定酸含量均呈现不同程度的下降,在贮藏48 d时,不同处理的可滴定酸大小关系为S4组>S2组>S3组>S1组。说明哈茨木霉菌处理在抑制果实可滴定酸下降的效果优于1-MCP处理。因此,与对照组比较(S1),不同处理均能够延缓可溶性固形物和可滴定酸含量的下降,其中S4处理组的效果最好。

图3 不同处理对樱桃番茄可溶性固形物(A)和可滴定酸含量(B)的影响Fig.3 Effects of different treatments on the soluble solids content(A)and the titratable acid content(B)of cherry tomato
2.4 不同处理对樱桃番茄VC含量和SOD活性的影响
VC含量和超氧化物歧化酶(SOD)活性是衡量果实营养价值和衰老程度的重要指标,SOD能通过歧化反应清除生物细胞中的超氧阴离子自由基,从而降低自由基对有机体的毒害作用,其采后的活性对果实的品质影响较大[18]。由图4(A)可知,VC含量在贮藏期间呈现先上升后下降的趋势,在贮藏12 d时达到峰值,此时不同处理的大小关系为S4>S3>S2>S1,在贮藏48 d时,S4组的 VC含量显著(p<0.05)高于对照组(S1),但与其他处理没有显著差异(p>0.05)。由图4(B)可知,樱桃番茄的SOD活性从贮藏开始到贮藏12 d呈现上升的趋势,此时各个处理组之间没有显著差异(p>0.05),从贮藏12 d开始,S1、S2组和S3组的SOD活性开始快速下降,而S4组的 SOD活性则相对缓慢下降,在贮藏末期(48 d),S4组的VC含量显著(p<0.05)高于对照组(S1),但与其他处理没有显著差异(p>0.05)。由此说明,不同处理之间均能够抑制樱桃番茄VC含量和SOD活性的下降,但S2、S3组、S4组相互之间均没有显著性差异(p>0.05),说明哈茨木霉菌和1-MCP在维持果实VC含量和SOD活性效果没有明显区别,综合比较,S4组维持果实VC含量和SOD活性的效果最好,S3组次之。
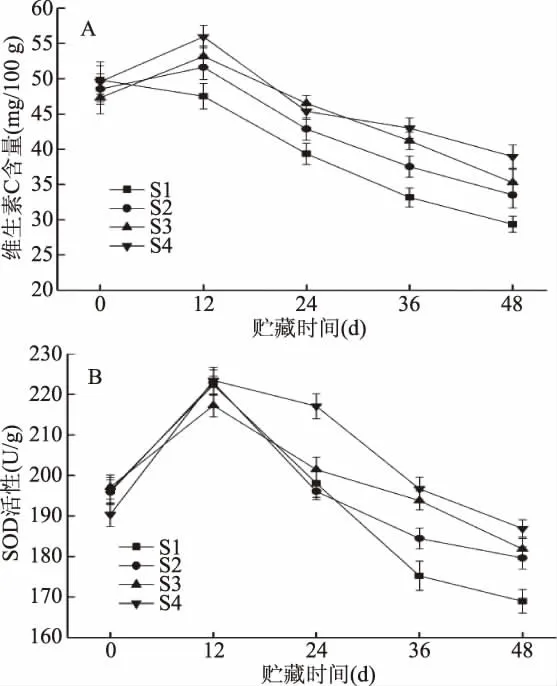
图4 不同的处理对樱桃番茄维生素C含量(A)和SOD活性(B)的影响Fig.4 Effects of different treatments on the vitamin Ccontent(A)and the superoxide dismutase activity(B)of cherry tomato
2.5 不同处理对樱桃番茄PPO、POD和LOX活性的影响
果实的贮藏效果与相关酶的活性密不可分,酶的活性反映樱桃番茄的贮藏品质。多酚氧化酶(PPO)是能够催化简单酚类的一种含有铜为辅基的氧化酶,当果蔬组织受到病菌侵染或者其他逆境胁迫的时候,PPO活性会快速升高,从而保护植物组织[19]。由图5(A)可知,从贮藏开始到贮藏12 d时,不同处理的PPO活性均呈现上升趋势,原因可能由于刚入库的樱桃番茄受低温胁迫导致的,或由于樱桃番茄采收后进行愈伤导致的。从贮藏12 d开始,不同处理的PPO活性开始下降,在贮藏结束时,S4组均显著(p<0.05)低于其他处理。
过氧化物酶(POD)能够将SOD作用产物过氧化氢催化分解成对体内细胞没有伤害的氧气与水,使体内不受过氧化氢伤害,所以POD的活性是衡量系统清除自由基能力的重要指标[20]。由图5(B)可知,不同处理樱桃番茄的POD活性呈现先上升后下降的趋势,在贮藏12 d时,不同处理樱桃番茄的POD活性大小关系为S2组 >S4组 >S3组 >S1组,并且S2、S4组与其他处理有显著差异(p<0.05),而S2组和S4组没有显著差异(p>0.05),在贮藏48 d时,S4组显著(p<0.05)高于其他处理,但其他处理间没有显著差异(p>0.05)。
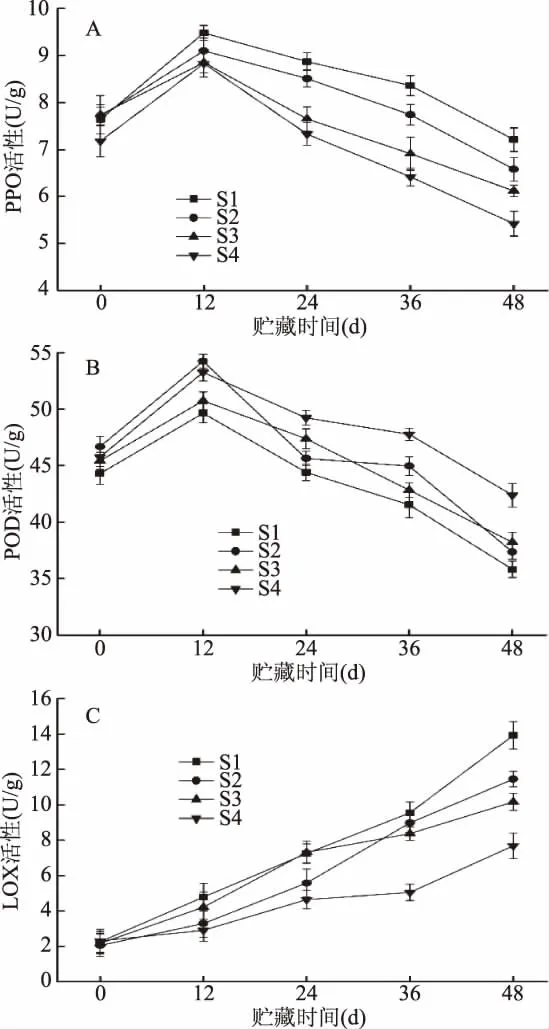
图5 不同的处理对樱桃番茄PPO(A)、POD(B)和LOX活性(C)的影响Fig.5 Effects of different treatments on the polyphenol oxidase activity(A),the peroxidase activity(B)and the lipoxygenase activity(C)of cherry tomato
脂氧合酶(LOX)是直接或间接的参与组织衰老的一种含有非血红素铁的蛋白质,它可以通过与多聚不饱和脂肪酸发生氧化,使细胞膜的完整性受损并且改变膜的通透性,在膜脂氧化过程中起到关键的作用,也是衡量果蔬衰老的关键指标[19]。由图5(C)可知,LOX活性在贮藏期间呈现上升的趋势,在贮藏前期,不同处理的LOX活性没有显著差异(p>0.05),在贮藏末期(48 d)时,不同处理的LOX活性大小关系为S1组>S2组>S3组>S4组,并且各个处理间均有显著差异(p<0.05)。由此可知,不同的处理均能够保持樱桃番茄的酶活性,其中S4组处理效果最好,能够更好地抑制樱桃番茄PPO活性和LOX活性的上升,延缓POD活性的下降。
3 讨论
番茄灰霉病是由半知菌亚门真菌,灰葡萄孢菌(Botrytis cinerea)引起的一种世界性重要病害,发病后传播迅速[21],因此,灰霉病的发生率是番茄果实贮藏效果重要因素之一,而木霉菌的菌丝可以缠绕并且能够寄生疫霉菌或灰霉菌的菌丝使其断裂[22],从而抑制果实的腐烂。本研究结果表明,不同处理均能够延缓果实腐烂率的上升和抑制果实硬度的下降,其中,在贮藏前期,S2组处理(哈茨木霉菌)的腐烂率低于S3组(1-MCP)处理,而贮藏后期S2处理的腐烂率高于S3,说明哈茨木霉菌在贮藏前期对樱桃番茄的腐烂率抑制效果优于1-MCP处理,而1-MCP处理在贮藏后期对果实腐烂率的抑制效果更好,但通过比较发现,S4组(哈茨木霉菌结合1-MCP)在整个贮藏期间能够更好地延缓樱桃番茄腐烂率的上升。
1-MCP作为一种乙烯受体抑制剂,能不可逆地作用于乙烯受体,阻断乙烯的正常结合,抑制所诱导的与果蔬或衰老相关的一些列生理生化反应。Tassoni等[23]研究表明,1-MCP 能够抑制番茄乙烯受体基因的表达,从而延缓番茄的衰老。Beno等[24]研究表明,1μL/L的1-MCP能够抑制贮藏期间番茄的软化。郑铁松等[25]研究表明,1-MCP明显减缓了番茄硬度的下降,抑制了呼吸强度的增大,并有利于保持番茄果肉细胞结构的完整性,最好的保鲜浓度在0.5~0.9μL/L之间。本实验研究表明,S3处理能够抑制果实的呼吸强度和乙烯生成速率,这与前人结果研究一致。但有研究表明,高浓度的1-MCP影响贮藏期间果实的口感和香气[26-27],所以,本实验为更好地保持樱桃番茄贮藏的品质和口感,确认哈茨木霉菌结合1-MCP对樱桃番茄保鲜的有效性。结果表明,S4组(哈茨木霉菌结合1-MCP)能够更好地抑制果实硬度的下降,降低果实的呼吸强度和乙烯生成速率,维持果实可溶性固形物、可滴定酸含量、VC含量和SOD活性。另外,本实验还研究了不同处理对樱桃番茄生理相关酶的影响,结果表明S4(哈茨木霉菌结合1-MCP)处理可以抑制PPO、LOX的活性升高,延缓POD活性的降低,进而延缓果实的衰老,保持贮藏期间樱桃良好的贮藏品质。
4 结论
本实验研究表明,与对照(S1)相比,不同的处理均能够抑制腐烂率上升,延缓果实硬度、可溶性固形物、可滴定酸含量和VC含量的下降,降低果实的呼吸强度和乙烯生成速率,更好地保持 SOD、PPO、POD、LOX 活性,其中 S1、S2、S3、S4 的腐烂率在贮藏末期(48 d)分别为 49.85%、37.89%、28.56%和19.81%。通过比较,采前喷施3.0×106CFU/mL哈茨木霉菌结合采后用0.5μL/L的1-MCP来处理樱桃番茄对果实的贮藏效果最好,能够明显延缓果实的衰老进程,保持较高的贮藏品质,并且樱桃番茄在贮藏末期(48 d)时腐烂率最低。
