不同分子量的葡聚糖 花生分离蛋白接枝复合物的制备及其性质
2019-01-26吴周山陆利霞熊晓辉
吴周山,李 晨,* ,薛 瑞,梁 忠,薛 峰,陆利霞,3,熊晓辉,3
(1.南京工业大学食品与轻工学院,江苏南京211800;2.南京中医药大学药学院,江苏南京210023;3.江苏省食品安全快速检测公共技术服务中心,江苏南京210009)
花生蛋白是一种营养价值较高的植物蛋白,由其制备的花生蛋白乳饮料不仅含有丰富的营养,而且具有很好的口感,深受消费者的喜爱。但由于花生蛋白自身的一些功能性质如乳化性、乳化稳定性等存在缺陷,导致其制备成的植物蛋白乳饮料不稳定,容易产生沉淀物质[1]。因此,研究花生蛋白的理化性质,对于改善其功能性质,开发新的应用方式有着非常重要的意义。
近年来,研究发现利用多糖接枝能够改善蛋白质的功能特性,且由经过多糖接枝后生成的蛋白-多糖共价聚合物制备成的乳浊液体系能够保持良好的物理和化学稳定性[2]。Cai等[3]利用多糖(卡拉胶、壳聚糖、羟甲基纤维素、甲基纤维)接枝到花生蛋白上,并观察接枝后产物的性质,发现随着多糖含量的增加,花生蛋白的溶解性降低,而乳化稳定性会得到增强。同样在大豆蛋白和燕麦蛋白与多糖的接枝反应中也能得到同样的结论[4-7]。多糖接枝是将多糖分子上的还原末端羰基接枝到蛋白质分子上的ε-氨基上的反应[8],因此,多糖接枝后形成的蛋白-多糖共价聚合物的性质不仅与蛋白质有关,同时也和接枝过程中的多糖有关。有研究表明葡聚糖能够显著提高花生蛋白的乳化性能[3],但葡聚糖分子量对于葡聚糖的性质会产生影响。
目前对于葡聚糖分子量的改变是否影响接枝产物性质的研究鲜有报道。鉴于此,本文选用10、20、40以及70 kDa四种不同分子量的葡聚糖与花生分离蛋白接枝形成相应接枝共价聚合物,并结合内源荧光光谱、远紫外圆二色谱、表面疏水性、表面张力等技术手段对其结构特性和所形成乳浊液的流变学特性进行分析,多角度观察不同分子量的葡聚糖接枝花生分离蛋白形成的复合物结构和性质。
1 材料与方法
1.1 材料与仪器
花生分离蛋白(PPI) 上海源叶生物科技有限公司(凯氏定氮法测定的蛋白质量分数85.33%);葡聚糖(相对分子量10、70 kDa) 合肥博美生物科技有限公司;葡聚糖(相对分子量20、40 k Da) 国药集团化学试剂有限公司;金龙鱼食用调和油 上海嘉里食品工业有限公司;β-巯基乙醇 合肥博美生物科技有限公司;8-苯胺基-1-苯磺酸 萨恩化学技术(上海)有限公司;其它试剂 西陇化工股份有限公司。
T-25IKA均质机 德国IKA公司;AH-BASIC高压均质机 安拓思纳米技术(苏州)有限公司;HJ-4磁力搅拌器 金坛区白塔新宝仪器厂;ZS90纳米粒度、Zeta电位分析仪 英国马尔文仪器有限公司;UV-1800紫外-可见分光光度计 上海美诺达仪器有限公司;Mos-450圆二色谱仪 法国Biologic公司;DCAT21自动化表面张力仪 德国Dataphysics公司;MCR302高级旋转流变仪 奥地利安东帕(中国)有限公司。
1.2 实验方法
1.2.1 接枝反应产物制备 分别称取不同相对分子量的葡聚糖与PPI等质量混合,分散在去离子水中(确保蛋白和多糖的混合物刚好溶解即可),用磁力搅拌器搅拌1 h,使蛋白和多糖充分溶解,然后将混合溶液冷冻干燥,完成后将冻干后的粉末置于温度60℃、湿度79%的环境下反应3 d,取样,置于干燥器中,备用[9]。
制得接枝反应产物:PPI和葡聚糖10 kDa(Dex 1)共价聚合物(PDC1)、PPI和葡聚糖20 kDa(Dex 2)共价聚合物(PDC2)、PPI和葡聚糖40 k Da(Dex 4)共价聚合物(PDC4)、PPI和葡聚糖70 kDa(Dex 7)共价聚合物(PDC7)。相应的PPI和葡聚糖未发生接枝反应的共混物:PDM1、PDM2、PDM4、PDM7,另外,Heat-PPI是经过接枝反应条件处理后的产物。
1.2.2 乳浊液的制备 将PPI蛋白样品或者接枝后的蛋白-多糖样品分散于10 mmol/L的磷酸盐缓冲溶液中,使得样品终浓度为2%。将混合好的样品溶液置于4℃的冰箱中24 h,保证溶液中的样品能充分水化。然后,向水化后的样品溶液滴加食用大豆油,使得最终混合溶液中油的比例为10%(w/w),将其用高速剪切机以24000 r/min剪切1 min形成初步乳浊液,然后再将初步乳浊液用高压均质机以70 MPa的压力均质 2 min,反复均质3次,最终制备成乳浊液[10]。
1.2.3 接枝度的测定 共价聚合物的接枝度按照OPA法进行测定[11]。OPA试剂的配制:将 40 mg OPA用1 mL甲醇溶解,然后加入25 mL浓度为10 mmol/L四硼酸钠溶液、2.5 mL 20% 浓度的SDS溶液以及100μLβ-巯基乙醇溶液,混合均匀后,用蒸馏水定容至50 mL得到OPA试剂。
用10 mmol/L,pH7.0的磷酸盐缓冲液将各样品进行溶解,配制成终浓度为2 mg/mL的样品溶液。取200μL样品溶液加入4 mL的OPA试剂中,35℃下反应2 min,然后用分光光度计在340 nm下比色。以 Lys作标准曲线(y=7.5171x+0.0128,R2=0.9993)计算出样品中的自由NH2的含量。利用公式(1)计算接枝度(Degree of grafting,DG):
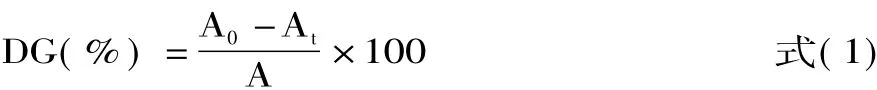
其中:A0为接枝前的样品中自由NH2含量(g),At为接枝后样品中的自由NH2含量(g),A为PPI中的自由NH2含量(g)。
1.2.4 远紫外圆二色谱扫描 远紫外圆二色谱图(Far-UV-CD)用于分析蛋白质的二级结构,可以通过圆二色谱图了解到蛋白质的α-螺旋、β-折叠、β-转角和无规则卷曲等二级结构变化情况。将各待测样品用10 mmol/L、pH7.0的磷酸盐缓冲液进行溶解,终浓度为0.2 mg/mL,磷酸盐缓冲液作为空白对照。圆二色光谱测定时参数设定:扫描波长为190~250 nm,所用样品池光程为2 mm,分辨率为0.5 nm,扫描速度100 nm/min,灵敏度为100 mdeg/cm,试验温度为25℃。得到蛋白质的平均摩尔椭圆吸光率用[θ](deg cm2dmol-1)表示[12]。
1.2.5 内源荧光光谱扫描 分别称取一定量各样品,用10 mmol/L磷酸盐标准缓冲液(p H7.0)进行充分溶解,终浓度为0.15 mg/mL,用荧光分光光度计对各样品进行发射波长扫描,记录各样品的荧光光谱。荧光分光光度计参数设置激发波长为290 nm,扫描速度为10 nm/s,扫描范围为300~400 nm,狭缝宽度为 5 nm[13]。
1.2.6 表面疏水性测定 表面疏水性采用ANS荧光探针法进行测量。将2 mg/mL的样品溶液用10 mmol/L,pH7.0的磷酸盐缓冲液分别稀释至0.05、0.1、0.2、0.5、1 mg/mL 浓度,并用标准缓冲液配制8 mmoL的8-苯胺基-1-苯磺酸(ANS)溶液。每种浓度下的样品溶液分别取4 mL于不同试管中,加入20μL ANS,用旋涡振荡器混合均匀,然后用荧光分光光度计记录下各样品的荧光强度。荧光分光光度计参数设置:激发波长为390 nm,发射波长为470 nm,狭缝宽度为5 nm。以荧光强度对样品浓度作图,曲线的初始斜率即为蛋白质的表面疏水性指数(H0)[14]。
1.2.7 表面电势测定 采用Malvern公司的Zeta电位仪测定样品的表面电势,首先将各待测样品先用10 mmol/L,pH7.0的磷酸盐缓冲液配制成2 mg/mL的溶液,在测定表面电势前,将各待测溶液用相同磷酸盐缓冲溶液稀释至0.001%的浓度。然后在25℃环境下重复测定3次,取平均值为最终测定结果[15]。
1.2.8 表面张力测定 采用表面张力仪来测定1.2.2中制备的乳浊液样品的表面张力。在20℃下对表面张力测定3次,取平均值为最终结果,表面张力(γ)结果和临界胶束浓度(CMC)可以从仪器中直接读取,然后根据γ值和CMC值结果和吉布斯吸附方程计算出表面吸附量(Γ),方程如下:

式中:C值是浓度(mg/mL),R是气体常数,T是绝对温度(℃)。表面吸附量中的每个分子的平均面积(A)是根据以下公式计算所得:

其中:N是阿伏伽德罗常数[16]。
1.2.9 乳化性及乳化稳定性测定 将各待测样品用10 mmol/L,pH7.0的磷酸盐缓冲液进行溶解,使得终浓度为2 mg/mL。将蛋白质溶液和大豆油按体积比3∶1混合并在均质机下以20000 r/min搅拌1 min获得乳状液。搅拌完后,立即用移液枪吸取50μL底部乳状液,加入5 mL的0.1%SDS溶液中,稀释后,用分光光度计在500 nm波长下测定吸光度。待乳状液静置10 min后,同样吸取底部乳状液50μL,加入5 mL的0.1%SDS溶液中进行稀释,然后在500 nm波长下测定吸光度。乳化活性(EAI)和乳化稳定性(ESI)计算公式见式(4)和式(5):

式中:DF为稀释倍数100;C为乳化液形成前蛋白质水溶液中蛋白质质量浓度;φ为比色皿的厚度1 cm;为乳化液中油的体积分数0.25;A0为0 min时取样测定的吸光度;A10为10 min时取样测定的吸光度[17]。
1.2.10 流变性质测定 采用安东帕MCR302型流变仪,对1.2.2中制备的乳浊液样品的流变性质进行测定,测定参数为:50 mm的锥板,稳态流动爬升范围为0.01~100 s-1,温度为25℃,在此条件下进行剪切速率扫描,记录下数据。并对数据采用Ostwald-de Waele模型进行拟合,公式如式(6):

式中:σ(Pa)为剪切应力,γ(s-1)为剪切速率,K(Pa·s)为稠度系数,n 为流变指数[18]。
1.3 数据处理
实验最少重复3次,所有数据用SPSS 17.0软件处理,得到的结果表示为平均值±标准差,并使用Origin 8.5软件进行作图。
2 结果与分析
2.1 不同分子量的葡聚糖与PPI的接枝能力分析
图1为不同分子量的葡聚糖与PPI发生反应生成的共价聚合物的接枝度测定结果。可以发现,不同分子量大小的葡聚糖都能与PPI发生接枝反应且难易程度有较大差别,其中Dex 1最易与PPI发生接枝反应,同样反应条件下,其与PPI的接枝产物PDC1接枝度达到48.1%左右,而其它分子量与PPI的相应接枝产物中,PDC2接枝度 37.2%附近,PDC4和PDC7则更低,在20%左右。可以看出,随着葡聚糖分子量的增加,其越难与PPI发生接枝反应,这可能由于分子量小的葡聚糖反应性更高,且接枝到蛋白上的多糖分子形成的空间位阻对结合比有影响[19]。

图1 不同分子量葡聚糖与PPI共价聚合物的接枝度Fig.1 The graft degree of covalent polymer generated by different molecular weight of dextran and PPI
2.2 圆二色谱分析
通过远紫外圆二色谱可以对PPI发生接枝反应前后的二级结构变化进行分析。图2是PPI以及PPI与不同多糖发生接枝反应后的共价聚合物的圆二色谱图,从图2中可以发现,发生接枝反应后的蛋白的圆二色谱曲线发生了明显变化,在192 nm处α-螺旋构象特征峰强度减小,210 nm附近也发生了明显的减弱现象,表明发生接枝反应后PPI的二级结构发生了明显改变。

图2 不同共价聚合物和PPI的圆二色谱图Fig.2 The circular dichroism spectra of different covalent polymers and PPI
通过软件CDtool计算得到PPI发生接枝反应前后具体二级结构比例变化情况,如表1所示,可以发现发生接枝反应后的PPI的α-螺旋和无规卷曲结构减少,β-折叠和β-转角结构增加,这种变化表明,发生接枝反应后PPI的内部二级结构折叠程度发生了改变。其中PDC1和PDC2的α-螺旋结构减少比例相对较高,根据 Hattori等[20]的研究,α-螺旋结构的减少主要是由于ε-氨基与多糖的结合所引起的,可以说明多糖与蛋白之间发生了接枝反应。而β-折叠和β-转角两种结构的增多,表明发生接枝反应后的共价聚合物结构变得更加松散。
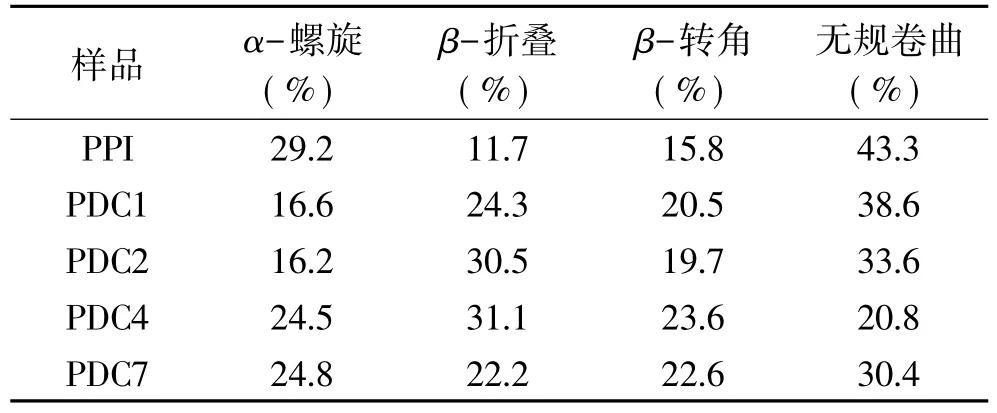
表1 不同共价聚合物和PPI的二级结构Table 1 Secondary structure distributions of different covalent polymers and PPI
2.3 内源荧光光谱分析
含有芳香族氨基酸色氨酸(trptophan,Trp)、酪氨酸(tyrosine,Tyr)和苯丙氨酸(phenylalanine,Phe)残基的蛋白质在280 nm或295 nm激发光的激发下会产生荧光,这种荧光称为内源性荧光(天然荧光)。因此,可以通过蛋白质产生的内源荧光强度的改变来了解蛋白的构象变化[21]。
如图3和图4所示,PPI与葡聚糖的共混物由于多糖的遮蔽作用,引起最大荧光强度的降低,最大荧光发射波长却没有明显偏移,而PPI和葡聚糖发生接枝反应生成共价聚合物后,以主要作用力共价键形式结合在蛋白多肽链上的多糖,会对蛋白表面Trp残基形成遮蔽作用,引起最大荧光强度的降低,同时由于接枝引起蛋白结构的改变,导致最大荧光发射波长发生红移现象,这种现象越明显,表明发生反应后的蛋白拥有更加松散的三级结构,导致内部疏水性基团得以暴露,从而引起表面疏水性的改变[22]。
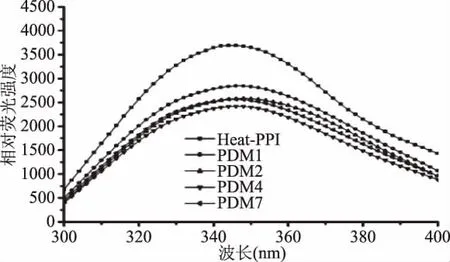
图3 不同共混物和Heat-PPI的内源荧光光谱Fig.3 The intrinsic emission fluorescence spectra of different blend and Heat-PPI

图4 不同共价聚合物和PPI的内源荧光光谱Fig.4 The intrinsic emission fluorescence spectra of different covalent polymers and PPI
表2是PPI和不同分子量葡聚糖共价聚合物的最大荧光对应的发射波长,可以发现蛋白与多糖共混物以及Heat-PPI最大荧光对应的发射波长无明显改变,而蛋白-多糖共价聚合物的最大荧光对应的发射波长都发生了红移现象,其中PDC1、PDC2红移现象更明显,结合接枝度结果可以发现,这两种共价聚合物的蛋白-多糖的接枝度也是最高的,可以说明多糖与蛋白发生接枝反应会引起蛋白三级结构的改变,而蛋白与多糖直接混合以及在反应温度下的加热都不会引起蛋白结构的改变。
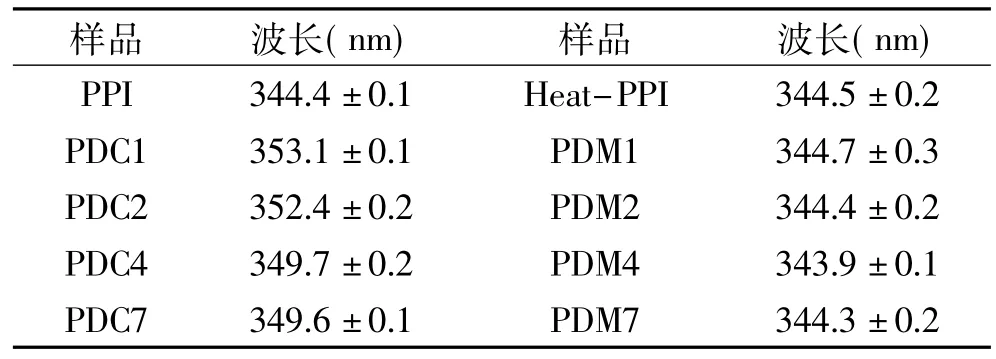
表2 不同样品的最大荧光强度对应的波长Table 2 The wavelength corresponding tothe biggest fluorescence intensity of different samples
2.4 表面疏水性分析
蛋白质具有特定的空间结构,在其形成过程中,非极性氨基酸由于疏水性会趋向于进入蛋白质内部,而极性氨基酸会分布于蛋白表面[23]。蛋白质的表面疏水性强弱与蛋白质表面的疏水性基团的变化情况有着密切联系。因此,可以通过观察蛋白质的表面疏水性变化来分析蛋白的一些性质以及结构的变化。
图5为PPI以及PPI与不同分子量的葡聚糖共价聚合物的表面疏水性结果。从图5中可以发现,PPI发生接枝反应后形成的共价聚合物的表面疏水性均得到了明显升高,其主要原因是,一方面发生接枝反应时,多糖接枝到蛋白的肽链上,会引起蛋白肽链的伸展,从而结构变得松散,内部的疏水性基团得以暴露,最终导致蛋白疏水性增强;另一方面接枝到蛋白上的多糖也会携带部分疏水性基团,在发生反应时,会迁移到蛋白的表面,引起蛋白表面疏水性的增加[24]。可以看到,PDC2的分子表面疏水性指数变化最大,达到了783±19,表面疏水性的改变会引起PDC2分子在水溶液中疏水作用力的改变。
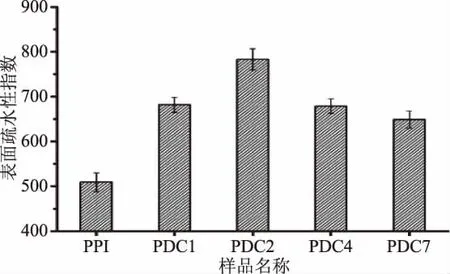
图5 不同共价聚合物和PPI的表面疏水性结果Fig.5 The surface hydrophobicity of different covalent polymers and PPI
2.5 Zeta电位分析
Zeta电位通常被用来确定胶体溶液体系的稳定性状况。它能用于分析胶体颗粒间作用力的强度,是判断稳定性的一项重要指标。通常情况下,体系中胶体颗粒的表面Zeta电位越高,颗粒间的排斥力表现得越大,越不容易发生聚集沉淀,则体系会表现得相对稳定,相反,如果体系中胶体颗粒的表面Zeta电位较低,颗粒间的较弱的静电排斥力会容易导致颗粒间相互靠近,引起胶体体系出现聚集沉淀等不稳定现象[25-26]。
图6反映了PPI以及PPI与不同分子量葡聚糖共价聚合物水溶液的表面Zeta电位情况。由图6中可以看到,不同分子量葡聚糖与PPI反应形成的共价聚合物水溶液之间Zeta电位有较大差异,且与PPI的表面Zeta电位比较也有较明显的变化,Zeta电位的绝对值有明显的提升,其中PDC2提升幅度最大,达到了-23.4 mV,表明PDC2在水溶液体系中时,由于分子间存在静电作用力,体系会表现出更加稳定的状态。
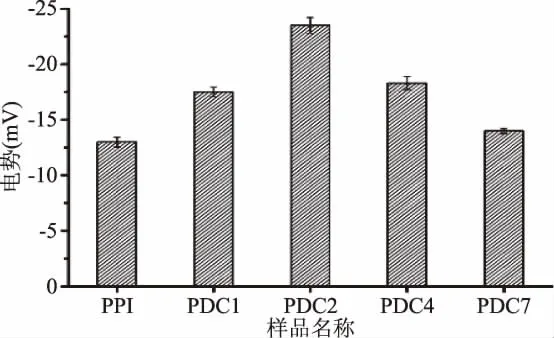
图6 不同共价聚合物和PPI的Zeta电位Fig.6 The Zeta potential of different covalent polymers and PPI
2.6 表面张力分析
表面张力一般是指液体与气体或其它不相容的液体以及固体相接触时,在接触面表现出的一种作用力,这种作用力可以让液体表面层表现出收缩趋势,尽可能减小其表面接触面积。表3是不同共价聚合物和PPI溶液的表面张力结果。
从表3中可以发现,发生接枝反应后的共价聚合溶液,其表面张力值及CMC值较PPI溶液都有提高,另外,可以发现当样品的表面吸附量Γ值最大时,同时会表现出最小的分子面积。从各样品的表面吸附量Γ值结果可以看出,接枝反应后的共价聚合物溶液的Γ值大于PPI,且表现出更小的分子面积,其中PDC2变化最为明显,表明接枝反应后共价聚合物分子在溶液中能够更好地分散开,在溶液界面上每个分子占有的面积更小,分子间作用更明显,因此,会表现出更好的分子内聚力,引起表面张力的增加。
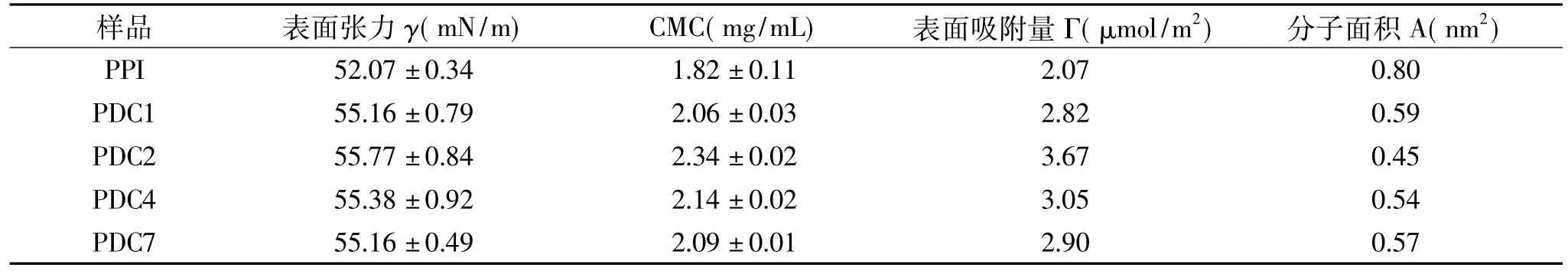
表3 不同共价聚合物和PPI溶液的表面张力和CMCTable 3 The surface tension and CMC of different covalent polymers and PPI solution
2.7 乳化特性分析
蛋白质的乳化性主要是通过乳化活性(EAI)和乳化稳定性(ESI)两个指标来评定的。乳化活性是指蛋白质在油水混合时形成的乳浊液体系中单位质量的蛋白质(g)能够稳定的油水界面的面积(m2);乳化稳定性是指蛋白质保持油水混合的乳浊液体系对外界环境的抗应变能力[27]。
对PPI以及不同分子量葡聚糖与PPI共价聚合物的乳化活性和乳化稳定性进行分析。结果如图7所示,可以发现不同分子量葡聚糖与PPI形成的共价聚合物,其乳化活性和乳化稳定性较PPI都有了明显的改善,但不同共价聚合物的改善程度有较大差异,其中PDC2改善最为明显,乳化活性达到了(92.2±1.13)m2/g,较PPI提高了319.1%,乳化稳定性达到了(80.1±0.78)min,较PPI提高了281.4%。结合前面的结构变化以及表面疏水性表面电势和表面张力的结果,可以说明PDC2乳化活性以及乳化稳定性的原因。
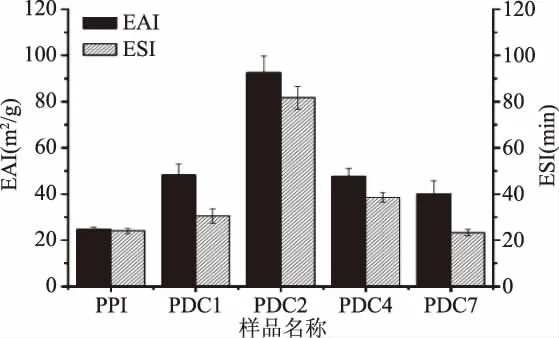
图7 不同共价聚合物和PPI的乳化活性和乳化稳定性Fig.7 The emulsion activity and emulsion stability of different covalent polymers and PPI
2.8 乳浊液流变特性分析
用数据处理软件对美拉德反应共价聚合物和PPI乳浊液的流变性质进行分析,利用Oswald-de Waele模型对流变数据进行拟合,得到相应的流变指数(n)、稠度系数(K)和决定系数R2,如表4所示。
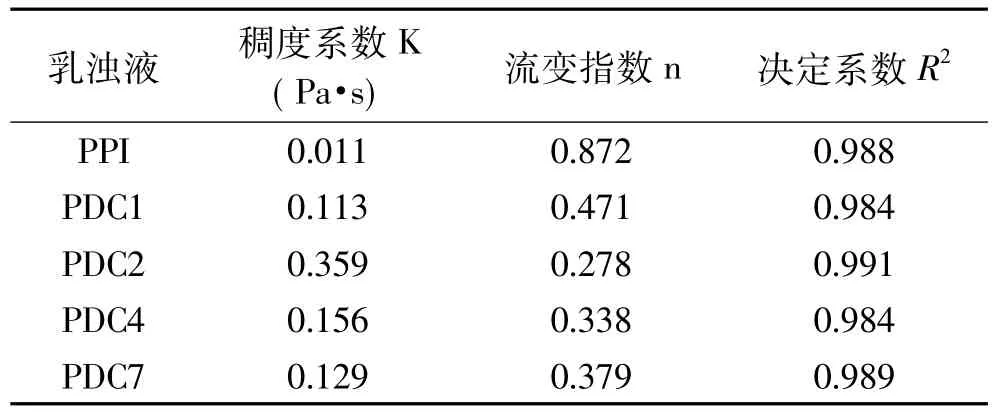
表4 不同共价聚合物和PPI乳浊液的稠度系数和流变指数Table 4 The consistency coefficient(K)and flow behavior index(n)of different covalent polymers and PPI emulsion
从表4中可以看出,各样品的流变数据用Oswald-de Waele模型拟合程度比较高(R2>0.98)。n值表示流变指数(通常n>1时,剪切变稠体系;n=1时,牛顿流体;n<1时,剪切稀化体系)。由表4中可以看出,各样品的n值都小于1,因此,不同共价聚合物和PPI乳浊液体系都为剪切稀化体系。另外,各共价聚合物乳浊液体系的稠度系数K值较PPI乳浊液体系明显增大,这主要是因为,一方面加入的葡聚糖自身具有增稠作用,引起乳浊液体系的稠度增加,另一方面接枝反应后生成了更加稳定的共价聚合物分子,其在乳浊液体系中分子间相互作用力增强,抗剪切作用力增大,引起稠度系数的增大[28]。从表4中各共价聚合物乳浊液的K值数据可以看出,PDC2乳浊液的K值相对较大,表明其抗剪切能力较好,乳浊液体系更加稳定,与前文乳浊液稳定性结果相符。
3 结论
接枝反应后的共价聚合物中,蛋白结构较PPI的三级结构和二级结构都发生了明显的变化,在二级结构中,α-螺旋结构减少,β-结构增多,空间结构变得更加松散,其中接枝度越高的共价聚合物PDC1、PDC2结构变化更加明显。接枝反应后的共价聚合物,其表面疏水性和Zeta电位发生了明显的改变,其中表现出更好乳化稳定性的共价聚合物PDC2溶液体系,表面疏水性和Zeta电位明显增大。接枝反应后的共价聚合物溶液表面张力明显增强,其中乳化性较好的共价聚合物PDC2能够表现出更好的表面吸附性,共价聚合物的乳浊液体系抗剪切能力更明显,体系更加稳定。不同分子量的葡聚糖与花生分离蛋白的接枝反应,能够改善花生分离蛋白的乳化性和乳化稳定性,且以分子量20 kDa的葡聚糖对花生分离蛋白性质改善最为明显。
