miR-23b通过Smad3信号通路抑制TGF-β1诱导的气道平滑肌细胞增殖的研究*
2019-01-25张炜黄林洁陈茗
张炜, 黄林洁, 陈茗
1深圳市南山区西丽人民医院呼吸内科(广东深圳 518055); 2中山大学孙逸仙纪念医院呼吸科(广东广州 510120)
哮喘发病的重要机制之一为气道平滑肌的异常增殖导致的气道重构,气道重塑的主要病理基础为气道管壁增厚,其中又以气道平滑肌细胞(ASMCs)增生,增殖最为重要,从而导致气道管腔狭窄和气道阻力增加[1-5]。转化生长因子-β1(TGF-β1)作为一个重要的调节因子,在以往的研究中,显示参与重症哮喘纤维化的过程[6-7]。在体外实验中表明TGF-β1还可以刺激平滑肌细胞的增殖和迁移[8-9]。miR-23b中已被报道参与许多细胞功能,包括细胞增殖,迁移和分化[10-14]。为了探讨miR-23b对TGF-β1诱导的小鼠ASMCs增殖、凋亡的影响及机制的研究,于2016年10月至2017年10月间进行了该项研究,现报告如下。
1 材料与方法
1.1 材料 成年6~8周龄BALB/c小鼠(雌性)从中山大学实验动物中心获得,合格证号:广东省实验动物检测证书号SCXK(粤)2011-0029。所有实验均按照中山大学动物实验的规定执行。DMEM细胞培养基、胎牛血清购自Hyclone公司;TGF-β1购自美国R&D 公司;CCK-8试剂购自碧云天公司;TRIzol、逆转录试剂盒、RT-PCR试剂盒均购自日本TaKaRa公司;引物设计与合成由上海生工公司完成;蛋白提取试剂盒购自北京普利莱公司;PVDF膜购自美国Millipore公司;Smad3抗体均购自美国Cell signaling technology公司;羊抗兔二抗购自Santa公司;其他试剂均系进口或国产分析纯。
1.2 方法
1.2.1 ASMCs的分离、培养及鉴定 采用组织块贴壁法培养ASMCs。取6~8周BALB/c小鼠,将BALB/c小鼠处死后,分离出气管及支气管,置于含0.1%胶原酶的Hanks′平衡盐溶液(HBSS)中。在解剖显微镜下将支气管外膜剥离干净,刮除内皮,将获得的单层在小烧杯中剪成1 mm3的小块后,置于含20%牛血清(FBS),100 U/mL青霉素和100 U/mL链霉素的DMEM基质中培养。待组织块周围细胞生长融合至80%后,采用α-肌动蛋白(α-actin)免疫细胞化学染色鉴定ASMCs。并对ASMCs对进行传代,并选择P4~6代ASMCs进行后续实验。
1.2.2 细胞转染及TGF-β1刺激 根据实验目的分为6组:(1)空白组(blank组);(2)空脂质体组(empty lipoblast组);(3)miR-23b mimic组;(4)mimic negative control组(mimic NC组);(5)miR-23b inhibitor组;(6)inhibitor negative control组(inhibitor NC组);转染前1 d,接种1×105细胞至含有1 mL完全培养基的12孔板中,使转染时的细胞融合度达到70%~80%。miR-23b mimic组、mimic NC组、miR-23b inhibitor组及inhibitor NC组细胞根据厂家说明书采用Lipofectamine 2000试剂对应转染入mimics、mimic NC、inhibitor、 inhibitor NC细胞。blank组及empty lipoblast组细胞分别加入等体积的PBS溶液及empty lipoblast。各组细胞转染24 h后采用TGF-β1(10 μg/L)处理。TGF-β1处理后进行以下实验。
1.2.3 miR-23b靶点预测及双荧光素酶活性分析 我们根据Sanger microRNA registry数据库获取小鼠miR-23b的序列信息。进一步通过生物信息学软件TargetScan (www.targetscan.org) 和microrna.org (http://www.microrna.org)对miR-23b的靶基因进行预测,发现Smad3是miR-23b的一个靶基因。
为了验证miR-23b对Smad3的表达抑制是直接作用还是间接通过其他信号通路调节,实验采用双荧光素酶报告实验进行分析。构建miR-23b与Smad3的3′UTR结合位点突变的报告基因,构建目的报告质粒,将其转染进AMSCs中,同时分别将miR-23b mimics、inhibitor及各自的载体转染入AMSCs内,用双荧光素酶报告实验检测靶基因的荧光强度。
1.2.4 CCK-8检测细胞增殖 收集对数期细胞种96孔板,每孔加入100 μL细胞悬液,各组依次加入对应的药物。96孔板置于5% CO2、37℃孵育24、48、72 h。进而每孔加入10 μL CCK-8溶液继续培养1~4 h。用酶标仪在450 nm波长处测每孔的光密度值(OD)。
1.2.5 流式细胞仪检测细胞凋亡的分析 用ddH2O将5×Binding Buffer稀释为1×Binding Buffer,每0.5 mL 1×Binding Buffer加入5 μL Annexin V和10 μL PI,配制成Annexin V/PI染色工作液。吸去培养板中的培养基,每孔用2 mL PBS轻轻润洗培养板内细胞,吸去PBS,每孔加入0.5 mL 0.25%胰酶,孵育,在显微镜下观察,当胞质回缩,细胞之间不再连接成片,吸去胰酶,加入2 mL PBS,吹打,制成单细胞悬液,将其移至流式管,1 000 r/min离心5 min,弃去上清,加入200 μL Annexin V/PI染色工作液,重悬细胞,轻轻吹打,避光孵育15 min,上机检测。
1.2.6 RT-PCR检测miR-23b、Smad3的表达 RNA提取和实时定量PCR:利用Trizol试剂提取组织总RNA(包括miRNA)。500 ng RNA用来进行反转录反应,在反转录酶的作用下利用miR-23b的特异性反转录引物合成cDNA。实时定量PCR反应按照2×SYBR Green Master Mix的说明要求进行,反应体系为:cDNA 1 μL,上下游引物各1 μL,2×SYBR Green Mix 10 μL,无菌蒸馏水7 μL。在Bio—Rad实时定量PCR仪上进行。反应条件是:95℃预变性30 s,95℃变性5 s,60℃退火30 s,进行40个循环。本实验所用引物如表1所示,并以U6 RNA作为内参检测组织中miR-23b、Smad3的表达水平。

表1 RT-PCR反应引物
1.2.7 Western blot检测Smad3表达 用BSA法测蛋白浓度。SDS聚丙烯酰胺凝胶电泳分离蛋白质,转移至硝酸纤维膜(PVDF膜),加入兔抗鼠Smad3抗体浸泡滤膜,4℃过夜,洗涤后加入碱磷酶标记的羊抗兔IgG,洗膜后ECL化学发光试剂检测。定量分析采用分子生物学图像分析系统。

2 结果
2.1 ASMCs的鉴定 从BALB/c小鼠中分离培养的原代AMSCs具有典型的“峰谷”生长状态(图1-A)。AMSCs经α-actin免疫细胞化学染色后发现,大部分细胞α-actin染色阳性(图1-B)。证明本实验所分离培养的细胞为ASMCs。
2.2 转染后miR-23b在各组ASMCs的表达 如图2所示,转染miR-23b mimics后,ASMCs miR-23b的表达显著上升,较未转染miR-23b mimics组为14 差异倍数(fold change),而转染miR-23b inhibitor后,ASMCs miR-23b的表达显著下降,约是blank组的1/10差异倍数(fold change)。

A:倒置显微镜下ASMCs的形态(×100);B:α-SMA免疫细胞化学染色(×100)
图1 ASMCs的鉴定

A:扩增分析;B:miR-23b的表达量,miR-23b mimic 组及miR-23b inhibitor 组与其各自的对照组相比*P<0.01
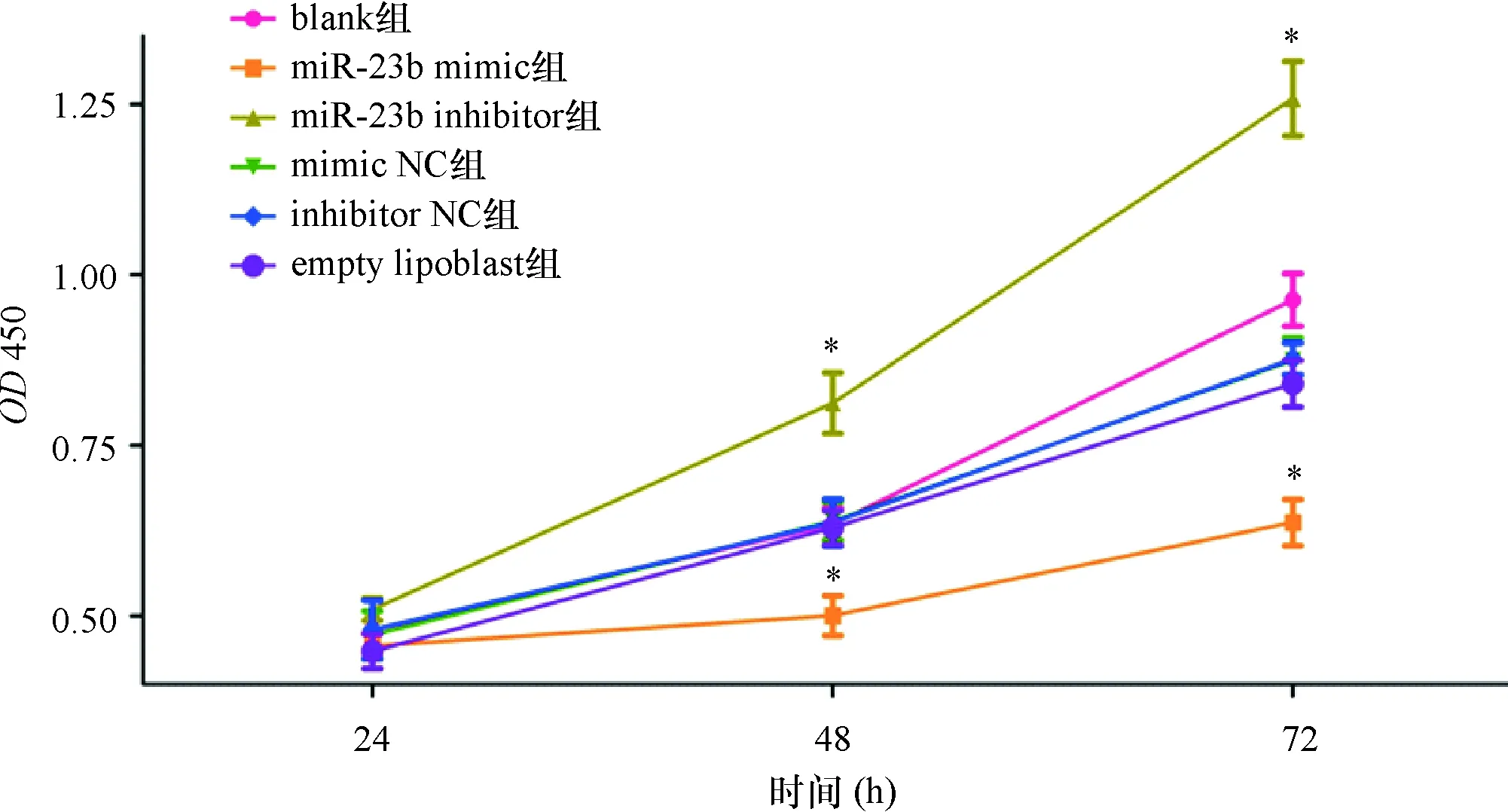
2.3 miR-23b抑制TGF-β1诱导的气道平滑肌细胞增殖 CCK-8结果显示(图3),blank组OD值随时间延长而明显升高(P<0.05)。其中miR-23b mimic转染到AMSCs后,miR-23b mimic组ASMC在48 h的OD值为0.49±0.03,显著低于blank组的0.63±0.04、empty lipoblast组的0.63±0.03、mimic NC组的0.63±0.04、inhibitor NC组的0.64±0.04和miR-23b inhibitor组的0.81±0.07;而miR-23b mimic组ASMC在72 h的OD值为0.61±0.03,显著低于blank组的0.89±0.05、empty lipoblast组的0.83±0.03、mimic NC组的0.85±0.04、inhibitor NC组的0.85±0.03和miR-23b inhibitor组的1.23±0.09(P<0.05)。
2.4 miR-23b促进TGF-β1诱导的ASMCs凋亡 如图4所示,经不同处理后的ASMCs细胞其凋亡率如表2所示,其中miR-23b mimics组的早期凋亡、晚期凋亡和总凋亡率均显著高于blank组、empty lipoblast组、mimic NC组、inhibitor NC组和miR-23b inhibitor组(P<0.05)。而miR-23b inhibitor组的早期凋亡、晚期凋亡和总凋亡率均显著低于blank组、empty lipoblast组、mimic NC组、inhibitor NC组和miR-23b mimic组(P<0.05)。见表2。
miR-23b mimic组及miR-23b inhibitor 组与其各自的对照组相比*P<0.01

图4 miR-23b促进ASMCs凋亡


组别早期凋亡率晚期凋亡率总凋亡率空白组12.6±0.5∗#7.5±0.9∗#20.2±1.6∗#空脂质体组13.1±0.9∗#6.3±1.1∗#19.4±1.1∗#miR-23b mimic组23.5±1.4#8.7±1.6#32.3±1.4#mimic NC组13.4±1.3∗#5.8±0.9∗#19.2±1.7∗#miR-23b inhibitor组5.5±1.2∗4.7±0.9∗10.3±2.0∗inhibitor NC组13.5±1.1∗#5.2±0.7∗#18.7±1.8∗#
*与miR-23b mimic组比较P<0.05;#与miR-23b inhibitor组比较P<0.05
2.5 miR-23b的靶基因Smad3 AMSCs在转染入Smad3 wt后,在miR-23b mimics作用下,其中miR-23b mimic组的荧光素酶活性为(2.5±0.4)%,blank组为(4.1±0.2)%、NC组为(4.2±0.05)%、inhibitor NC组为(4.5±0.1)%、miR-23b inhibitor组为(6.1±0.5)%,其中miR-23b mimic组的荧光素酶活性显著低于blank组、mimic NC组、inhibitor NC组和miR-23b inhibitor组,差异均有统计学意义(P<0.05);而在AMSCs在转染入Smad3 mutant后,miR-23b mimics和inhibitor作用荧光素酶活性约为(3.9±0.06)%和(4.3±0.2)%,与blank组(4.3±0.1)%相比差异无统计学意义(P>0.05)。见图5。
2.6 miR-23b抑制Smad3 mRNA的表达 如图6所示:在TGF-β1刺激48 h后,blank组Smad3 mRNA明显升高(P<0.05)。miR-23b mimic转染到ASMCs后,miR-23b mimic组的Smad3 mRNA表达为0.56±0.02,blank组为0.98±0.11、inhibitor组为2.25±0.6,经统计分析,miR-23b mimic组的Smad3 mRNA表达显著低于blank组(P<0.05),而miR-23b inhibitor组Smad3 mRNA值显著高于blank组(P<0.05)。

图6 miR-23b对Smad3在AMSCs中mRNA表达的影响
2.7 miR-23b抑制Smad3蛋白的表达 如图7所示,在TGF-β1刺激48 h后,blank组Smad3表达显著。MiR-23b mimic转染到ASMCs后,miR-23b mimic组的Smad3 蛋白表达为0.15±0.03,blank组为1.02±0.01、miR-23b inhibitor组为1.59±0.17,经统计分析,miR-23b mimic组的Smad3 蛋白表达显著低于blank组(P<0.05),而miR-23b inhibitor组Smad3 mRNA值显著高于blank组(P<0.05)。

图7 miR-23b对Smad3在AMSCs中蛋白表达的影响
3 讨论
在防治哮喘气道重塑方面,目前尚未找到有效的预防或逆转气道重塑的措施。现有的治疗方案包括糖皮质激素、支气管扩张剂、白三烯调节剂等仍不能满足部分哮喘患者的治疗需求,每年死于哮喘病的患者有25万之多。因此,进一步研究哮喘气道重塑的发病机制,阐明起关键作用的蛋白分子及其调控方式,为确立新的治疗靶点,从而进一步达到有效防治哮喘的目的,具有重要的意义。
miR-23b是一个多功能微小RNA(miRNA),参与调节多种信号通路。最近大量研究显示其作用涉及免疫、增殖、分化、凋亡、细胞黏附等各个方面,而且关于其功能及作用机制的研究仍在不断扩展[15]。意大利布雷西亚大学Salvi等[16]研究显示,正常人类真皮成纤维细胞AB2细胞株中高水平表达miR-23b,而尿激酶型纤溶酶原激活物(u-PA)和肝细胞生长因子受体(c-met)存在生理性下调;当应用抗转染技术干扰内源性miR-23b表达时,正常AB2细胞株中内源性uPA和c-met含量增加。另一方面,发现肝癌细胞中u-PA在基因转录和蛋白翻译水平上均为高表达,而miR-23b分子表达水平很低;当肝癌细胞株SKHep1C3转染miR-23b后,尽管相应信使RNAs (mRNAs)含量稳定,内源性u-PA和c-met均被下调。由于u-PA mRNA和c-met mRNA表达水平与肝细胞肝癌紧密相关,同时u-PA和c-met均在肿瘤细胞的增殖、迁移中发挥作用,研究者认为miR-23b可能通过转录后水平下调u-PA和c-met途径来减少肝癌细胞迁移[16]。研究发现miR-23b在人的结直肠癌样本中表达明显下降,miR-23b通过靶向抑制FZD7、MAP3k1等多种信号分子,在包括肿瘤生长、迁移及血管生成等肿瘤迁移的多个过程中发挥了重要的负调控作用[17]。研究组通过分子、细胞生物学、小鼠疾病模型和临床样本分析等多种研究手段,通过高通量microRNA芯片筛选发现了miR-23b是自身免疫病患者和自身免疫病小鼠模型的炎症病理组织中共同下调的microRNA[18]。为探讨miR-23b对TGF-β1诱导的小鼠气道平滑肌细胞增殖,凋亡的影响及机制的研究,本研究合成miR-23b的类似物和抑制剂,转染入气道平滑肌细胞,明确其对ASMCs的影响。结果显示miR-23b的过表达显著抑制TGF-β1诱导平滑肌细胞增殖,促进细胞凋亡。
为了进一步研究的miR-23b的具体作用,以确定的miR-23b的靶基因。miR-23b靶向Smad3蛋白是由TargetScan的组合(www.targetscan.org)和microrna.org(http://www.microrna.org)预测。此外,最近的研究已经表明的miR-23b中的调节TGF-β1通过靶向Smad蛋白(Smad3蛋白,Smad4和Smad5)信号担当分子开关[19-20]。因此,我们推测的miR-23b可以在ASMCs的终止通过靶向Smad3的参与。本研究中,发现miR-23b直接调节Smad3在ASMCs的表达。本研究的数据表明,靶向Smad3蛋白是由其中的miR-23b中控制许多细胞内转导途径的活性的机制之一。这些研究结果表明的miR-23b中促进ASMCs的由激活TGF-β1信号传导途径的生长和迁移。
为确立miR-23b作为哮喘治疗的新靶标提供更充分的科学依据,由于本研究仅在细胞水平探讨了miR-23b对TGF-β1/Smad3信号通路在ASMCs增殖凋亡的影响,需进一步在动物体内加以验证。综上所述,本研究证实了miR-23b对TGF-β1/Smad3信号通路及ASMCs增殖凋亡的影响,从分子水平进一步探讨支气管哮喘气道重塑的发病机制。
