ALK阳性肺腺癌脑转移个例诊治分析
2019-01-25何冬云王凤楠邓秋华黄丽燕杨海虹
何冬云, 王凤楠, 邓秋华, 黄丽燕, 杨海虹△
广州医科大学附属第一医院、广州呼吸健康研究院 1胸部肿瘤科, 2转化医学中心(广东广州 510120)
间变性淋巴瘤激酶(ALK)融合基因阳性肺癌在非小细胞肺癌(NSCLC)中所占的比例为2%~7%[1],脑转移是最常见部位之一,初治患者发生率约30%。目前ALK融合基因阳性NSCLC的标准治疗是第1代ALK酪氨酸激酶抑制剂(TKI)克唑替尼,但患者迟早会出现耐药。60%的克唑替尼耐药患者会出现脑转移,获得性耐药机制涉及ALK耐药基因突变、ALK基因扩增和旁路信号传导途径激活等,如合并继发性干细胞生长因子受体(KIT)基因扩增[2-3]。本文报道KIT/PDGFRA基因扩增导致1例ALK阳性肺腺癌脑转移患者克唑替尼原发耐药,并对临床诊治进行分析。
1 病例资料
患者,男,29岁,因被发现左上肺肿物,于2015年11月20日入院,入院后行纤维支气管镜肺组织活检,病理结果诊断肺黏液腺癌;经免疫组化染色(Roche,VENTANA)证实为ALK融合蛋白阳性。初步诊断:左肺腺癌T4N3M1Ⅳ期(骨、肝、脑、肾上腺、双肺)EGFR阴性、ALK(+)。头颅MRI显示双侧额叶、顶叶及右侧枕叶多发转移瘤(图1-A)。患者口服克唑替尼1个月后,影像学检查示颅外病灶均较前缩小,但颅内转移瘤无明显变化,疗效评估稳定(SD)。后行脑转移瘤立体定向放疗治疗(X刀治疗),中心剂量为16 Gy,放疗期间同时继续克唑替尼治疗。放疗后1个月,复查颅外病灶评估部分缓解(PR),但头颅MRI显示颅内转移瘤较前增大,颅内病灶评估进展(PD)(图1-B)。之后患者出现右侧身体运动障碍和抽搐等表现,再行MRI检查显示“颅内转移瘤继续增大,合并出血”(图2-A)。后于神经外科行左侧额叶转移瘤切除术,术后病理结果示“转移性黏液腺癌”,采用第2代基因测序(NGS)方法进行脑转移瘤组织基因检测,结果示ALK融合基因阴性,KIT(CN=8.4)和PDGFRA(CN=8.9)基因扩增,术后2周复查MRI示“左侧额叶转移瘤切除术后改变,余颅内转移瘤继续增大增多,并合并出血”(图2-B)。术后给予克唑替尼联合KIT/PDGFRA-TKI(舒尼替尼)治疗,2周后患者症状明显好转,恢复正常活动。影像学检查示颅外病变SD和颅内转移瘤较联合用药前明显缩小(图2-C),疗效评估PR。
2个月后影像学检查示肺部原发肿瘤进展,颅内病灶稳定。后肺部进展肿瘤行纤维支气管镜肺活检术,术后病理示“肺黏液腺癌”,NGS组织基因检测结果仅有高丰度的EML4-ALK融合基因。后患者改口服第2代ALK-TKI色瑞替尼(450 mg/次,1次/d)联合舒尼替尼(37.5 mg/次,1次/d),治疗3个月后,颅外病变评估PR,颅内病变评估SD。但由于出现严重腹泻及厌食,剂量减少至色瑞替尼450 mg/次,隔天1次,舒尼替尼37.5 mg/次,隔天1次;症状缓解。后患者每3个月行影像学检查,临床持续缓解19个月,总生存时间27个月(末次随访时间2018年3月)。表1为患者治疗疗效评估表。
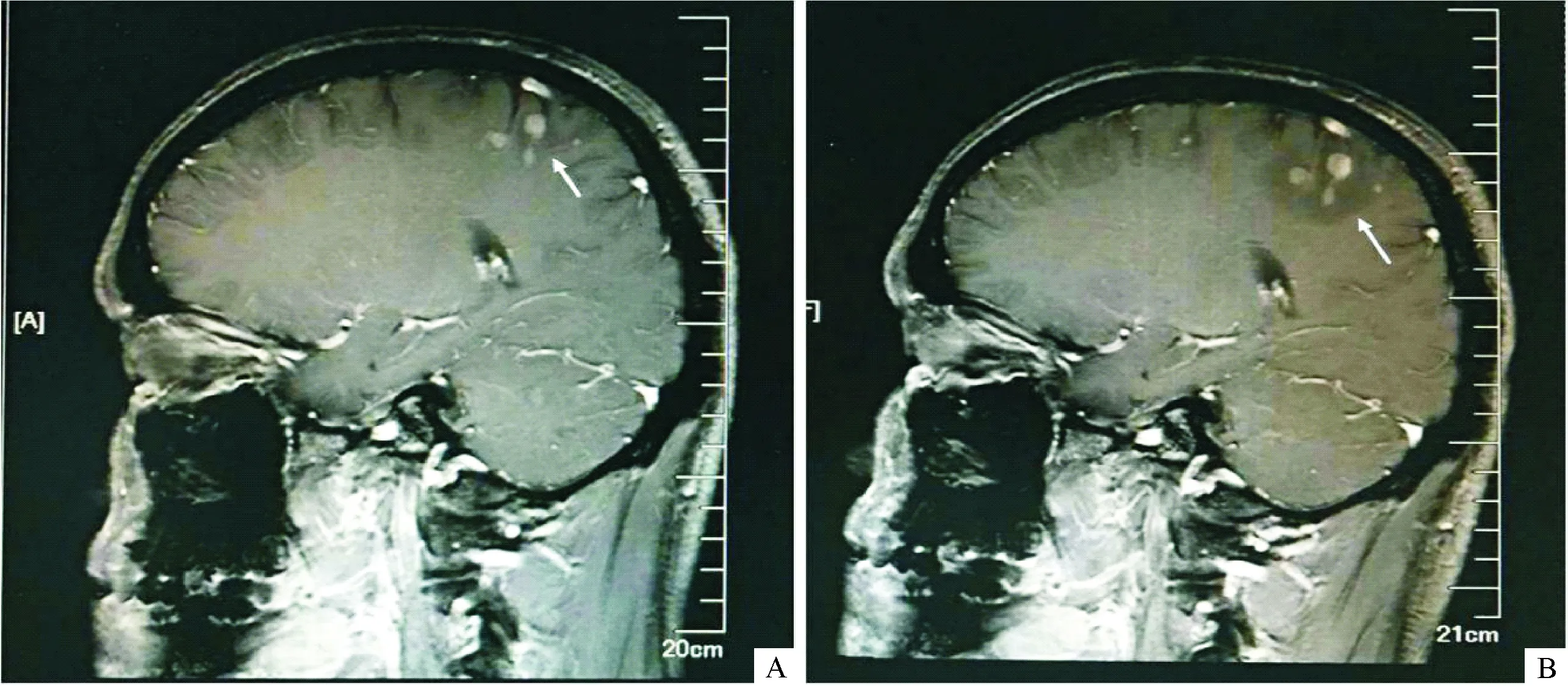
A:治疗前;B:治疗后;箭头:脑转移瘤病灶
图1患者X刀治疗前后头颅MRI改变显像

A:手术前颅内转移瘤继续增大,并合并出血;B:行左侧额叶转移瘤切除术后颅内转移瘤继续增大增多,并合并出血;C:克唑替尼联合KIT/PDGFRA-TKI治疗2周后,颅内转移瘤较用药前明显缩小;箭头:脑转移瘤病灶
2 讨论
2.1 流行病学 肺癌是全球发病率增长最快和病死率最高的恶性肿瘤,5年生存率低于15%,其中NSCLC占肺癌的80%~85%,约70%患者确诊时已为晚期。2007年ALK融合基因的发现是NSCLC靶向治疗的一个里程碑。在NSCLC患者中,有3%~5%的病例为ALK基因重排型,其中EML4-ALK融合基因最常见[1, 4]。克唑替尼是首个获得批准的ALK第1代ALK-TKI,用于ALK阳性晚期NSCLC一线治疗[5-8]。目前全球已获批一线适应证的还有第2代ALK-TKI包括色瑞替尼、艾乐替尼和Brigatinib。第2代和第1代TKI最大的区别在于对脑转移瘤控制的优劣性,患者口服克唑替尼治疗期间,多达60%的患者会发生脑转移[9-10]。其中部分患者表现为颅外病灶控制良好,而出现颅内唯一病灶进展。克唑替尼耐药时脑转移瘤高发可能原因:克唑替尼药物颅内渗透性差;肿瘤的异质性;旁路途径激活等机制[11-12]。
2.2 分子病理 肺腺癌标本中,组织学形态特征为低分化、腺泡/印戒细胞的黏液型或实性腺癌[13],ALK融合蛋白检出率高达30%~40%。目前我国认证ALK融合基因检测方法主要有3种:荧光原位杂交(FISH)、免疫组织化学(IHC)、逆转录酶-PCR(RT-PCR)。NGS作为一种新的基因检测法,近几年逐渐走进临床。除检测所有ALK融合体外,NGS巨大优势是筛选新型ALK融合基因以及其他肺癌相关基因突变、融合和扩增,例如由于未知旁路途径激活或肿瘤异质性导致ALK-TKI耐药[14],由于需要专业知识来分析和解析测序结果且测序需要大量DNA,并且由于各个平台之间的差异,目前没有统一标准,使NGS运用受到一定程度的限制。
KIT基因扩增旁路激活可以导致克唑替尼继发性耐药,KIT基因和血小板衍生因子受体A(PDGFRA)都位于染色体4q12同一位置,因此两者经常同时发生扩增。本例患者第1次耐药时颅内转移瘤组织中只有KIT/PDGFR基因扩增而没有ALK融合基因表达;第2次耐药时颅外原发肺肿瘤进展组织只有ALK融合基因表达而没有KIT/PDGFR基因扩增。在ALK阳性的原发性肺癌和ALK阴性的转移瘤中曾报道过ALK重排导致的肿瘤内异质性[15],该患者可能存在肿瘤内异质性伴随KIT/PDGFRA基因扩增旁路途径激活,因此该例患者克唑替尼耐药原发性耐药时因为出现KIT/PDGFRA基因扩增驱动的脑转移瘤。此类患者诊断极其困难,相对传统的基因检测方法,NGS基因检测法更具优势,并且行多部位组织病理基因检测,以明确分子病理。
在淋巴瘤中,ALK融合蛋白可通过激活JUN通路和转录因子Jun B(JUNB)上调PDGFR的表达,但在NSCLC中无相似的病例报道[16]。ALK阳性肺腺癌患者可能伴有初发KIT/PDGFRA基因扩增,这类似结肠癌患者有微卫星不稳定性(MSI)或染色体不稳定(CIN)途径的激活[17]。
染色体片段4q12的局部复发性扩增与原癌基因PDGFRA和KIT重叠,导致3%~7%肺腺癌患者同时出现PDGFRA和KIT扩增[18]。但目前尚无临床数据支持PDGFRA或KIT基因扩增是NSCLC患者致癌驱动基因。在多形性胶质母细胞瘤(GBM)和其他恶性脑肿瘤中,PDGF作为重要的肿瘤生长致癌驱动因子,并且这些肿瘤中染色体4q12区域常有PDGFRA和KIT基因扩增[19]。因此,我们推测KIT或PDGFRA基因扩增可能是极少部分ALK阳性肺腺癌患者脑转移的致癌驱动突变基因。
在ALK阳性肺腺癌脑转移瘤组织中检测到KIT/PDGFRA基因扩增,我们首次报道KIT/PDGFRA基因扩增可能是一种罕见的ALK阳性肺癌脑转移瘤驱动基因突变,并对克唑替尼原发耐药KIT/PDGFRA基因扩增。但本例中我们无法确定KIT和PDGFRA哪个是关键基因突变。
2.3 临床表现ALK融合基因阳性多见于年轻、无/轻度吸烟史的肺腺癌患者[20]。这类患者口服克唑替尼易出现早期耐药,颅内进展最常见。值得注意的是,少数患着出现囊性脑转移瘤(CBM)。头颅MRI中观察到脑转移呈双侧多发,T2高信号,T1低信号,大多数病灶无血管源性水肿或增强,但通常在较大的病灶外周观察到轻微的线性增强(囊性变),可能与丰富的黏液蛋白形成相关[21-24]。临床上,尽管在接受克唑替尼时全身进展,即使没有CNS指导的治疗,CBM常无症状,但随着时间的推移,CBM倾向于缓慢进展[22],易合并脑出血。该患者克唑替尼耐药时,患者出现运动障碍和抽搐等中枢神经系统症状且头颅MRI示CBM增大合并瘤内出血,并且放疗治疗效果不好。此类患者我们要高度注意肿瘤异质性的问题,因此手术切除可以达到迅速缓解症状和病理组织活检明确基因状态,指导下一步治疗。值得注意的是,临床上既往接受过或者仍在接受克唑替尼治疗的ALK阳性NSCLC患者,出现中枢神经系统症状并发症时,患者有可能出现软脑膜转移[25]。该患者在口服克唑替尼联合KIT和PDGFRA抑制剂后症状明显好转。
2.4ALK阳性NSCLC脑转移治疗ALK阳性NSCLC患者,口服克唑替尼可获得良好疗效,中位无疾病进展生存(PFS)时间为10.9个月,甚至长达13.6个月[26]。尽管口服克唑替尼明显优于化疗,但约30%患者在口服克唑替尼3~6个月内出现颅内病变进展,导致克唑替尼早期耐药。一项回顾性研究分析了克唑替尼治疗ALK阳性NSCLC脑转移患者的局限性[27]。克唑替尼脑血药物浓度之比仅有0.2%,在病程初期应该口服克唑替尼联合SRS放疗治疗可取得良好疗效。初诊ALK阳性肺腺癌脑转移患者也可以选择第2代或者第3代ALK-TKI(色瑞替尼、艾乐替尼、Brigatinib、劳拉替尼)靶向治疗,脑转移瘤控制良好甚至可以降低脑转瘤的发生率。对于重症或者复发脑转移瘤,首选放疗治疗。
本例患者出现2次克唑替尼耐药。第1次耐药时,行脑转移瘤X刀治疗后颅内PD,脑转移瘤术后NGS检测示KIT/PDGFRA基因扩增,后予克唑替尼联合舒尼替尼治疗,患者症状明显改善。临床上提示伴有KIT/PDGFRA基因扩增的肺腺癌脑转移患者可能对SRS放疗治疗不敏感甚至抵抗。耐药后转移部位局部治疗后继续使用克唑替尼患者能否继续获益?其他药物或联合方案能不能有效控制颅内疾病进展?Otterson等发现,患者在疾病进展后,继续口服克唑替尼治疗后病情仍可缓解。一项回顾性分析发现,30%伴有孤立脑转移且口服克唑替尼疗效欠佳的ALK阳性NSCLC患者,可在放疗后继续口服克唑替尼可再获至少4个月以上的无疾病进展期[28]。因此,对于这类患者可继续服用ALK-TKI。第2次耐药时,肺部增大肿瘤再次活检,NGS组织基因检测结果仅有高丰度的EML4-ALK融合基因,改口服第2代ALK-TKI色瑞替尼联合舒尼替尼,该患者长期生存获益。
目前上市的第2代ALK-TKI,虽然可以克服一代TKI部分早期耐药问题,但部分患者仍出现获得性耐药。克唑替尼耐药后如何选择其他TKI?由于耐药后仍依赖ALK通路,应进行重复活检、精准定位,以制定个体化治疗方案。由于肿瘤异质性,ALK激酶区可能同时发生多种突变,也可能同时发生拷贝数扩增和点突变,单个小块原发灶内就可能存在多种突变,提示临床上最好采用即时多点标本ALK基因检测结果来指导治疗。现3种新型ALK-TKIs 正处于临床试验阶段:Brigatinib、Ensartinib 与 Lorlatinib,初步研究结果表明前景良好,可对抗二次耐药突变。
总之,初诊无症状NSCLC脑转移患者,首选克唑替尼联合(或不联合)立体定向放射外科(SRS)放疗。初诊有症状或后期出现脑转移患者,可在克唑替尼基础上选择局部治疗(手术或SRS放疗);也可以一线选择二代ALK-TKI(色瑞替尼和艾乐替尼等)治疗。而对于早期颅内出现唯一进展病灶,我们应该积极手术活检,明确分子病理状态,指导下一步治疗。
