外周血淋巴细胞G显带高分辨染色体制片效果量化评价
2019-01-25胡亮罗小金丛潇怡裴元元魏凤香
胡亮,罗小金,丛潇怡,裴元元,魏凤香
染色体G显带核型分析作为一种经典的细胞遗传学检测技术,是染色体病诊断的金标准[1-2],在产前诊断、辅助生殖等领域具有重要意义。染色体G显带核型制片方法根据获得条带的数量是否达到550条带可分为中低分辨染色体制片法和高分辨染色体制片法。高分辨染色体与常规中低分辨染色体相比,能够提供更多的染色体结构信息,有着重要的临床应用价值。虽然高分辨染色体制片技术已较为成熟,并应用于临床,但是对高分辨染色体制片效果进行质量评价的方法较少。本研究建立了一种染色体制片条带水平量化评价方法,并对高分辨染色体制片方法和常规中低分辨染色体制片法的制片效果进行比较,介绍如下。
1 材料与方法
1.1 主要试剂 培养基:外周血淋巴细胞培养基:5 mL/瓶,胎牛血清浓度10%(一生骏)。5-氟尿嘧啶:10-5mol/L(Sigma),尿嘧啶核苷:10-5mol/L(sigma),胸腺嘧啶:10-3mol/L(Sigma),溴化乙锭(EB):1 g/L(sigma);秋水仙素:40 ng/μL(Aladdin)。
1.2 样本采集、接种及培养 随机选取2016年9月—2017年3月因不良孕史就诊并进行染色体核型分析的受检者233例,其中男99例,女134例,年龄21~45岁,平均(31.2+3.2)岁。抽取其3 mL肘正中静脉血,并用1 mL注射器接种至2瓶5 mL培养基,每瓶接种0.4 mL,于37℃培养箱培养72 h。
1.3 细胞周期同步化、收获及显带 培养72 h后,每例受检者的2瓶培养细胞分别采用中低分辨制片方法和高分辨制片方法进行收获、显带。中低分辨方法:加入秋水仙素(终浓度1.8×10-4g/L),50 min后收获并显带。高分辨方法:加入5-氟尿嘧啶(终浓度1.5×10-7mol/L)和尿嘧啶核苷(终浓度1.5×10-7mol/L),继续培养16 h后,加入胸腺嘧啶(终浓度1.5×10-6mol/L)。继续培养4 h后,加入溴化乙锭(终浓度6×10-3g/L)。45 min后,加入秋水仙素(终浓度2.4×10-4g/L)。40 min后收获细胞。
收获及显带流程如下。低渗:将培养物转移至15 mL离心管,2 000 r/min离心5 min,弃上清,加37℃预温的0.075 mol/L KCl 8 mL,吹打混匀后37 ℃水浴25 min;预固定:加入1 mL 3∶1甲醇冰醋酸固定液,吹打混匀,37℃水浴10 min,2 000 r/min离心5 min;固定:加入8 mL 3∶1甲醇冰醋酸固定液,吹打混匀,2 000 r/min离心5 min,本步骤重复3次;滴片:40 cm高度滴片,每张玻片滴2滴,70℃干烤2 h。显带:将25 mg胰酶粉末溶于37℃预温的50 mL生理盐水,并加入0.5 mL 3%tris溶液。胰酶消化10~20 s,吉姆萨染色1.5 min。上述消化及显带条件根据实际效果随时调整。
1.4 核型分析 利用全自动染色体核型分析工作站(Leica GS120)采集各样本分裂相,每例样本采集两种方法所制的玻片各3张,每张玻片随机采集60个分裂相,共计180个分裂相。若分裂相数量不足则增加采集玻片数量,直至采集到的分裂相总数达到180个。选取各样本180个分裂相中形态清晰,长度适中,分散适度的3个分裂相进行核型分析。核型分析标准参照《ISCN2016》。
1.5 质量评价条带的选取 参照《ISCN2016》Fig.5所示的染色体核型示意图选取15条质评条带。质评条带需满足3个条件:①均为G显带着色较深的深带,便于辨认;②质评条带在某一条带分辨水平下可见,而在较低一级的条带分辨水平下不可见,例如质评条带1p31.3在550条带水平下可见,在400条带水平下不可见;③质评条带应距离着丝粒、次缢痕等多态区较远,避免多态影响条带观察。质评条带的可见最低分辨以550条带水平为主,少量选取400及700条带水平的条带。
1.6 质量评价评分及统计学方法 对每例样本的两种方法获得的3个核型图进行质量评价。在一个核型图中,以在任意一条同源染色体中能否清晰可见15个质评条带为标准进行评分,对于每一条质评条带,可见计1分,不可见计0分。合计3个核型图的总分,满分为45分,评分越高表明该样本制片质量越高。对同一样本的核型分析及质量评价均由一人独立完成。所得数据用R-3.4.4进行配对样本双侧t检验,P<0.05为差异有统计学意义。
2 结果
2.1 质量评价条带的选取 15条质评条带见表1。
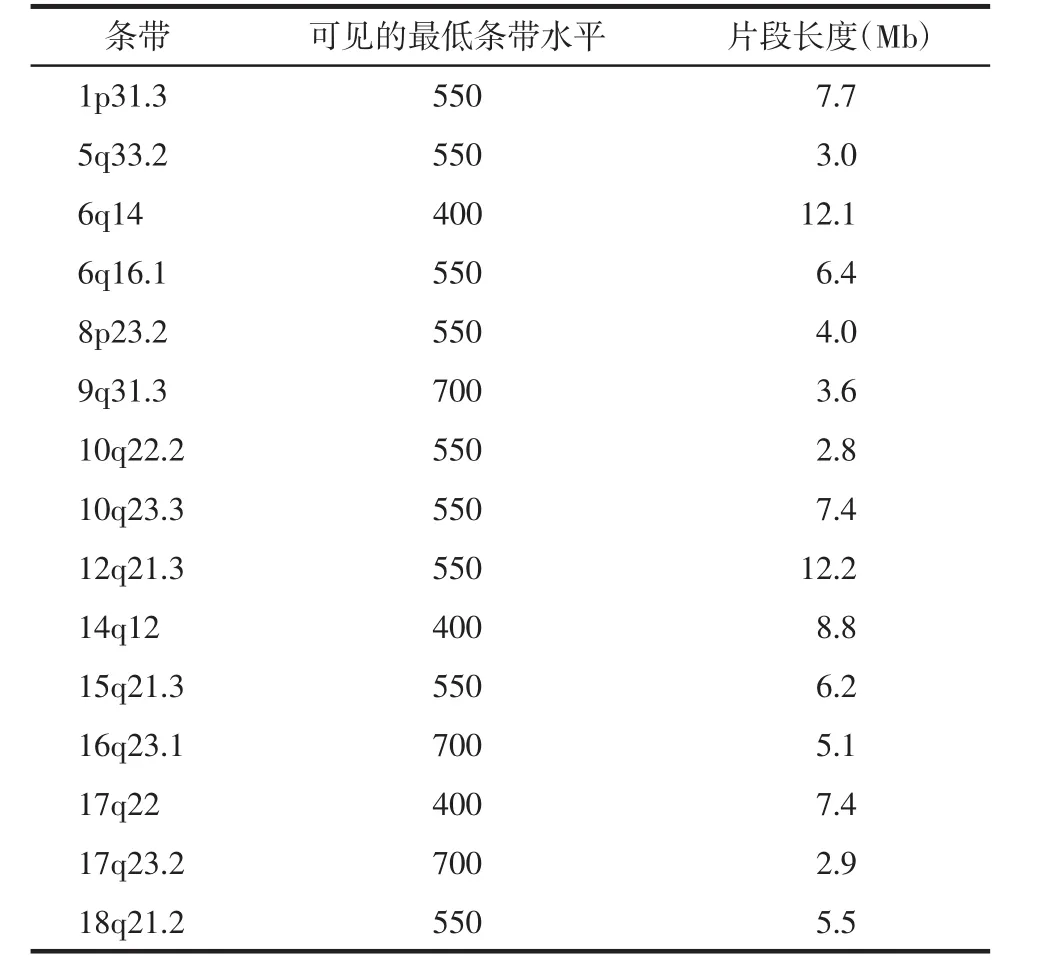
表1 染色体质量评价条带表
2.2 不同制片方法制片效果的质量评价 利用15个质评条带对两种方法所制的染色体核型进行评分,结果见图1A。中低分辨方法制备的核型质评分数最低为4分,最高29分,平均为(17.82±4.79)分,高分辨方法制备的核型质评分数最低为6分,最高44分,平均为(26.84±7.70)分。高分辨方法制片质量评分高于中低分辨方法,差异有统计学意义(t=14.161,P=0.000)。各质评条带在两组染色体核型中的可见核型数见图1B。
3 讨论
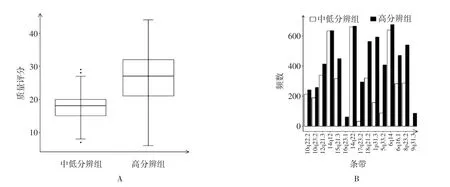
图1 不同制片方法效果质量评分图
染色体G显带核型分析是目前临床广泛应用的形态学遗传检测技术,在现阶段尚无法被染色体微阵列分析、二代测序等分子遗传学方法完全取代[1]。其中高分辨染色体核型分析由于能够提供细致的带纹信息,在部分平衡性染色体结构异常的诊断中仍具有重要意义[2]。传统的染色体制片过程中对染色体制片效果的评价大多集中于细胞分裂指数和染色体分散程度[3],主要依赖操作者个人经验,较为主观,且对带纹数量的评价不够细致,不利于700~850条带水平下的染色体制片质量评价。为此本研究中建立了一套量化的染色体制片质量评价方法。该方法利用位于12个染色体上的15条深带作为质量评价条带并进行评分。通过上述评分,本研究获得了染色体制片质量的量化评价方法,该方法具有相对客观、精细,不同批次、操作者、实验室间易于比较的优点,能够更好地对染色体制片环节进行质量控制以及技术优化。
本研究结果显示,高分辨方法的评分高于中低分辨率方法。高分辨方法的核型带纹水平显著高于中低分辨方法。高分辨方法中少量样本的评分较低,接近或低于中低分辨方法的评分均值,这是由于高分辨染色体制片的条件要求较苛刻,部分样本收获效果欠佳所致。
本研究中质评条带的选取兼顾了评价方法的便捷性与客观性。选取的条带均为深带,且距多态区域较远,易于观察。在15个质评条带中,400条带水平可见的条带3个,550条带水平可见的条带9个,700条带水平可见的条带3个。400条带水平的质评条带6q14、14q12、17q22在两组大部分核型中均可见,且可见的核型数两组间均无差异;550条带水平的质评条带在两组间的可见核型数有差异;700条带水平的质评条带9q31.3、16q23.1、17q23.2主要仅见于高分辨组,提示核型条带数达到700~850水平。本研究中质评条带的评价目标为目前临床上高分辨染色体较为常用的550~700条带水平,兼顾400~550以及700~850条带水平。但对于400条带以下和850条带以上的核型不具有评价价值。
染色体核型分析的质量评价是细胞遗传工作中的重点和难点[4-5]。由于高分辨染色体的制片过程较为复杂,对制片条件进行优化改善显得尤为必要。本研究建立的上述染色体制片质量评价标准,能够评价400~700条带水平的常规中低分辨染色体及高分辨染色体,具有操作方便,简单易用的特点。将染色体核型质量评价量化分析后,可为优化条件,提高制片质量提供依据。此外,本评价方法相对客观,有利于实验室开展室内质量控制以及室间质量评价,进一步改善染色体制片质量。
