CDK1在口腔鳞状细胞癌中的表达及意义*
2019-01-25段晓峰
石 静, 马 洪*, 段晓峰
(贵州医科大学, 贵州 贵阳 550004)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是发生在口腔颌面部最常见的一种恶性肿瘤,占口腔颌面部肿瘤的80%以上且全球每年新发现的OSCC人数超过300 000例,死亡人数超过120 000例[1]。目前针对中晚期OSCC病人以手术治疗为主,手术治疗后患者面容及口腔功能会有严重的缺陷,影响其生活质量、言语等。现已有一些OSCC的诊断标志物,帮助早期诊断OSCC,但肿瘤的发生发展是多基因多因素共同造成的结果,因此仍需要更进一步探讨潜在的一些肿瘤生物学标记物。近年来相关研究发现,细胞周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1)与多种肿瘤包括乳腺癌、胃癌,卵巢癌等发生发展关系密切,本研究采用免疫组织化学和Real-Time qPCR法检测CDK1基因和蛋白在OSCC中的表达,同时观察不同分化程度、不同临床分期及是否发生淋巴结转移患者的CDK1 mRNA的表达水平,为OSCC的早期发现和治疗提供依据。
1 材料与方法
1.1 标本主要仪器及试剂
1.1.1标本采集 收集2015年10月~2017年4月颌面外科手术切除的新鲜OSCC组织64例(OSCC组),病理类型经病理科证实。OSCC患者男45例、女19例,年龄<60岁26例、≥60岁38例,高分化癌40例、中或低分化癌24例,临床分期Ⅰ或Ⅱ期35例、Ⅰ或Ⅱ29例,无淋巴结转移45例、有淋巴结转移19例;另取20例正常组织标本(正常对照组)。本研究获医院伦理学会审核同意。切取1~2 mm3大小组织,一部分立即用RNAlater液暂封,-80 ℃冻存,用于Real-Time PCR检测CKD1 mRNA的表达;另一部分用福尔马林固定,石蜡包埋,用于免疫组织化学检测CKD1蛋白的表达。
1.1.2主要仪器及试剂 CFX connect Real Time System PCR扩增仪(BIO-RAD CFX96,美国),S1000 PCR 热循环仪(BIO-RAD,美国),YS100光学显微镜(Nikon,日本),各种规格的微量移液器(Eppendorf,德国),Dynabeads mRNA DIRECTTMKit试剂盒(Abcam公司,美国),Transcriptor First Strand cDNA Synthesis Kit试剂盒(Roche公司,美国),Light Cycler R480 SYBR Green I Master(Roche公司,美国);CDK1引物序列(上游 TAGCATCATCAGATGCACGC,下游 GTGTCCAGCAGTCGCACTAT;上海生工,中国)。
1.2 方法
1.2.1免疫组织化学 采用免疫组织化学超敏二步法检测组织切片中CDK1的表达。利用高温高压修复(0.01 mol/L枸橼酸盐缓冲液,4 min),一抗按1∶250比例稀释,阴性对照以PBS代替一抗。所有操作均严格按试剂盒说明进行,阳性染色主要表现为胞质中出现棕黄色颗粒,采用双盲法在光学显微镜下随机观察切片,根据免疫反应评分(IRS)评估染色强度和阳性细胞的比例;阳性细胞数<10%、10%~30%、>30%分别计0、1、2分,染色强度无着色、淡黄色、棕黄色及以上分别计0、1、2分;根据两者综合计分,0~1分计阴性(-),2~3分计阳性(+),4分计强阳性(++)。
1.2.2qPCR 利用Dynabeads mRNA DIRECTTMKit试剂盒,磁珠法提取组织mRNA,使用Transcriptor First Strand cDNA Synthesis Kit试剂盒逆转录成cDNA(-80 ℃储存备用)。按Light Cycler R480 SYBR Green I Master说明在冰上操作,配制10 μL反应体系, SYBR Green I Master 5 μL,上下游引物4.0 μL,模板1 μL。反应条件为变性95 ℃,5 min,变性95 ℃,10 s,退火65 ℃,30 s 共64个循环。每个样本3个复孔取平均值,采用2-ΔΔCT法进行分析。
1.3 统计学分析
应用SPSS 24.0软件进行统计分析。对于免疫组化CDK1蛋白表达与临床病例特征关系分析采用χ2检验,对于荧光定量PCR数据不符合正态分布应用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 CDK1蛋白表达
64例OSCC组织中可见细胞质中出现不同染色程度的棕黄色颗粒,少部分胞核见黄染,CDK1阳性率为82.81%;正常口腔黏膜细胞胞质中也存在少量棕黄色颗粒,CDK1阳性率为20.00%。经统计学分析,OSCC组CDK1阳性表达率显著高于正常对照组(P<0.01),见图1、表1。
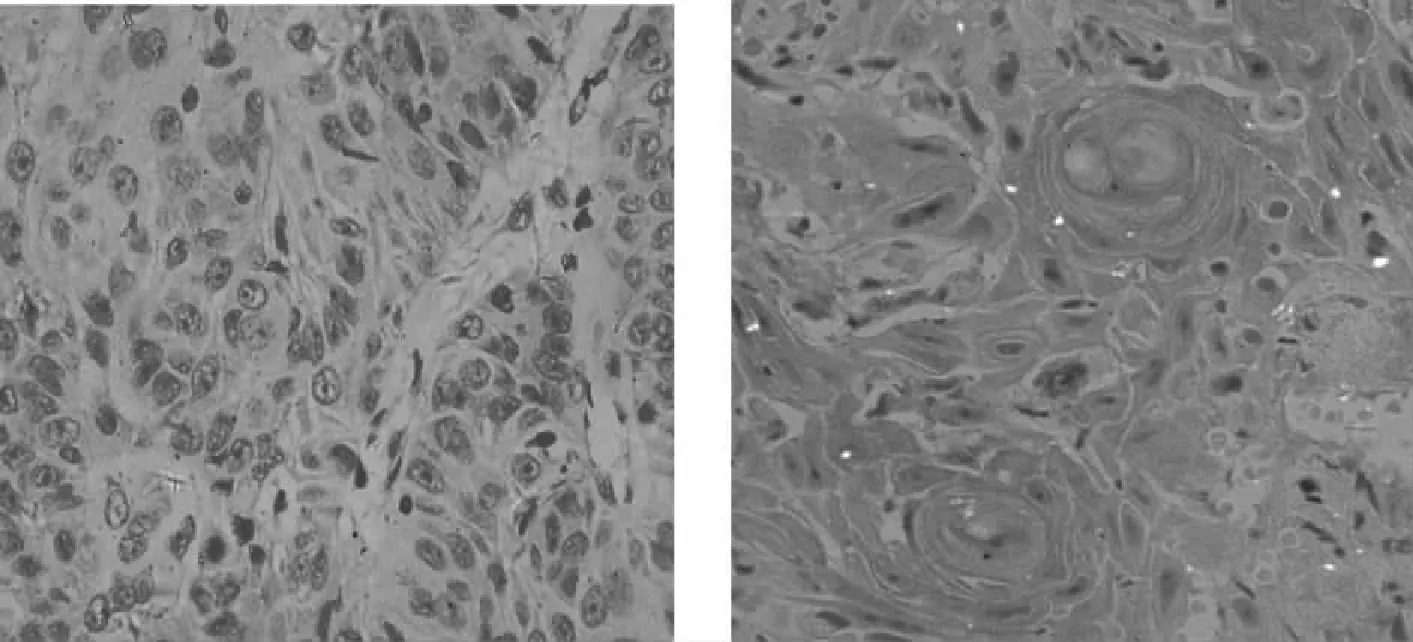
正常对照组 OSCC组图1 两组口腔组织CDK1蛋白的表达(×400)Fig.1 CDK1 protein expression in oral tissues in the two groups
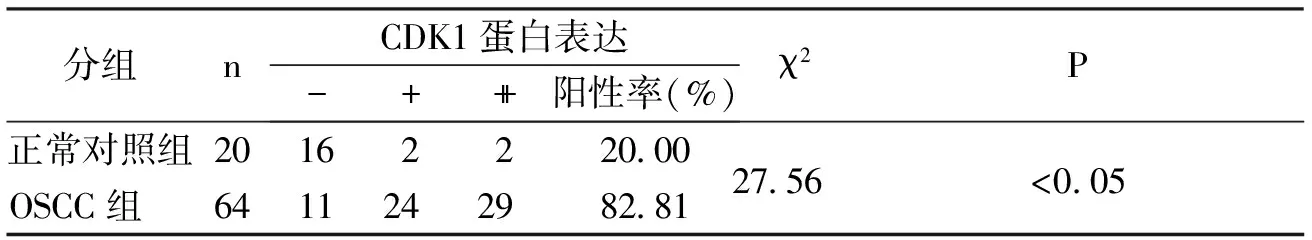
分组nCDK1蛋白表达-+++阳性率(%)χ2P正常对照组20162220.0027.56 <0.05OSCC组 6411242982.81
2.2 CDK1 mRNA表达
OSCC组及正常组织CDK1 mRNA相对表达量分别为1.301 3±1.033 7,0.656 3±0.175 0,OSCC组表达明显高于正常对照组(P<0.01),见图2。

(1)与正常对照组比较,P<0.01图2 CDK1 mRNA在两组口腔组织中的相对表达Fig.2 Relavtive expression of CDK1 mRNA in OSCC and Normal tissue
2.3 不同临床特征OSCC组织中CDK1 mRNA的表达
中、低分化OSCC的CDK1 mRNA的相对表达量显著高于高分化OSCC(P<0.05),并且Ⅲ、Ⅳ期OSCC组织中CDK1 mRNA的相对表达量也高于Ⅰ、Ⅱ期(P<0.05),存在淋巴结转移的OSCC组织中CDK1 mRNA相对表达量高于未见淋巴结转移组织(P<0.05);但是CDK1 mRNA的表达在不同性别及年龄中,差异无统计学意义(P>0.05),见表2。
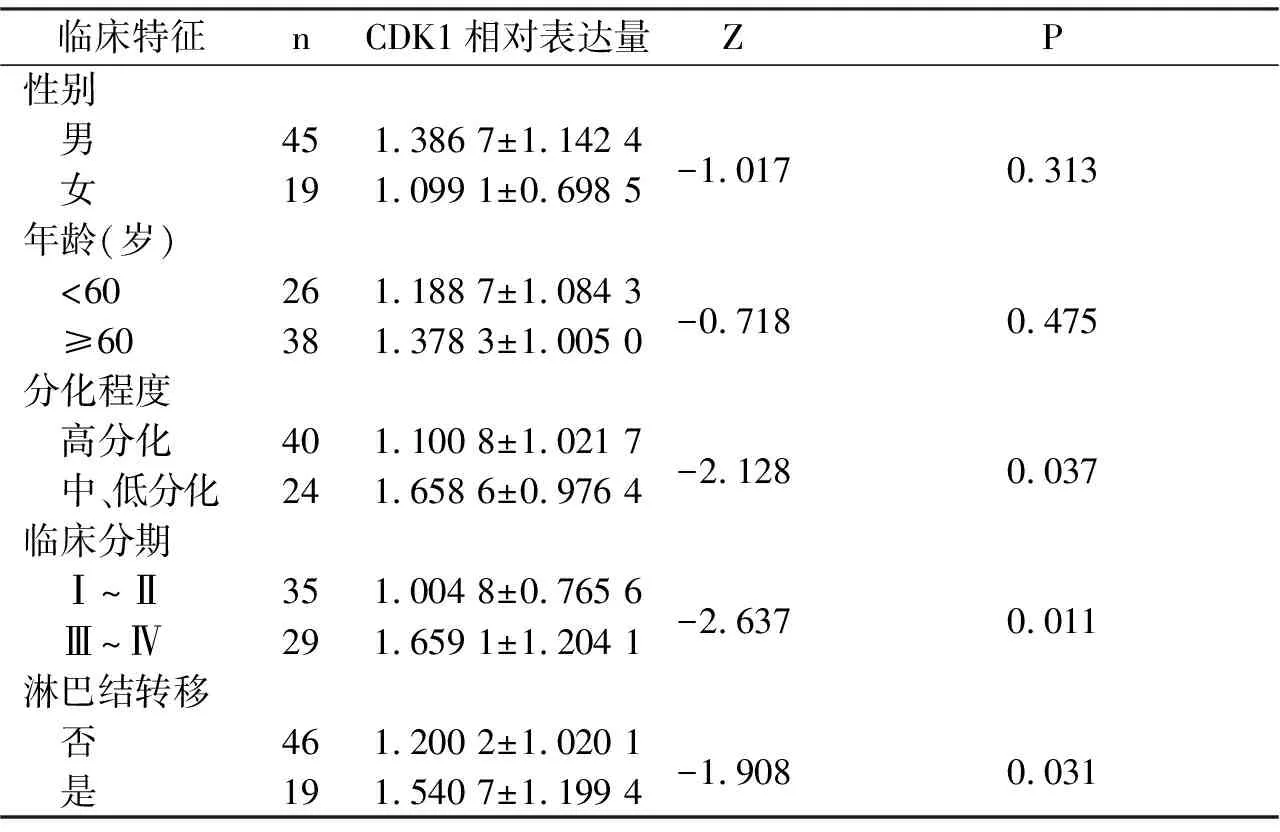
表2 CDK1 mRNA的表达与OSCC临床特征的关系Tab.2 The relationships between CDK1 mRNA expression and clinical characteristics in patients with OSCC
3 讨论
细胞周期主要通过细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDKS)的活化进行调控。CDKS功能的失调在许多肿瘤中均有报道,推测CDKS因子在肿瘤的发生发展中起重要作用[2-4]。细胞周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1) 为丝氨酸/苏氨酸蛋白激酶家族的成员之一,其是CDC2基因编码的相对分子质量为3.4×104的蛋白质。CDK1与cyclinB组成的复合物(即有丝分裂促进因子,MPF), 促使细胞周期从 G2期进入M 期,是影响细胞有丝分裂的主要因素[5-6]。CDK1是细胞周期的一个重要的调节分子,在细胞由G2期进入M期中发挥着重要的作用。研究表明,多种恶性肿瘤的发生发展都与细胞周期调节机制的紊乱有着密切的关联,认为肿瘤是一种细胞周期性疾病[7]。CDK1在非小细胞肺癌、结肠癌及乳腺癌中是影响临床预后的标志物[8]。因此,推测CDK1与肿瘤的发生发展有潜在的相关性。本研究在OSCC组织中,检测出CDK1蛋白和基因的表达水平均增高,可能与大量癌细胞的增殖、恶性程度以及侵袭性的增加有关,可能有望成为判断OSCC临床预后的标志物。
本研究中免疫组织化学结果显示64例OSCC组CDK1蛋白阳性表达率显著高于20例正常对照组,同时qPCR结果显示OSCC中CDK1 mRNA的表达明显高于正常对照组,这与CDK1在其他肿瘤病变如胃癌[9]、乳腺癌[10]、卵巢癌[11]、肝癌[12]等中的报道相一致,其作用机制均是CDK1的含量增高,引起肿瘤细胞的增殖和发展。同时进一步分析比较不同临床特征OSCC患者中CDK1 mRNA的表达情况,结果显示,中、低分化OSCC中的CDK1 mRNA的相对表达量显著高于高分化的OSCC,Ⅲ, Ⅳ期OSCC组织中CDK1相对表达量也高于Ⅰ、Ⅱ期OSCC组织,伴有淋巴结转移OSCC组织的CDK1 mRNA相对表达量高于无淋巴结转移组织,推测CDK1可作为判断OSCC临床预后的一个标志物,但是在性别以及年龄的分组中无明显差异,推测随着OSCC组织分化程度的降低以及临床分期的进展,CDK1 mRNA的相对表达量就越高,肿瘤恶性程度随之升高,从而促进肿瘤细胞增殖,加重侵袭性,临床预后较差。
基于本次实验,推测CDK1的高表达在OSCC中可能加速细胞周期G2/M期的转化,促进细胞有丝分裂,进一步促进肿瘤细胞的增殖。有关于CDK1更精准的调控机制有待进一步研究,为进一步实现早期诊断及精准治疗做准备。
