口腔鳞癌中STAT3的表达和肿瘤相关巨噬细胞含量的相关性分析*
2019-01-25冯红超宋宇峰马竹君
叶 丹, 冯红超, 宋宇峰, 马竹君
(1.贵州医科大学, 贵州 贵阳 550004; 2.贵阳市口腔医院 口腔颌面外科, 贵州 贵阳 550001; 3.贵州省食品药品监督管理局, 贵州 贵阳 550004)
口腔鳞状细胞(oral squamous cell carcinoma,OSCC)是人头颈部最常见的恶性肿瘤,其浸润转移是引起患者死亡的主要原因[1],因此针对OSCC的相关治疗研究非常重要。课题组前期研究证实肿瘤组织中存在大量巨噬细胞浸润即肿瘤相关巨噬细胞(tumor associated macrophages,TAMs),并且能极化为M1 型、M2 型[2]。在肿瘤组织及其微环境中均存在大量巨噬细胞浸润, 它们与肿瘤的发生、生长、转移有密切的关系[3]。目前大量研究提肿瘤发生发展过程中TAMs的浸润在其中起重要作用[4]。信号转导和转录活化因子3(STAT3)是STATs家族中参与多种致癌途径的枢纽中心,持续活化的STAT3能导致肿瘤的发生,在肿瘤形成过程中可通过JAK/STATs 通路不断活化从而导致癌细胞增殖、恶化[5]。有研究显示TAMs 可能通过诱导 STAT3 信号转导通路,激活STAT3 促进肿瘤细胞的侵袭和转移[6]。因此本研究以STAT3、巨噬细胞为对象,采用免疫组化法检测二者在OSCC中的表达以及相关临床病理特征的分析,研究癌症中巨噬细胞的极化问题,为肿瘤治疗提供新思路。
1 材料与方法
1.1 材料
收集2014-2017年贵州医科大学附属口腔医院和贵阳市口腔医院手术切除、术后病理确诊为口腔鳞状细胞癌的患者42例。其中男 31 例、女 11例,平均60岁。所有患者均为初发肿瘤原发病损,未接受任何针对肿瘤放疗、化疗等治疗,排除自身免疫性疾病等基础相关性疾病。其中高分化23例、中低分化19 例、淋巴结转移27例。另设15例肿瘤外2 cm正常黏膜组织作对照。本次研究均征得患者知情同意且经医院伦理委员会批准。
1.2 方法
采用非生物素二步免疫组织化学法,标本切片后经二甲苯, 酒精梯度脱蜡水化, 高温高压进行抗原修复。一抗鼠抗人STAT3多克隆抗体(购自proteintech公司),鼠抗人CD68单克隆抗体,鼠抗人 CD163 单克隆抗体4 ℃冰箱过夜,通用型二抗(北京中杉金桥生物技术公司)37 ℃烤箱孵育30 min,浓缩型DAB(北京中杉金桥生物技术公司)显色,苏木精复染后脱水、封片。操作步骤参照试剂盒说明书进行。以 PBS 取代一抗做阴性对照,用已知的阳性组织切片做阳性对照。一抗工作浓度STAT3为1∶150、CD68为1∶40、CD163为1∶75。
1.3 结果判定
STAT3判定标准采用阳性细胞比例和着色强度两项综合评定阳性结果。以细胞质出现淡黄色颗粒为阳性细胞,每张切片在高倍镜下(400倍)随机选取5个高倍视野,按着色强度评分:0分为无着色、1分为浅黄色、2分为黄色、3分为棕黄色。按阳性细胞百分比评分:0分为阴性、 阳性细胞数≤10%记为1分、11%~50%记为2分、51%~75%记为3分、>75%记为4分。上诉两项评分的乘积作为总积分,>3为阳性、≤3分为阴性。
巨噬细胞数的评定先在低倍镜下选取5个染色较好的视野,后在高倍镜下进行观察并计数阳性细胞个数,取其平均值做巨噬细胞计数。结果由2位专业人员独立阅片评估。
1.4 统计学方法
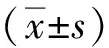
2 结果
2.1 STAT3、CD68+及CD163+在OSCC中的表达及浸润数量
STAT3阳性表达主要定位在肿瘤细胞胞浆,染色程度呈黄色至棕褐色,而正常组织中基本不表达或仅部分弱表达,见图1。CD68+、CD163+细胞主要位于巨噬细胞的细胞膜和细胞质内,分别见图2、3,在癌周间质呈棕黄色、黄色颗粒弥散分布,正常组织中数量较少。在癌组织STAT3表达、CD163+、CD68+细胞浸润数明显高于正常对照组,差异有统计学意义(P<0.05)。见表1。
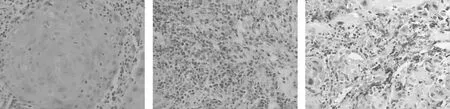
STAT3 CD68+ CD163+图1 口腔鳞癌中STAT3阳性表达、CD68+及CD163+浸润数量(400×)Fig.1 Positive expression of STAT3 in OSCC

组别STAT3CD163+CD68+病例组(n=42)5.19±2.9357.02±21.6244.02±23.81对照组(n=15)0.80±1.8219.40±9.52 10.07±4.10t6.7309.0828.884P<0.001<0.001<0.001
2.2 STAT3、CD68+、CD163+与OSCC各项临床病理参数之间的关系
见表2及表3。结果显示,STAT3、CD68+及CD163+与OSCC的临床分期、肿瘤细胞的分化程度及淋巴结转移相关。
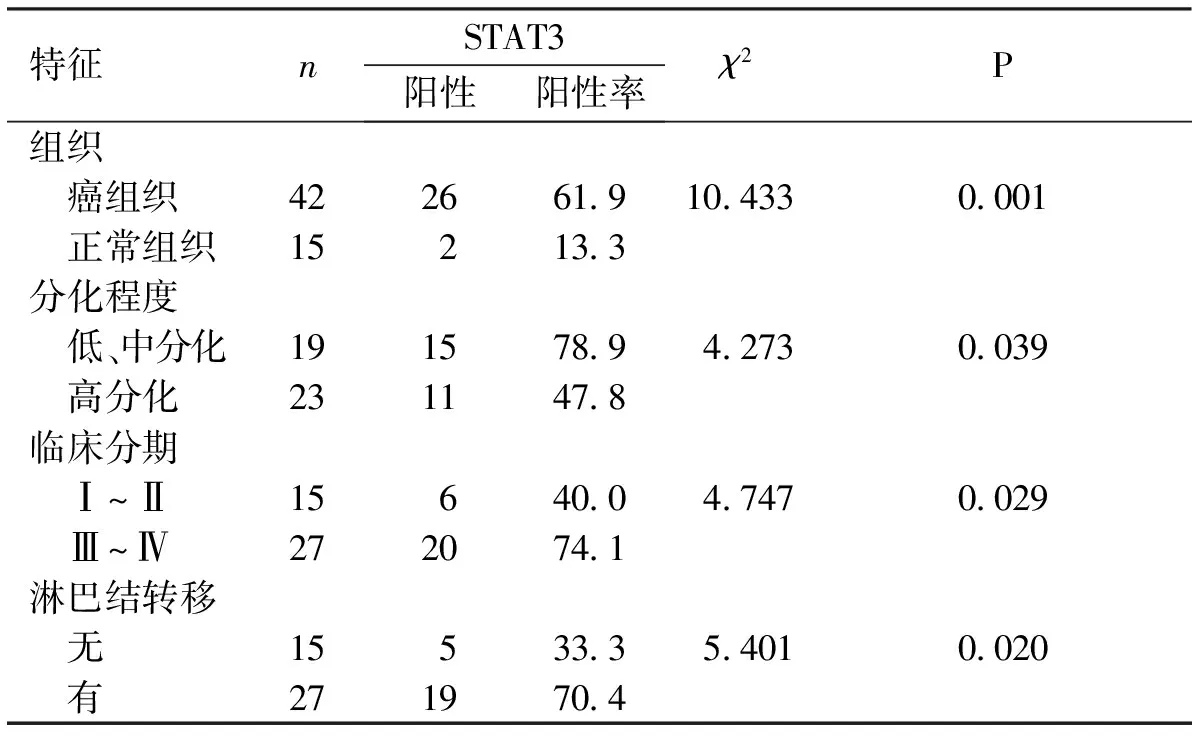
表2 STAT3的表达与OSCC临床病理参数的关系Tab.2 The relationship between the expression of STAT3 and clinical-pathologic factors in OSCC

表3 CD163+、CD68+细胞与OSCC临床病理参数的关系Tab.3 The relationship between CD68+,CD163+cells and clinical-pathologic factors in OSCC
2.3 STAT3、CD68+、CD163+在口腔鳞状细胞癌中表达的相关性分析
经Pearson相关性分析,口腔鳞癌中STAT3的表达与CD163+细胞呈正相关(r=0.397,P<0.05),随鳞癌恶性程度的增高,STAT3与CD163+的表达均明显增高。CD163+与CD68+计数正相关(r=0.329,P=0.034)。
3 讨论
近年越来越多研究方向转向肿瘤微环境,认为肿瘤的发生发展与机体局部微环境异常相关。肿瘤微环境是肿瘤所处的内环境,肿瘤细胞和肿瘤间质细胞 (包括巨噬细胞、淋巴细胞和成纤维细胞等) 分布于肿瘤微环境中,各个细胞又能够表达分泌各自相关的细胞因子[7]。其中肿瘤相关巨噬细胞 (TAMs) 是炎性细胞中起主要作用的一员[8]。TAMs在肿瘤间质细胞中占有相当大的比例。巨噬细胞能在肿瘤及肿瘤相关间质细胞分泌的趋化因子和细胞因子的作用下被募集到肿瘤周围,在肿瘤微环境下受细胞因子的作用下分化为不同型的TAMs。本次结果巨噬细胞在OSCC中数量明显高于正常组(P<0.05)意味着肿瘤组织中确实存在着TAMs现象的聚集现象,提示肿瘤中存在着炎症特别是TAMs的浸润,在OSCC中同样可能起着重要的作用。
随着研究的深入普遍认为可以根据巨噬细胞其表型和分泌的细胞因子类型极化为与急性炎症、T细胞免疫相关的M1型经典活化的巨噬细胞和促进肿瘤生长有关的具有肿瘤免疫抑制作用的M2型选择性活化巨噬细胞。查阅相关文献显示M2型巨噬细胞更多的参与肿瘤的发生发展过程,提高肿瘤细胞生存和迁移能力,促进肿瘤的转移并导致预后不良[9]。实验中CD68是区别于单核细胞和淋巴细胞的分子标记物,用于标记巨噬细胞但并不能区分亚型。而CD163和CD206只表达在M2型[10-11]巨噬细胞表面,目前较公认的 M2型特异性标记物通常采用CD163[11-12],因此为了阐述TAMs与肿瘤间的相关关系,本次实验选择以CD68蛋白标记巨噬细胞,CD163蛋白标记M2型巨噬细胞。此次实验结果显示CD163+细胞在鳞状细胞癌组织中浸润数量明显升高,随着肿瘤细胞及炎性因子的聚集并开始生长、浸润时迫使巨噬细胞极性会更倾向于转变为M2型[ 12-13]这与大多数研究一致。同时在本次实验中得出CD163+的浸润数量在淋巴结、分期、分化中差异中有统计学意义(P<0.05),提示可能与肿瘤发展和转移有一定关系,绝大多数癌症的致死是由于肿瘤细胞的转移和远处播散,进一步增强了肿瘤的恶性生物学行为,也因此表明巨噬细胞的极化与肿瘤分期有关。
STAT3不仅是众多致癌途径的中心调节枢纽,在肿瘤侵袭和转移中起着重要作用[14]。在近几年的研究中STAT3被认为是M2型巨噬细胞极化的主要信号传导分子之一[15],在TAMs中起着重要作用。异常表达STAT3能上调VEGF[16]、MMPs、HIF-1α等蛋白促进肿瘤增殖[17],也有研究显示STAT3缺乏会抑制血管生成[18],表明STAT3的高表达与血管生成相关。通过新生血管生成和肿瘤基质重塑促成肿瘤生长、存活和传播。同时有研究显示M2型巨噬细胞通过释放VEGF促进肿瘤转移和复发[19]。本研究中STAT3表达量确实在肿瘤组中明显高于正常组织,且STAT3的阳性表达与临床分期、分化、局部淋巴结转移有关(P<0.05),与鳞癌分化程度呈负相关,当肿瘤发生淋巴结转移时, 意味着较差的预后, STAT3表达阳性率也呈升高趋势,这提示STAT3可能在口腔鳞状细胞癌发展及转移中起作用。而本研究利用免疫组化实验技术证明了鳞癌组织中高表达CD68+、CD163+、STAT3,在实验中从相关性分析得知STAT3的表达与CD163+细胞计数呈正相关(r=0.397,P<0.05),推测STAT3的上调可能促进巨噬细胞向M2型分化,进一步推测二者在口腔鳞癌中可能起协同作用。
综上所述,在OSCC中CD68+、CD163+、STAT3的浸润数量及表达明显上升,提示它们的异常表达可能与肿瘤的发生、淋巴结转移有关,因此检测三者对于口腔癌发生发展提供一定参考。
