阿托伐他汀对DN小鼠肾组织SFRP1表达的影响*
2019-01-25田平平孟庆敏卢雨微张国忠石明隽
孔 静, 田平平, 孟庆敏, 卢雨微, 张国忠, 肖 瑛, 郭 兵, 石明隽**
(1.贵州医科大学 病理生理学教研室, 贵州 贵阳 550025; 2.贵州省常见慢性疾病发病机制及药物研究重点实验室, 贵州 贵阳 550025; 3.贵阳市第四人民医院, 贵州 贵阳 550000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)常见且严重的并发症,是引起终末期肾病的主要原因之一,其发病机制尚不清楚。肾小管间质纤维化是DN进展为终末期肾病的重要病理基础,肾小管上皮细胞向间充质细胞分化(epithelial-mesenchymal transition, EMT)在肾小管间质纤维化的发生发展中起着重要作用[1-2],Wnt信号通路是诱导EMT发生的一条关键信号通路[3-5],SFRP1是该通路的抑制因子[6]。阿托伐他汀是一种经典的降脂药,有减少尿蛋白排泄、减轻细胞外基质聚集等肾脏保护作用[7],前期研究发现阿托伐他汀可抑制单侧输尿管梗阻(unilateral ureteral obstruction, UUO)大鼠肾纤维化时肾组织Wnt4/β-catenin信号通路活化,改善肾纤维化病变,但具体机制尚不清楚[8]。本研究以DN小鼠为研究对象,观察阿托伐他汀对小鼠肾组织Wnt4/β-catenin信号通路及SFRP1表达的影响及延缓DN肾纤维化的可能机制。
1 材料与方法
1.1 材料
链脲佐菌素(STZ,美国Sigma),BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒(北京碧云天生物研究所),SP试剂盒、DAB显示试剂(北京中杉金桥公司),逆转录试剂盒(美国Fermentas),SuperReal PreMix Plus(北京天根公司)。小鼠抗大鼠β-actin(武汉普美生物),兔抗小鼠SFRP1、Wnt4、β-catenin、E-cadherin、col-Ⅳ(北京博奥森),α-SMA(美国santa 公司),山羊抗兔二抗、兔抗小鼠二抗(武汉普美生物)。
1.2 方法
1.2.1分组及处理 雄性清洁级昆明小鼠30只,体质量(30±10)g,购自贵州医科大学动物中心,动物批号SCXK(黔)2012-0001。30只小鼠随机分为正常对照(NC)组、糖尿病肾病(DN)组及阿托伐他汀治疗(Ato)组,每组10只。DN和Ato组小鼠禁食不禁水3 h,给予55 mg/kg STZ腹腔注射、连续5 d、1次/d,NC组给予相同剂量无菌柠檬酸钠缓冲液处理。造模第1周开始,小鼠禁食不禁水3 h后采集各组小鼠尾静脉检测空腹血糖,以造模第2周血糖≥16.7 mol/L判定为造模成功。造模第5周开始,Ato组小鼠给予阿托伐他汀(用0.5%羧甲基纤维素配制成混悬液)20 mg/(kg·d)灌胃4周, NC组和DN组小鼠给予等体积0.5%羧甲基纤维素。
1.2.2标本收集 造模第9周时禁食不禁水3 h,乙醚麻醉后处死各组小鼠,摘除眼球取血,离心取血清-20 ℃保存;解剖分离肾脏,部分肾脏固定于4%中性甲醛液中供石蜡切片用,其余肾脏-80 ℃保存供后期实验用。于处死小鼠前1天用代谢笼收集24 h尿液,记录尿量,离心取上清-20 ℃保存。
1.2.3生化指标检测 小鼠血、尿标本送贵阳金域公司检测血糖、胆固醇、尿素氮、甘油三酯、肌酐及24 h尿蛋白。
1.2.4肾组织形态学观察 用4%中性甲醛固定的肾脏组织制作成厚度约为3 μm石蜡切片,行HE和Masson染色,光镜观察肾组织结构变化。
1.2.5免疫组化染色观察 β-catenin和SFRP1表达 制备好的3 μm石蜡切片按照两步法检测试剂盒进行免疫组化染色,烤片、脱蜡、PBS漂洗、3% H2O2阻断内源性过氧化物酶、微波抗原修复、PBS漂洗、一抗孵育(SFRP1 1∶100,β-catenin 1∶100)过夜,次日取出切片,PBS漂洗、二抗孵育、DAB显色、流水冲洗、胞核复染、上行脱水、中性树胶封片后镜下观察及采集图像。
1.2.6Western blot检测小鼠肾组织SFRP1、β-catenin、E-cadherin 1、α-SMA 1及Col-IV蛋白表达 冰上提取小鼠肾组织总蛋白、BCA法蛋白定量后取50 μg/孔上样,电泳、转膜、5%脱脂奶粉封闭、一抗孵育过夜(β-actin 1∶4 000、SFRP1 1∶400、β-catenin 1∶300、E-cadherin 1∶400、α-SMA 1∶400、Col-IV 1∶1 000),次日TBST洗膜后二抗孵育1 h,TBST洗膜3×10 min,ECL发光, Bio-Rad凝胶成像系统扫描条带,Image Lab软件分析条带灰度值,用目的蛋白条带灰度值比上内参β-actin条带的灰度值表示蛋白相对表达量。
1.2.7Real time-PCR检测小鼠肾组织SFRP1 mRNA表达 Trizol法提取总RNA,IMPLEN核酸蛋白仪检测RNA浓度和纯度,按照Fermentas试剂盒说明书进行反转录,Real- time PCR反应根据SuperReal PreMix Plus试剂盒设定反应体系,Bio-Rad CFX 96TM荧光定量PCR仪进行检测,以β-actin为内参照,目的基因的相对含量以2-ΔΔCt表示。PCR反应引物由上海捷瑞生物工程有限公司设计合成。
1.3 统计学方法
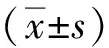
2 结果
2.1 一般情况和相关生化指标
造模第1周,小鼠血糖逐渐升高,部分小鼠血糖值≥16.7 mmol/L;造模第2周时,全部模型组小鼠血糖值≥16.7 mmol/L;造模第9周时,与NC组比较,DN组小鼠逐渐出现多饮、多食、尿量增多、消瘦及体重减轻。NC组小鼠毛发光亮,饮食饮水正常,体质量持续增加,经Ato治疗后上述症状有所减轻;与NC组比较,DN组小鼠的血糖、尿素、肌酐、24 尿蛋白、甘油三酯及胆固醇均明显增高,差异有统计学意义(P<0.05); 与DN组比较,Ato组小鼠尿素、肌酐、24 h尿蛋白、甘油三酯和胆固醇较DN组明显降低,差异有统计学意义(P<0.05)。见表1。
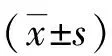
表1 各组小鼠部分血液生化指标比较Tab.1 Mouse blood biochemical indexes
(1)与NC组比较,P<0.05;(2)与DN组比较,P<0.05
2.2 肾组织形态学
HE染色可见NC组小鼠肾小球结构清晰完整,肾小管排列紧密、整齐,肾间质无炎性细胞浸润;DN组小鼠肾小球体积增大,肾小管管腔明显扩张,间质见炎性细胞浸润;Ato组间质炎性浸润细胞明显减少。Masson染色NC组小鼠肾组织未见胶原纤维沉积,DN组小鼠则显示肾小管间质有大量蓝色条索状物质沉积,Ato治疗组上述病变明显较DN组小鼠轻(图1)。
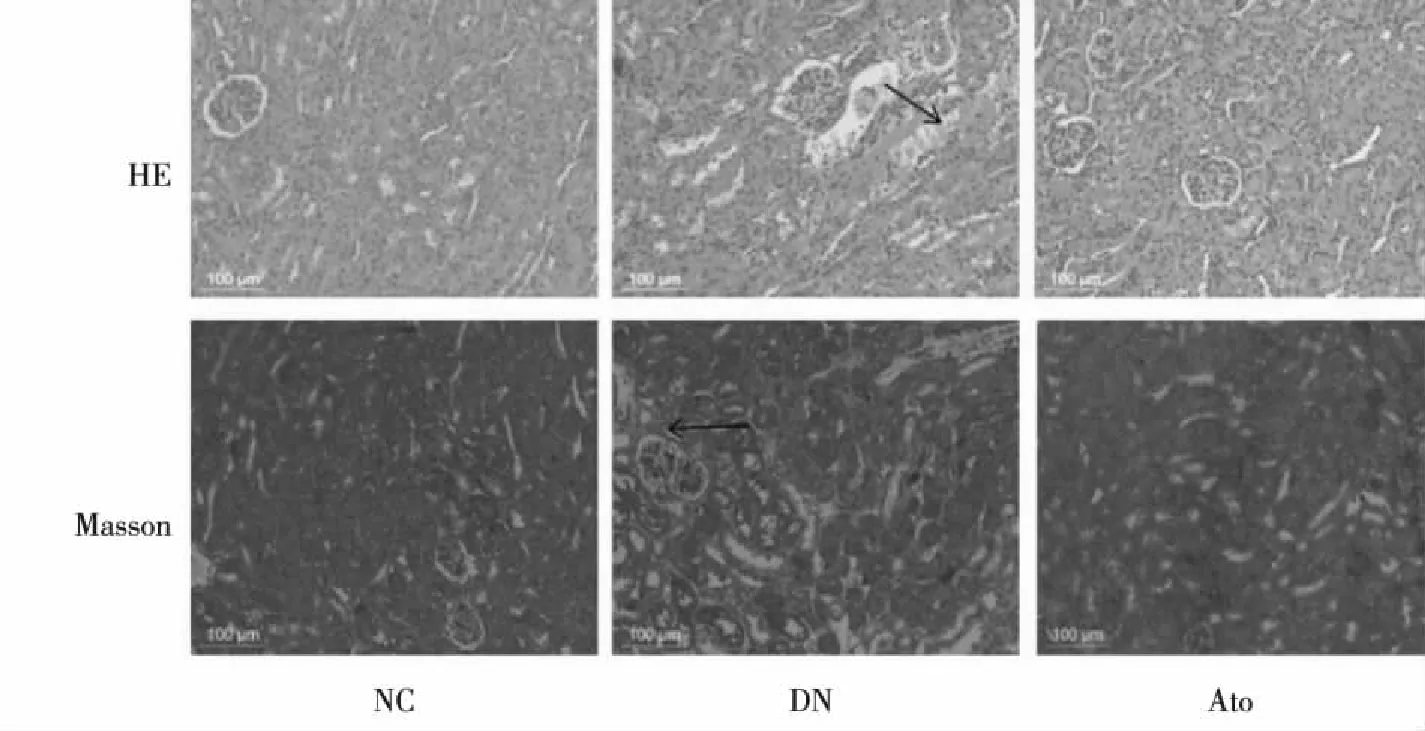
图1 各组小鼠肾组织HE、Masson染色(200×)Fig.1 HE staining and Masson staining of the kidney tissue in each group mice
2.3 免疫组织化学结果
NC组可见肾组织几乎未见β-catenin蛋白表达,SFRP1在肾小管上皮细胞胞浆中有较多棕黄色阳性表达。N组可观察到β-catenin在肾小管上皮细胞胞浆和胞膜阳性表达增多且在核中表达,SFRP1在肾小管上皮细胞胞浆中棕黄色阳性表达较少;与DN组比较,Ato组β-catenin阳性表达减少,而SFRP1阳性表达增加(图2)。

图2 β-catenin和SFRP1蛋白在各组小鼠肾组织中的表达(免疫组化,×400)Fig.2 Immunohistochemical staining of kidney β-catenin and SFRP1
2.4 Western blot结果
与NC组比较,DN组小鼠肾皮质Wnt4、β-catenin、α-SMA和Col-IV蛋白表达显著增多(P<0.05),SFRP1和E-cadherin蛋白表达减少(P<0.05)。给予阿托伐他汀治疗后,Wnt4、β-catenin、α-SMA和Col-IV蛋白表达较DN组明显减少,而SFRP1和E-cadherin蛋白表达则有所增加,差异有统计学意义(P<0.05)。见图3。

(1)与NC组比较,P<0.05;(2)与DN组比较,P<0.05图3 SFRP1、Wnt4、β-catenin、E-cadherin、α-SMA和Col-Ⅳ蛋白在各组小鼠肾组织中的表达(Western blot)Fig.3 The effect of atorvastatin on expression levels of SFRP1, Wnt4, β-catenin, E-cadherin, α-SMA and Col-Ⅳ
2.5 Real-Time PCR结果
与NC组相比,DN组小鼠肾皮质中SFRP1 mRNA表达明显降低,Ato组SFRP1 mRNA表达较DN组增加,差异有统计学意义(P<0.05),但仍低于NC组(图4)。

(1)与NC组比较,P<0.05;(2)与DN组比较,P<0.05图4 各组小鼠肾组织中SFRP1 mRNA表达(Real-time PCR)Fig.4 The effect of atorvastatin on SFPR1 mRNA levels in mouse renal cortex
3 讨论
阿托伐他汀是常用的降脂药,同时还具有抗炎、抗氧化等作用。王湘研、陈雪芬等[9-12]研究发现,阿托伐他汀可以改善心肌纤维化和肺纤维化。阿托伐他汀同样也具有抗肾纤维化效应[13-14],本课题组的前期研究表明阿托伐他汀可抑制UUO大鼠肾组织Wnt/β-catenin信号途径的活化和转导,使肾间质细胞外基质(extracellular matrixc,ECM)沉积减少,肾纤维化病变得到改善,但具体机制尚不明确。
本研究采用55mg/kg STZ多次腹腔注射成功复制I型糖尿病小鼠模型,生化及HE和Masson染色结果提示DN组及Ato组小鼠出现肾脏损害,继发DN,而Ato组小鼠经过阿托伐他汀治疗后,小鼠一般情况改善,尿素氮、24尿蛋白、甘油三酯、总胆固醇、肌酐均明显降低,病理形态观察可见间质炎性浸润细胞明显减少,PAS染色阳性物质减少,纤维化病变减轻,说明阿托伐他汀对DN小鼠肾具有一定的保护作用。β-catenin是经典Wnt通路的核心分子,其在胞浆中积聚增多后转移入核是经典Wnt信号通路活化的标志[15-16]。本实验免疫组织化学和Western blot结果显示DN组小鼠肾组织β-catenin表达较NC组明显增高,进一步证实了经典Wnt信号通路活化参与了DN肾纤维化发生,给予阿托伐他汀治疗后Ato组β-catenin表达较DN组明显减少,说明阿托伐他汀可抑制DN小鼠肾组织经典Wnt/β-catenin信号通路的活化。SFRPs是Wnt信号通路的拮抗因子,其家族成员包括SFRP1-5,其中SFRP1高表达于肾脏[17-20]。本实验研究发现DN小鼠肾组织SFRP1 mRNA和蛋白表达明显低于NC组小鼠,提示DN发生时Wnt/β-catenin经典信号通路的活化可能与该通路抑制因子SFRP1表达下调,进而对该通路抑制作用减弱有关。经阿托伐他汀治疗后,与DN组相比Ato组小鼠肾组织SFRP1 mRNA和蛋白表达增多,Wnt4、β-catenin、α-SMA和collagen-IV蛋白表达下调,E-cadherin蛋白表达上调,提示阿托伐他汀可能是通过上调SFRP1的表达而增强了对Wnt4/β-catenin信号通路的抑制作用,故阿托伐他汀干预后Wnt4/β-catenin信号通路相关分子表达明显下调,进而使其下游信号分子间充质细胞标志物α-SMA和collagen-IV表达减少,上皮细胞标志蛋白E-cadherin表达上调,延缓DN小鼠EMT的发生和减少ECM沉积,起到了延缓DN小鼠肾纤维化的作用。与段兴旺等[21]在大鼠UUO肾纤维化模型中发现益肾康胶囊可能通过上调SFRP1表达而下调了β-catenin蛋白的表达,从而延缓肾纤维化进程的实验结果一致。
综上所述,在DN小鼠肾纤维化进程中,SFRP1 mRNA和蛋白水平的下调可能是导致wnt4/β-catenin信号通路异常活化的原因,而阿托伐他汀可以通过上调DN小鼠肾组织SFRP1 mRNA和蛋白的表达,进而抑制wnt4/β-catenin信号通路活化,延缓DN小鼠肾纤维化的发生发展。
