微管相关蛋白1A在前列腺癌中的表达与其临床特征的关系
2019-01-25苏嘉明袁东波陈卫红孙兆林朱建国
王 蔚 苏嘉明 袁东波 张 伟 陈卫红 孙兆林 朱建国*
(1.贵州医科大学研究生院,贵阳 550000;2.贵州省人民医院泌尿外科,贵阳 550000;3.遵义医科大学研究生院,贵州遵义 563000)
前列腺癌(prostate cancer,PCa)已成为危害男性健康的主要恶性肿瘤之一,在欧美发达国家及地区,其发病率已跃居至男性恶性肿瘤发病率的首位[1-2]。根据最新的10年统计数据,PCa在大多数国家的发病率急剧上升,其中尤以亚洲、北欧和西欧地区的增长最为快速[3]。我国前列腺癌的发病率虽然较低,但其趋势却不容乐观,伴随着我国社会经济的飞速发展,人们生活及饮食习惯的改变,人口老龄化日益加剧,PCa的发病率也在不断上升且增长的速度更为快速,现已成为我国男性泌尿生殖系统中最常见的恶性肿瘤[4]。前列腺癌的病因尚不明确,可能与种族、遗传、环境、食物、吸烟、肥胖、性激素等有关。其发生发展是由多种因素诱导的复杂过程,受到体内、外各种因素的作用和影响。许多研究[5-7]证明某些基因的功能丢失或突变在前列腺癌的发病、进展及转移中发挥重要作用。因此寻找早期诊断前列腺癌、评估远期预后的分子标志物是前列腺癌基础研究的一个热点方向。
MAP1A是微管相关蛋白(microtubule-associated proteins,MAPs)家族中重要的一员,附着于微管多聚体上,参与微管组装并增加微管稳定性[8],其在细胞增生、分化、自噬、迁移和肿瘤的发生发展中扮演了十分重要的角色。本研究采用免疫组织化学(immunohistochemistry,IHC)染色、实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, RT-qPCR)检测MAP1A基因在前列腺癌及正常前列腺组织中的表达情况,进一步通过癌症基因信息数据库(the Cancer Genome Atlas, TCGA)分析MAP1A的表达与临床病理等参数之间的相关性,探讨MAP1A在前列腺癌中的表达情况及临床意义。
1 材料与方法
1.1 组织芯片
采用前列腺癌患者组织芯片进行IHC,检测MAP1A在99例前列腺癌及81例癌旁正常前列腺组织样本中的表达差异。组织芯片购自上海芯超生物科技有限公司(芯片编号:FM-S4006-1,芯片批号:HPro-Ade180PG-01),组织芯片排列包含了99例原发前列腺癌患者的前列腺癌组织和81例癌旁正常前列腺组织。99例前列腺癌患者年龄50~90岁,平均年龄(70.71±7.98)岁。组织芯片包括了181个位点(其中1个为定位点),均无组织芯片脱落。所有组织均经直肠前列腺13点穿刺或临床手术切除后经病理证实为前列腺癌,患者在术前均没有接受抗雄激素去势治疗及放射治疗(以下简称放疗)和化学药物治疗(以下简称化疗)。临床病理参数信息包括有:年龄、Gleason评分、肿瘤大小、病理分型、淋巴结转移检测等,同时本组织芯片没有随访信息。
1.2 免疫组织化学染色
按照SP试剂盒的操作说明进行免疫组织化学染色,样本使用二甲苯脱石蜡并用梯度乙醇再水化,3%(质量分数)的过氧化氢离子水用于灭活内源性过氧化物酶活性,柠檬酸盐缓冲液进行抗原修复,使用5%(质量分数)牛血清白蛋白(bovine serum albumin,BSA)孵育载玻片以阻断非特异性结合,随后分别进行与第一抗体及第二抗体的孵育;最后通过应用过氧化物酶复合物试剂和3,3’-二氨基联苯胺溶液实现蛋白质可视化。最终实验结果由两位病理医师根据以下判定标准独立地进行盲评。免疫组化结果评判标准:根据阳性细胞所占的比例和细胞染色强度两个方面分别计分[细胞质和(或)细胞核出现棕黄或棕褐颗粒为阳性细胞]: 无阳性细胞评0分, 阳性细胞≤25 %评1分,26%~50%评2分,51%~75 %评3分,>75 %评4分。着色强度无色评0分, 淡黄色评1分,棕黄色评2分, 棕褐色评3分。最终免疫组化评分(immunoreactive score, IRS)结果为两者评分的相加总分,0分为阴性(-), 2~3分为弱阳性(±),4~5分为阳性(+),6~7分为强阳性(+ +);其中(+) 和(+ +) 判为阳性结果。
1.3 实时荧光定量聚合酶链式反应
该研究经贵州省人民医院研究伦理委员会批准(批准文号:2016026)。从贵州省人民医院的组织库收集了6例原发性PCa组织和6例正常前列腺组织的样品。所有标本均按照道德和法律标准进行匿名处理,患者同意和签订患者知情同意书。上述样本为前列腺根治术或经尿道前列腺电切术以及膀胱癌根治术时手术切下的前列腺组织,术后立即放液氮速冻,-80°保存备用。本研究中招募的患者均未在手术前进行化疗或放疗,所有冰冻样本都经苏木精-伊红染色(hematoxylin eosin staining,HE)鉴定,符合要求才进一步提取RNA。使用天根RNA试剂盒(CatNo.DP419,TianGene,China)提取总RNA,并通过UV分光光度计NanoDrop 2000(Thermo Scientific,USA)测量总RNA的浓度。 RT-qPCR用于检查基质mRNA在基质组织中的表达状态。qPCR检测采用SYBR Green©染料法,反应条件参数为:95℃预变性5 min,95℃变性15 s,58℃退火20 s,72℃延伸20 s,共进行30个循环。所有测定一式三份进行,使用IQ5软件(Bio-Rad)测定循环阈值(cycle threshold,Ct)值。用GAPDH表达对每个样品中的基因表达进行标准化。使用比较Ct值评估靶基因表达的相对定量。
1.4 统计学方法
统计数据使用SPSS 22.0软件处理,临床病理参数之间MAP1A的表达水平比较采用独立样本t检验;若方差不齐则采用近似t检验。前列腺癌及癌旁正常组织间MAP1A阳性表达率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MAP1A蛋白在前列腺癌组织中的表达
结果显示,MAP1A在前列腺癌及癌旁组织中均主要表现为细胞质染色,MAP1A在前列腺肿瘤细胞质中的免疫组化染色强度主要为弱阳性和中度阳性,而在癌旁正常前列腺组织中免疫组化染色强度多为强阳性和中度阳性(图1A、C)。组织芯片IRS评分结果显示,MAP1A在前列腺癌组织中的表达(4.08±1.58)显著低于癌旁正常组织(4.91±1.46),差异有统计学意义(t=-3.699,P<0.001)(图1B)。通过IRS评分进一步检测组织芯片中MAP1A的阳性表达率,将0~3分定义为阴性表达,4~7分定义为阳性表达。结果显示,在99例前列腺癌组织中58例呈阳性表达,阳性率为58.6%;而在81例癌旁良性组织中有67例染色呈阳性,阳性率为82.7%;两者比较差异有统计学意义(χ2=12.225,P=0.001)。
对99例前列腺癌患者MAP1A的表达水平与其临床特征进行统计分析的结果显示,在不同临床病理分期的前列腺癌组织中,MAP1A的表达水平差异具有统计学意义(t=-2.678,P=0.003),肿瘤的临床病理分期越晚,则前列腺癌组织中MAP1A的表达越低;而在不同年龄(t=1.661,P=0.100)和不同Gleason评分(t=-0.925,P=0.357)的前列腺癌组织中MAP1A的表达差异无统计学意义,详见表1。

图1 MAP1A蛋白在前列腺癌组织和癌旁正常组织中的表达Fig.1 Expression of MAP1A protein in prostate cancer tissues and adjacent normal tissues
A:immunohistochemistry results of MAP1A in tissue microarrays;B:immunoreactive score;C:the expression of MAP1A (immunohistochemistry staining, 10×,20×);* * *P<0.001; Red arrows show the positive staining cells;MAP1A:microtubule associated protein 1A;TMA:tissue microarrays;IRS:immunoreactive score;Cancer:the prostate cancer group;Normal:the adjacent normal tissues group.

*P<0.05;MAP1A:microtubule associated protein 1A;IRS:immunoreactive score.
2.2 MAP1A mRNA在前列腺癌及正常前列腺组织中的表达情况
应用RT-qPCR检测前列腺癌组织(n=6)和正常前列腺组织(n=6)中MAP1A mRNA表达量。以MAP1A基因的反转录cDNA为模板进行扩增,引物序列为(F: 5′-GAGAGGCTTCCTCCTACACC-3′ R:5′-GTCTCCCCCAGGCTCTAAAC-3′),结果在186bp扩增到清晰条带,与预期的片段大小一致(图2A)。图2B中结果可见,MAP1A mRNA在前列腺癌中的表达量为正常前列腺组织中表达量的0.81倍,差异具有统计学意义(P=0.019),即MAP1A mRNA在PCa组织中表达显著低于正常前列腺组织。
2.3 TCGA数据库中MAP1A的表达降低与前列腺癌的侵袭性进展和预后的关系
为了进一步验证MAP1A表达情况与前列腺癌临床病理参数的关系,对TCGA公共数据库中497例前列腺癌患者MAP1A mRNA表达水平与其临床病理特征进行统计分析。结果显示,MAP1AmRNA的表达在不同临床特征的肿瘤组织中差异具有统计学意义,即Gleason评分高,病理分期晚,发生转移的患者体内MAP1A表达量更低,表明MAP1A在前列腺癌中表达水平低,则患者临床预后较差,详见表2。
3 讨论
前列腺癌的发生和发展是由众多因素的改变引起的,许多研究[9-11]表明前列腺癌的预后与确诊时前列腺癌的分期具有直接的相关性,因此早期诊断对患者的治疗和预后有重大意义。前列腺癌的诊断手段包括:直肠指检、血清前列腺特异性抗原 (prostate specific antigen,PSA) 检测、前列腺B超和盆腔磁共振(magnetic resonance imaging,MRI)检查等方式[12],其中血清PSA检测在临床上最为常用,通过评估血清PSA浓度,大多数患者在癌症早期可通过前列腺穿刺明确诊断[13-14]。但PSA浓度可受到诸多因素的影响,如年龄、前列腺肥大、前列腺炎、导尿术和膀胱镜检查后、前列腺穿刺活检或前列腺手术后等,都将导致不同程度的升高,因此缺乏前列腺癌的特异性。此外,当PSA处于4~10 ng/mL的灰度区间时,仍有25%的患者可能为前列腺癌,而PSA<4 ng/mL时也有15%患者可能是前列腺癌[15-16]。因此单纯依靠PSA进行筛查可发生前列腺癌的过度诊疗及患者生活质量下降的问题,故不能把穿刺活检应用于大样本人群的筛查和早期诊断[17-18]。目前PCa的诊疗方案及远期预后主要取决于疾病的临床病理学特征,例如肿瘤分期、血清PSA浓度、手术边缘状态和Gleason评分等[19-20]。前列腺癌的远期预后及生存率有赖于早期诊断和早期治疗,而PCa的临床进展是从无痛或无临床意义的惰性肿瘤到侵袭性、转移性的致死性疾病。据统计[21],发生远端转移的侵袭性PCa患者的5年相对生存率为28%,而局部或区域性的惰性低风险PCa患者的存活率则接近100%。对于惰性的低风险肿瘤患者来说,采用积极监测的保守治疗方式可能比手术治疗更能保证其生命质量[22]。因此临床上需要一种精准的肿瘤标志物来补充及提高前列腺癌的诊断率,并能有效地区分惰性和侵袭性病例,从而确定最佳的治疗策略。
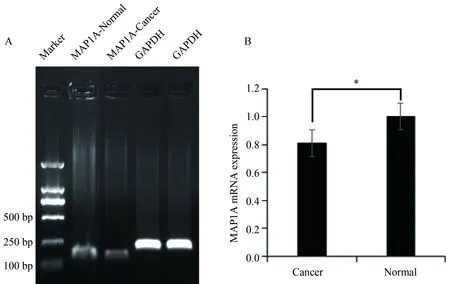
图2 MAP1A在前列腺癌及正常前列腺组织中的RT-qPCR检测结果Fig.2 RT-qPCR results of MAP1A in prostate cancer and normal prostate tissue
A: The electrophoresis of PCR product for MAP1A;B: Histogram for the relative expression levels for MAP1A;*P<0.05;MAP1A:microtubule associated protein 1A;MAP1A-Normal: the normal prostate tissues group;MAP1A-Cancer: the prostate cancer group;GAPDH: internal reference.

表2 TCGA 数据库中前列腺癌患者MAP1A mRNA表达与临床特征的关系Tab.2 Associations of MAP1A mRNA expression with clinical characteristics of prostate patients
MAPs和微管蛋白是组成微管的主要成分,微管是细胞骨架的主要结构成分之一,参与细胞的许多生理功能:维持细胞正常的形态,作为细胞内物质运输的通道,参与纤毛、鞭毛的运动,还在细胞分裂、细胞周期、细胞增生、细胞自噬过程中发挥重要作用[23]。微管相关蛋白 1(MAP1)是MAPs家族中的经典成员之一,哺乳动物基因组通常包含3个家族成员:MAP1A、MAP1B和MAP1S。MAP1A主要分布在神经元的轴突和树突中,可以参与微管组装、调节微管运动及稳定性并促进微管聚合成束,对轴突、树突的生长发育发挥重要作用[24-25]。研究[26-27]表明MAP1与多种肿瘤的发生、发展密切相关。如Meyer等[26]研究发现MAP1A可在胶质瘤中抑制肿瘤细胞增生,从而抑制肿瘤的生长、侵袭等作用。Knutson等[27]发现,相对于正常乳腺组织及血液,MAP1A在乳腺癌中上调表达,其作为孕酮受体的下游靶基因,可联合预测乳腺癌早期转移及不良预后事件的发生,从而作为乳腺癌潜在的内分泌治疗靶点。Jiang等[28]发现,在前列腺癌中,MAP1S和富含亮氨酸的三角状五肽重复结构蛋白(leucine rich pentatricopeptide repeat containing,LRPPRC)可以协同调控前列腺细胞自噬,作为前列腺癌患者预后的标志物。本研究显示,相比于癌旁正常前列腺组织,MAP1A蛋白在前列腺癌组织中的表达显著下调(P<0.001)。同时组织芯片结果显示,MAP1A在前列腺癌旁正常组织中阳性表达率为82.7%,在癌组织中表达率为58.6%,说明其可作为提高前列腺癌诊断率的一种辅助标志物。RT-qPCR结果进一步表明,MAP1A mRNA在正常前列腺组织中的表达显著高于前列腺癌组织,这说明MAP1A的异常表达在前列腺癌的发生、发展中可能扮演着重要的角色。但是因本资料入组样本有限,关于MAP1A在前列腺癌诊断中的价值及作用,还需要进行验证。因此笔者进一步使用TCGA数据库分析MAP1A的表达与前列腺癌患者临床病理学特征的关系,结果显示,MAP1A的表达与患者的年龄无关,但在不同Gleason评分(P<0.001)、临床病理分期(P=0.009)、转移(P=0.008)、总体生存率(P=0.049)的肿瘤组织中,差异具有统计学意义。MAP1A的表达越低,肿瘤分化越差、病理分期越晚,故恶性程度越高,同时肿瘤患者的远期生存率也越低。因此综上所述,笔者推测MAP1A在前列腺癌的发生、发展、侵袭和转移中可能发挥着重要的作用。
总之,本研究拓展了临床科研工作者对MAP1A在前列腺癌中的研究认识,MAP1A在前列腺肿瘤组织中表达显著下调,其表达与临床特征显著相关。通过对术后肿瘤组织中MAP1A的检测,可能有助于提高前列腺癌诊断的准确性并有效地区分惰性和侵袭性疾病,是对患者的预后评估及指导治疗的一个重要的潜在靶点,但这还需在未来进行大样本的临床验证。
