母亲产时发热伴新生儿感染的危险因素分析
2019-01-25张成强陆澄秋钱蓓倩汪吉梅
张成强 陆澄秋 钱蓓倩 汪吉梅
分娩人群中1.6%~14.6%有产时发热[1-3]。产时发热不仅增加了母亲静脉应用抗生素、器械助产和剖宫产的干预率,也增加了新生儿发生呼吸系统疾病、新生儿脑膜炎和围生期死亡的风险[4-7]。临床中如母亲产时发热,常将新生儿收入院进行感染评估并应用抗生素[8],这是由于母亲发热是绒毛膜羊膜炎的表现之一,而后者明显增加新生儿感染的风险[9]。也有学者[10,11]认为,母亲产时发热的病因与微生物感染无关。因此,对所有产时发热母亲的新生儿常规应用抗生素,可能并不合理。本研究通过回顾性分析母亲产时发热的新生儿,探讨其发生感染的危险因素,以期指导临床上早期评估和预测新生儿发生感染的风险,从而促进抗生素的合理使用。
1 方法
1.1 研究设计 病例对照研究。纳入在复旦大学附属妇产科医院(我院)建卡,且有母亲产时发热(体温峰值≥38℃)的新生儿,根据我院新生儿感染的诊断标准分为感染组和对照组,分析新生儿感染的危险因素。
1.2 母亲产时发热及其新生儿的临床处理常规
1.2.1 母亲 对合并胎膜早破的母亲,在第二产程开始前至少4 h进行抗感染治疗。诊断绒毛膜羊膜炎(诊断标准参考文献[12])者,均建议剖宫产。不符合绒毛膜羊膜炎诊断标准且无剖宫产指征者,均建议经阴道分娩试产,若试产失败,则转为剖宫产分娩。
1.2.2 新生儿 母亲产时发热分娩的新生儿常规转入新生儿科,予氨苄西林舒巴坦钠联合头孢噻肟钠(均100 mg·kg-1·d-1,q 12 h,静注)抗感染治疗,抗生素应用前均经桡动脉采血送血培养。动态监测血常规和CRP。未达到新生儿感染诊断标准的患儿,在生后48~72 h停用抗生素,留院观察,如血培养>72 h阴性且临床无感染征象,予以出院。诊断新生儿感染的病例予抗感染治疗5 d,血培养报告阴性且临床无感染表现,则出院随访。若血培养阳性,诊断早发性败血症,上述抗生素治疗14 d,待血培养转阴且无感染表现予以出院。
1.3 纳入标准 同时满足一下各项,①母亲在我院建卡,于2016年1月1日至2016年12月31日出生;②母亲产时发热转入我院新生儿科评估和行抗感染治疗;③胎龄≥37周;④单胎。
1.4 排除标准 ①母亲因急产院外分娩,产前自测体温≥38℃;②家长拒绝新生儿入院;③母亲入待产室前即有发热(体温≥37.5℃);④新生儿有遗传代谢性疾病(染色体疾病、临床表型明显异常和糖尿病等);⑤新生儿有呼吸困难表现(合并湿肺、胎粪吸入综合征和呼吸窘迫综合征等);⑥新生儿合并其他系统严重畸形,如危重先天性心脏病、巨大肝脏血管瘤和膈疝等。
1.5 新生儿感染诊断标准 生后12~24 h血常规WBC≥50×109·L-1和/或CRP≥20 mg·L-1;或生后24~48 h WBC≥30×109·L-1和/或CRP≥8 mg·L-1。新生儿在使用抗生素前采集0.5 mL桡动脉血进行培养,培养阳性者诊断为败血症。
1.6 分组 符合本文纳入和排除标准的新生儿,根据新生儿感染诊断标准的临床判断为新生儿感染并给予相应抗生素治疗的为病例组,余为对照组。
1.7 资料截取 从我院母亲产前体温单和入院病历记录中检索符合本文纳入和排除标准的病例的住院号,从住院信息系统提取母亲及其新生儿的病历,由双人截取以下资料并进行核对。①母亲的分娩方式,出院诊断;②新生儿性别、胎龄和出生体重等;③新生儿感染的可能危险因素[13]:母亲发热的体温值(取最高体温值),产前血WBC、CRP,分娩时麻醉方式,是否有B族链球菌(GBS)阳性、羊水Ⅲ°或羊水异味、胎膜早破是否>18 h。
1.8 统计学方法 使用SPSS17.0统计软件进行统计分析。非正态分布计量资料采用M(Q)表示,组间差异比较采用秩和检验; 计数资料采用频数及率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义
2 结果
2.1 一般情况 2016年1月1日至2016年12月31日在我院分娩18 125例活产新生儿,母亲产前发热(≥38℃)441例。图1显示,323例符合本文纳入和排除标准的新生儿进入分析。①323例母亲中,确诊绒毛膜羊膜炎39例,绒毛膜羊膜炎可能284例。②323例新生儿中,感染组123例,对照组200例;5例诊断新生儿败血症(1.54%,5/323),血培养3例为大肠埃希菌,1例为无乳链球菌,1例为缓症链球菌。323例均经氨苄西林/舒巴坦钠+头孢噻肟钠抗感染治疗后治愈出院。③感染组和对照组分别有88例(71.5%)和49例(24.5%)行剖宫产,宫腔培养阳性率分别为6.8%(6/88)和8.2%(4/49)。

图1研究对象的筛选流程图
2.2 围生期因素分析 表1显示,两组新生儿性别、胎龄和出生体重差异无统计学意义,感染组剖宫产率、母亲的体温峰值、产前WBC和CRP高于对照组(P均<0.05),两组的母亲硬膜外麻醉比例差异无统计学意义(P>0.05)。
2.3 多因素Logistic回归分析 以单因素分析中P<0.3 的指标为自变量,以是否患新生儿感染为因变量,表2显示,母亲体温峰值、产前WBC数、GBS阳性、羊水Ⅲ°或羊水异味、胎膜早破≥18 h均为新生儿感染的独立危险因素。
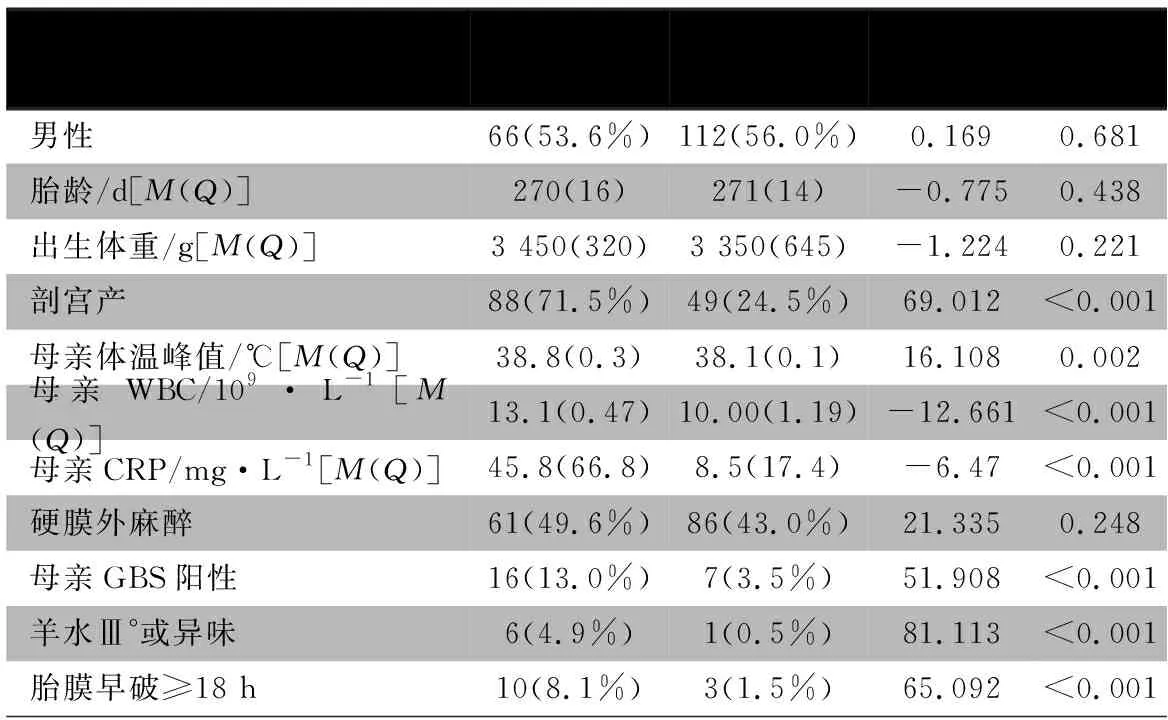
表1 感染组和对照组比较
注 GBS:B族链球菌

表2 新生儿感染发病因素的多因素分析
注 GBS:B族链球菌
3 讨论
母亲产时体温>38℃被认为是分娩期体温异常升高,为临床绒毛膜羊膜炎最重要的临床表现[14]。绒毛膜羊膜炎的诊断目前仍未达成共识,多以母亲发热(37.8~38℃)为首要条件,并合并以下临床表现中至少2项来诊断,①母亲心动过速(>100·min-1)、②母亲血WBC>15×109·L-1、③胎儿心动过速(>160·min-1)、④子宫压痛和羊水异味等[12,14]。临床上当母亲有产时发热或绒毛膜羊膜炎时,通常在新生儿分娩后行血培养并予静脉抗生素治疗,根据血培养结果决定是否停用抗生素[9]。美国CDC提倡,对于以产时发热为单独绒毛膜羊膜炎表现的新生儿,应积极收入院抗感染治疗并行血培养评估[8]。有学者认为,许多母亲发热的病因与微生物感染无关[15-17],且很多能引起绒毛膜羊膜炎的微生物并不会导致新生儿败血症[10,11],这是由于大多数绒毛膜羊膜炎的致病菌为厌氧菌,而后者很少导致新生儿早发性败血症[10,11,15];也有学者认为,真正的绒毛膜羊膜炎是母亲的炎症反应,40%的母亲分娩时不存在微生物感染[6]。
本研究中,母亲产前WBC数是新生儿感染的独立危险因素,提示母亲产前WBC升高为母亲存在明显细菌感染的证据,可以增加新生儿感染风险。本研究还发现,当母亲发热且合并其他感染高危因素(GBS阳性,羊水Ⅲ°或羊水异味,胎膜早破≥18 h)时,新生儿感染率亦明显升高,与文献报道相符[8]。
硬膜外麻醉目前在经阴道分娩的产妇中应用广泛,但其可致不明原因的发热[18],并掩盖子宫触痛,且麻醉药物会降低母亲和胎儿的心率[19]。基于以上原因,硬膜外麻醉可能会严重影响母亲绒毛膜羊膜炎的诊断。本研究中,感染组与对照组母亲接受硬膜外麻醉者分别占49.6%和43%,差异无统计学意义。多因素logistics回归分析显示,硬膜外麻醉并非感染的独立影响因素,提示硬膜外麻醉虽会使母亲产时发热的概率增加,但可能与新生儿感染无直接关系。
需要说明的是,目前尚无新生儿感染的统一标准。本研究通过动态监测新生儿生后12~48 h的血WBC和CRP,联合血培养作为诊断新生儿感染和败血症的指标。血培养虽然是诊断败血症的金标准,但其耗时长、血样本量少、采血时操作不规范以及抗菌治疗等均可导致假阴性率升高,增加了临床诊断的困难[20,21]。因此,临床上常结合WBC、CRP和降钙素原(PCT)等指标综合判断新生儿是否发生感染,对于临床表现不典型及围生期存在高危因素的新生儿,尤其是孕母有绒毛膜羊膜炎者,建议结合高危因素及实验室检查给予经验性抗生素治疗[20]。因新生儿血WBC在生后12 h内呈动态变化[20],且受母亲因素或诸多围生期因素影响,CRP与非感染性因素(如新生儿窒息、胎粪吸入综合征和溶血等)有关[22],因此,动态观察新生儿出生12 h后的WBC及CRP对诊断新生儿感染有参考意义。新生儿在生后3 d内PCT水平有生理性的升高,48~72 h可降至0.5 μg·L-1以下[23]。本研究中的新生儿均在生后当天入院,为排除PCT的生理性升高影响诊断,未行PCT检测。本研究中,母亲产时发热的新生儿中败血症发生率为1.54%(5/323),Braun等[24]报告≥35周、母亲产前有绒毛膜羊膜炎的新生儿败血症发生率为0.6%。
本文的局限性:①血培养标本仅留取0.5 mL,对于足月儿来说,标本量较少,可能影响败血症的检出率;②未常规留取胎盘标本进行病理检查,难以从病理上对绒毛膜羊膜炎进行确诊。
