冠心病P2Y12基因多态性与氯吡格雷抵抗的相关性研究
2019-01-24王珣张远恒张弛
王珣 张远恒 张弛
(1.武汉市第三医院心内科,湖北 武汉 430060;2.武汉科技大学附属普仁医院心内科,湖北 武汉 430081)
冠心病是临床常见的心血管疾病之一,近年来随着高血压、糖尿病等基础性疾病发病率的上升,冠心病的发病率也呈现出逐步上升的趋势。冠心病会导致患者不良心血管事件的发生。对冠心病患者进行介入治疗,能够改善患者的临床转归。氯吡格雷能够在改善冠心病介入治疗后的高凝状态等方面发挥积极作用,可有效降低介入术后血栓形成的风险[1-2]。不同等位基因位点的改变,会影响到冠心病介入治疗患者的远期抗血小板治疗效果、凝血功能障碍及继发性血小板性血栓的形成,进而影响到临床治疗结局[3-5]。为了揭示不同的等位基因多态性的改变对冠心病介入治疗后血小板抵抗的影响,本次研究选取300例冠心病介入治疗后采用氯吡格雷进行抗血小板治疗的患者作为研究对象,探讨P2Y12基因G52T多态性位点与氯吡格雷抵抗的关系。
1 资料与方法
1.1一般资料 选取2013年1月至2016年1月在我院进行介入治疗后采用氯吡格雷进行抗血小板治疗的冠心病患者300例为研究对象,根据血小板聚集率不同分为氯吡格雷抵抗组(抵抗组)43例、非氯吡格雷抵抗组(非抵抗组)257例。抵抗组中男25例、女18例;年龄48~79岁,平均(62.3±10.7)岁。非抵抗组中男140例、女117例,年龄44~79岁,平均(63.6±12.4)岁。纳入标准:(1)冠心病的诊断标准参考人民卫生出版社第八版《内科学》、美国心脏病协会(AHA)/美国心脏病学会(ACC)制定的相关标准;(2)患者经冠脉造影检查确诊为冠心病;(3)在我院接受介入治疗,采用氯吡格雷进行抗血小板治疗;(4)患者的临床基线资料完整。排除标准:(1)伴有肿瘤疾病者;(2)近一周使用GPⅡb/Ⅲa受体拮抗剂治疗者;(3)患者接受抗血小板治疗前的血小板计数<100×109/L;(4)伴有严重的心功能、肝肾功能障碍者;(4)伴有消化道出血、贫血者;(5)伴有甲状腺功能疾病者。两组患者的性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2收集资料及分组方法 收集所有纳入对象的年龄、性别、体质量指数(BMI)、吸烟史、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、甘油三酯(TG)、总胆固醇(TC)、糖化血红蛋白(HbA1c)、伴随疾病情况、冠脉病变支数。分组方法:ADP诱导的血小板聚集率较基线水平降低<10%或氯吡格雷维持治疗是血小板聚集率>50%的患者为氯吡格雷抵抗组。未达到上述标准的患者为非氯吡格雷抵抗组。
1.3P2Y12基因多态性检测 取冻存的血清保存液体,按照10 000 r/min的离心速度进行离心分离,每1 mL的TRIZOL试剂裂解的样品中加入0.2 mL的氯仿,进行裂解操作,4℃冰上采用无酶的RNA冲洗液进行洗涤,再次10 000 r/min离心5 min,得到RNA。混合液在加入逆转录酶MMLV 之前先70℃干浴3 min,取出后立即冰水浴至管内外温度一致,然后加逆转录酶0.5 μL,37℃水浴60 min,室温放置5 min使其完全溶解,使其逆转录为cDNA。以β-actin为模版,在反应体系中加入SYBR Green 1 染料、上游引物、下游引物、dNTP,使得总体积达20 μL,上机,反应条件为:93℃ 2 min、93℃ 1 min、55℃ 2 min,共40个循环。
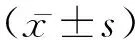
2 结 果
2.1两组患者的资料比较 两组患者的年龄、性别、吸烟率、HDL-C、TG、合并高血压疾病率、冠脉病变支数比较,差异均无统计学意义(P>0.05);抵抗组患者的LDL-C、TC、HbA1c、糖尿病合并率均显著的高于非抵抗组(P<0.05)。见表1。
表1 两组患者资料比较
2.2两组患者的P2Y12基因G52T多态性及等位基因频率比较 抵抗组患者的P2Y12基因G52T多态性中GT、TT显著高于非抵抗组,差异有统计学意义(P<0.05);抵抗组患者的等位基因频率T显著高于非抵抗组,差异有统计学意义(P<0.05)。见表2。
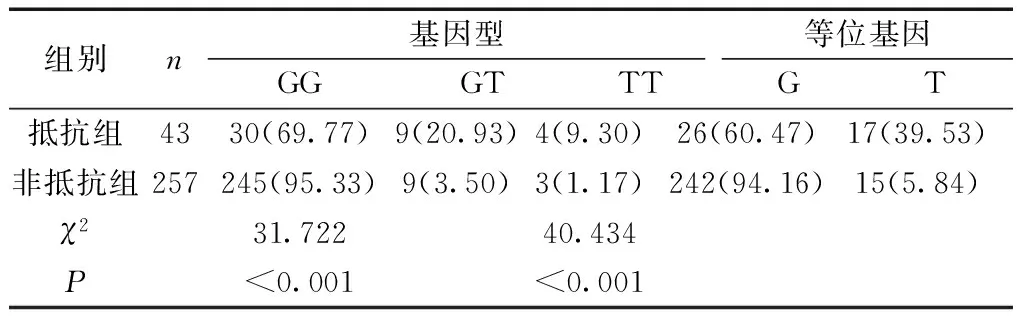
表2 两组患者的P2Y12基因G52T多态性及等位基因频率比较[n(%)]
2.3氯吡格雷抵抗与P2Y12基因G52T多态性的关系 以是否发生氯吡格雷抵抗作为因变量,P2Y12基因G52T多态性、LDL-C、TC、糖尿病合并率作为自变量进行Logistic回归分析,结果显示:P2Y12基因G52T位点GT、TT频率增高OR(95%CI)=2.048(1.574~7.028)(P<0.05),合并糖尿病是氯吡格雷抵抗的危险因素OR(95%CI)=1.776(1.309~4.881)(P<0.05)。见表3。
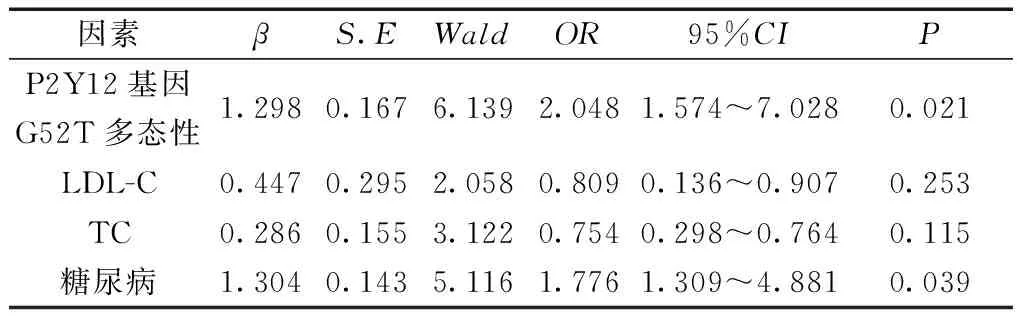
表3 氯吡格雷抵抗与P2Y12基因G52T多态性Logistic回归分析
3 讨 论
冠心病是由于心脏血管血流供应障碍导致心肌细胞的缺血性坏死,从而致使心血管系统发生难以逆转的病理改变。氯吡格雷抗血小板治疗,一方面能够改善患者血小板高凝状态导致的继发性血栓的形成,另一方面可以改善局部内皮损伤或者冠心病本身等高危因素导致的血栓形成。但较高的血小板抵抗仍然是目前临床上影响氯吡格雷治疗效果的主要因素,过高的血小板抵抗加剧了患者心血管系统不良临床预后的发生[6-7]。
P2Y12基因是影响血小板聚集或者表面活化的重要因素,过度的P2Y12基因的激活,可以对患者的血小板的富集或者纤维蛋白的交锁等发挥作用。而P2Y12基因多态性可以影响半胱氨酸及含巯基氨基酸的代谢,导致中间代谢产物的上升,并影响到血小板聚集的程度,促进血小板性血栓的形成,并可影响到血小板的稳定性,促进血栓脱落[8-9]。同时,P2Y12基因多态性可以引起TG、TC及HDL等血脂指标的代谢异常,增加血小板表面活化因子b的合成,促进了血小板表面蛋白ⅡB的表达,促进了血小板抵抗的形成[10-11]。已有的研究探讨了其他位点的多态性对于氯吡格雷抵抗的影响的,但迄今为止缺乏对于P2Y12基因G52T多态性的相关研究。
在发生氯吡格雷抵抗的患者血清中,可以通过RNA相关检测技术发现P2Y12基因G52T多态性存在明显的等位基因的表达差异,其中P2Y12基因G52T多态性GT或者TT等位基因的表达差异较为明显,明显高于氯吡格雷非抵抗组,提示GT或者TT等位基因的问题可能影响到了氯吡格雷抗血小板的临床效果,从机制上考虑,P2Y12基因G52T多态性的GT或者TT等位基因的差异,可以通过影响下列几个方面的机制导致氯吡格雷抵抗的发生[12-13]:(1)GT或者TT的高表达,促进了P2Y12蛋白翻译过程中末端巯基结构的合成或者修饰,导致P2Y12蛋白的四级空间结构受到了一定的影响;(2)GT或者TT的高表达,能够在影响局部血小板表面蛋白IIB或者IA的配体结合活性,或者加剧血小板的粘附能力等方面形成一定的生理效果,从而影响血小板抵抗的发生。刑元[14],吴小利等[15]研究者在探讨了大样本量的临床多中心临床数据后发现,发生氯吡格雷抵抗的患者中,相关等位基因的表达差异较为明显,特别是等位基因GT的表达增加,促进了患者氯吡格雷的高剂量或者长时间治疗结局的发生,加剧了氯吡格雷抵抗的发生风险。在探讨其他因素对于氯吡格雷抵抗的影响过程中发现,抵抗组患者的血清中可以发现其具有明显的血脂或者血糖代谢紊乱,特别是LDL-C、TC、HbA1c等可能在影响氯吡格雷的半衰期或者氯吡格雷的肝脏代谢等方面发挥作用,促进患者氯吡格雷治疗过程中抵抗的发生。最后,相关的危险因素回归分析也可见,GT、TT频率增高、合并糖尿病及血脂异常是影响氯吡格雷抵抗的主要因素,进一步提示了等位基因的表达差异对于氯吡格雷抵抗的影响。
