小桐子CDPK及相关激酶基因家族的 全基因组鉴定及表达分析
2019-01-24王海波郭俊云代冬琴唐利洲
王海波,郭俊云,辛 胡,刘 潮,高 永,代冬琴,唐利洲
(1.曲靖师范学院 云南高原生物资源保护与利用研究中心,云南省高校云贵高原动植物遗传多样性及生态适应性进化 重点实验室,生物资源与食品工程学院,云南曲靖 655011;2.西南林业大学 林学院,昆明 650224)
在植物的整个生命周期中,受到外界多种生物与非生物环境因素的影响,在长期的进化中,植物形成了一套复杂的网络信号系统,经过胞外信号感知、膜上信号转换、胞内信号转导,及基因表达与蛋白活性可逆调控,以适应多变的外界环境[1]。Ca2+作为第二信使,在植物信号转导途径中发挥重要作用,在植物体中多种信号途径都会促发胞内Ca2+浓度的变化,进而通过钙信号感应器(CDPK-SnRK超家族)将信号传递至下游级联系统,包括:钙依赖蛋白激酶(Calcium-dependent protein kinase,CDPK/CPK)、钙依赖蛋白激酶相关激酶(CDPK-related protein kinase,CRK)、磷酸烯醇式丙酮酸羧化酶激酶(Phosphoenolpyruvate carboxylase kinase,PPCK)、磷酸烯醇式丙酮酸羧化酶激酶相关激酶(PEP carboxylase kinase-related kinase,PEPRK)及钙与钙调素依赖蛋白激酶(Calcium and calmodulin-dependent protein kinase,CCaMK)等[2-4]。CDPK是植物与部分原生生物(Protozoa)特有的一类丝氨酸/苏氨酸蛋白激酶,作为典型的Ca2+传感器,可不需要钙调素(Calmodulin,CaM)而被Ca2+直接激活[5]。典型的植物CDPK蛋白属于单体蛋白,仅由1条多肽链组成,从N端到C端包含4个结构域(功能区),即N端可变区[包含豆蔻酰化(Myristoylation)与棕榈酰化(Palmitoylation)位点]、具有催化活性的Ser/Thr蛋白激酶区、活性控制的自抑制连接区以及包含2~4个EF-hand基序负责结合Ca2+的CaM调控区[6-7]。催化区由约300个氨基酸残基组成,具有典型的Ser/Thr蛋白激酶结构域,且不同物种中同源性较高。自抑制连接区由20~30个氨基酸残基组成,在没有Ca2+存在时,负责结合催化区的激酶结构域从而抑制其活性。调控区通过2~4个结合Ca2+的EF hands基序控制自抑制区的抑制活性[8]。CDPK调控区通过结合Ca2+解除自抑区对激酶区的抑制作用从而激活CDPK的活性,特别的独特结构使其同时具有Ca2+感应器与效应器的功能,在Ca2+信号转导过程中发挥核心作用。另外,CRK未鉴定到自抑区以及调控区的EF-hand基序,而CCaMK的自抑区与钙及钙调素结合结构域重叠,且调控区仅包含3个EF-hand基序,PPCK与PEPRK都包含激酶结构域,而PEPRK在N端与C端还包含可变区,但两者都没有结合Ca2+的EF-hand基序[7-9]。
研究表明,CDPK在植物的大部分器官中都有分布,且参与植物生长发育的大部分过程,如细胞骨架建成、气孔运动、小分子跨膜转运、碳氮代谢以及生物与非生物胁迫响应等。目前,已经对许多植物从全基因组水平进行CDPK及相关基因家族鉴定,CDPK基因家族包括拟南芥34个[8]、水稻31个[9]、玉米40个[10]、杨树30个[11],CRK基因家族包括拟南芥8个[12]、水稻5个[9]、杨树9个[11]、番茄6个[13];另外,在拟南芥中分别鉴定到PPCK、PEPRK、CCaMK基因2、2、0个[8],对应水稻中包括0、2、1个[9]。小桐子(JatrophacurcasL.)属大戟科(Euphorbiaceae)麻疯树属(Jatropha)落叶灌木或小乔木,作为世界公认的具有巨大开发潜力的能源树种,其种子含油量高、品质好,是加工生物柴油的优质原料,具有广阔的开发利用前景。日本Kazusa DNA研究所在2011年公布小桐子基因组测序数据[14],为从基因组水平上分析小桐子CDPK及相关激酶基因家族提供条件。本研究对小桐子CDPK及相关激酶基因家族从全基因组水平进行鉴定,并对其序列特征、进化关系及表达特性进行分析,为进一步研究CDPK及相关激酶家族基因的功能奠定基础。
1 材料与方法
1.1 小桐子CDPK及相关激酶基因家族的鉴定
根据Cheng等[12]鉴定的模式植物拟南芥的CDPK及相关激酶基因家族登录号,从拟南芥TAIR数据库(https://www.arabidopsis.org/)下载拟南芥34个CDPK基因、8个CRK基因、2个PPCK基因、2个PEPRK基因以及水稻的1个CCaMK基因[9]蛋白质序列,通过ClustalX进行多重序列比对,利用Hmmer 3.0软件的Hmmbuild程序将比对文件生成CDPK结构域的隐马可夫HMM模型,同时,从GenBank下载小桐子最新注释蛋白质数据库。基于以上模型,利用Hmmer 3.0软件的Hmmsearch程序对小桐子蛋白质数据库进行检索(参数设置:阈值E<1e-10,序列相似性>50%),得到候选的小桐子CDPK及相关激酶蛋白质序列,利用Excel脚本去除重复序列。将非冗余的候选序列利用Pfam与CDD在线工具进行CDPK激酶结构域分析,得到最终的小桐子CDPK及相关激酶家族蛋白质序列。
1.2 小桐子CDPK及相关激酶家族基因及蛋白质的特征分析
根据鉴定的小桐子CDPK及相关激酶蛋白质登录号,从GenBank下载其对应的基因序列、mRNA序列以及CDS(Coding sequence,CDS)序列。利用ProtParam工具(http://web.expasy.org/protparam/)对CDPK及相关激酶蛋白质进行氨基酸数目、理论分子质量(Mw)、等电点(pI)等基本参数的分析。亚细胞定位采用CELLO服务器V2.5(http://cello.life.nctu.edu.tw/)进行鉴定。利用PROSITE(http://prosite.expasy.org/)在线分析工具对CDPK及相关激酶蛋白质序列进行motif分析。利用ClustalX(Version 2.0)进行序列相似性比对,然后用MEGA 6.0软件通过邻接法(NJ)构建系统进化树,并采用自展法(Bootstrap)进行检验。利用GenDOC软件对ClustalX比对结果进行CDPK及相关激酶蛋白的保守结构域分析。通过CDS序列与基因序列比对以确定基因内含子与外显子的结构,并利用GSDS(Gene Structure Display Server,http://gsds.cbi.pku.edu.cn/)绘制基因结构图。另外,染色体定位以Wu等[15]构建的小桐子遗传连锁图谱进行锚定,并通过MapChart(Version 2.1)绘制基因定位图。
1.3 小桐子CDPK及相关激酶家族基因的表达分析
从GenBank的SRA数据库下载小桐子不同器官的Illumina高通量测序数据(叶片SRR1639660、根SRR1639659、种子SRR1639661)。通过Bowtie2与Samtools工具将鉴定到的小桐子CDPK及相关激酶家族基因与测序数据进行比对,得到各CDPK及相关激酶基因的表达reads数据,之后通过Cufflinks程序计算每个基因的表达量FPKM(Fragments Per Kilobase per Million)值,进行以2为底的对数转化,并设置以基因与器官同时进行聚类,聚类方法选择层次聚类法(Hierarchical Clustering)。另外,将鉴定的小桐子CDPK及相关激酶家族基因序列对低温转录组数据[16]进行比对,通过编号得到各基因在对照与12 ℃低温处理12、24及48 h的低温数字基因表达谱(Digital Gene Expression,DGE)[17]中的原始表达标签CleanTaq数据,进一步通过TPM(Transcript per Million Clean Tags)获得标准化的基因表达量[18-19],经过log2(处理TPM/对照TPM)转化,得到小桐子CDPK及相关激酶家族基因在低温处理下的差异表达数据。利用R软件(Version 3.4.1)的gplots与pheatmap函数进行聚类分析及热图(heatmap)的绘制。
2 结果与分析
2.1 小桐子CDPK及相关激酶基因家族的鉴定与序列特征
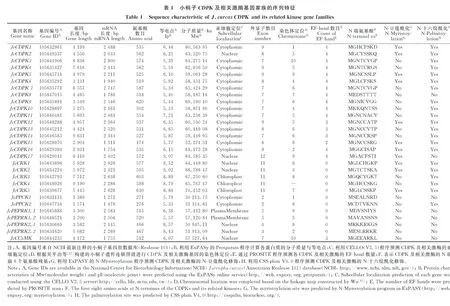
在小桐子全基因组共鉴定到17个CDPK基因,分别命名为JcCDPK1-JcCDPK17,5个CRK基因(JcCRK1-JcCRK5)、2个PPCK基因(JcPPCK1、JcPPCK2)、4个PEPRK基因(JcPEPRK1.1、JcPEPRK1.2、JcPEPRK2.1、JcPEPRK2.2)及1个CCaMK基因(JcCCaMK)(表1)。理化参数分析结果表明,小桐子JcPPCK1与JcPPCK2基因(1 389 bp、1 574 bp)与蛋白(271 aa、276 aa)序列较短,CDPK及相关激酶基因长度分布在2 904(JcCDPK15)~9 631(JcCDPK14)bp,蛋白序列长度分布在466(JcPEPRK2.1)~630(JcCRK5)aa。其中,等电点有明显的家族特异性,CDPK基因家族的Ⅰ、Ⅱ及Ⅲ亚族、PPCK基因家族Ⅰ亚族、CCaMK基因家族成员的等电点都偏酸性与中性,分布在5.31(JcCDPK10)~7.21(JcCDPK11),而CDPK基因家族的Ⅳ亚族、CRK基因家族及PPCK基因家族Ⅱ亚族都偏碱性,分布在8.43(JcPEPRK2.2)~9.02(JcCDPK17)。CELLO亚细胞定位显示,小桐子CDPK基因家族主要定位细胞质(15个)、其次为细胞核(2个,JcCDPK2与JcCDPK17),CRK基因家族定位细胞核与叶绿体,PPCK基因家族都定位细胞质,PEPRK基因家族定位细胞核与细胞膜,而CCaMK定位细胞核。
2.2 小桐子CDPK及相关激酶基因家族的系统进化与基因结构
根据Harbak等[8]关于拟南芥CDPK及相关激酶基因家族的分类标准,通过MEGA构建小桐子与拟南芥CDPK及相关激酶基因家族进化树(图1、图2),可见小桐子与拟南芥聚类结果(图1)与小桐子单独聚类结果(图2)完全吻合,小桐子CDPK基因家族也聚类为Ⅰ、Ⅱ、Ⅲ、Ⅳ 4个亚族,基因数量分别为6、5、6、1,较拟南芥对应亚族基因10、13、8、3数量少,其中第Ⅳ亚族只有JcCDPK17基因。另外,小桐子CRK、PPCK及PEPRK基因家族分别鉴定到5、2、4个基因,对应拟南芥中包含8、2、2个基因,CCaMK基因家族在拟南芥中未发现,而在小桐子中鉴定到1个对应JcCCaMK基因,与Asano等[9]在水稻中鉴定到OsCCaMK1(GenBank登录号:AC097175)的报道一致。
结合小桐子29个CDPK及相关激酶家族的聚类结果,基因结构分析显示,小桐子CDPK基因家族除Ⅳ亚族JcCDPK17包含12个外显子外,其他3个亚族都包含6~9个外显子(图2、表1),且首尾外显子都与5-UTR与3-UTR区域重合,中间为分散且长度较短的外显子。其中,Ⅰ亚族除JcCDPK4(9个外显子),都包含7个外显子,且都鉴定到5-UTR与3-UTR区域;Ⅱ亚族除JcCDPK15(6个外显子),都包含8~9个外显子,而JcCDPK2与JcCDPK15分别缺失5-UTR与3-UTR区域;Ⅲ亚族包含7~9个外显子,而JcCDPK16缺失5-UTR区域。同时,小桐子CRK基因家族成员都包含11个外显子,且外显子分布规律完全一致,PPCK基因家族成员都包含2个外显子,PEPRK基因家族包含3~5个外显子,且Ⅰ(JcPEPRK1.1、JcPEPRK1.2)与Ⅱ(JcPEPRK2.1、JcPEPRK2.2)亚族成员基因结构一致,而CCaMK基因家族的唯一成员JcCCaMK包含7个外显子。

黑色圆点表示Bootstrap检验值的大小 Bootstrap values were represented by black dots

图2 小桐子CDPK及相关激酶基因家族的基因结构Fig.2 Gene structure of J.curcas CDPK and its related kinase genes family
2.3 小桐子CDPK及相关激酶氨基酸序列分析
为了分析小桐子CDPK及相关激酶的保守序列,通过多序列比对鉴定到小桐子CDPK家族成员的N-端可变区、激酶结构区、自抑区及EF-hand调控区4个保守结构域以及其他激酶成员的激酶结构域。其中,N-端可变区氨基酸序列整体变化较大,而前8个氨基酸残基相对保守,PROSITE分析显示该区域是与CDPK及相关激酶修饰调控相关的序列,通过ExPASY的N-Myristoylation与CSS-plam 4.0工具分析29个小桐子CDPK及相关激酶表明,有21个鉴定到与N-豆蔻酰化(N-Myristoylation)修饰相关的核心氨基酸残基Cys,其中11个可能会发生N-豆蔻酰化修饰,另外,有24个可能会发生N-十六烷酰化(N-Palmitoylation)修饰(表1)。
CDPK及相关激酶都包含约300aa的核心激酶结构域,多序列比对结果表明,小桐子CDPK的激酶结构域保守性较高,鉴定到与CDPK激酶催化相关的保守序列C-E/A-G-G-E-L-F-D-R-I、H-R-D-L-K-P-E-N-F-L-F/L、D/E-V/I-V-G-S-P/A-Y-Y、A-P-E-V-L、D-V-W-S、G-V-M/I-L-Y-I-L-L、G-V-P-P-F-W、P-W-P-x-V/I-S、A-K-D-L-V以及H-P-W[20](图3),以及催化活性中心的核心氨基酸残基Asp(图3三角形所示)。

实线表示激酶结构域的保守基序,三角形表示激酶结构域的催化核心Asp残基 Solid line indicates conserved motifs in kinase domain ofJ.curcasCDPK,the triangle indicates the core catalytic Asp residue in the kinase domain
图3小桐子CDPK激酶结构域多序列比对
Fig.3MultiplealignmentforconservedkinasedomainofJ.curcasCDPK
CDPK激酶调控区的EF-hand基序通过结合Ca2+从而解除自抑区对激酶结构域的抑制作用,其中,Ca2+主要结合EF-hand基序的Asp(D)或Glu(E),在小桐子CDPK激酶的调控区也鉴定到4个保守EF-hand基序(1st、2nd、3rd、4th EF-hand),以及对应的4个保守的序列D-x-D(图4三角形所示),另外发现每个EF-hand基序的保守D-x-D序列之后都包含富含Glu(E)的一段保守序列E-E-L-K(1st EF-hand)、E-E-I/L-A/T(2nd EF-hand)、D/E-E-L(3rd EF-hand)以及E-F-A/V-T/A-M-M(4th EF-hand)(图4)。

虚线表示自抑区,实线表示4个EF-hand保守基序;双实线表示EF-hand基序的核心序列;三角形表示EF-hand基序的保守D-x-D残基 Dotted and solid lines show conserved motifs of auto-inhibitory and EF-hands ofJ.curcasCDP,respectively,the double lines and the triangles represent the core sequences and the conserved D-x-D residues in the EF-hand,respectively
图4小桐子CDPK自抑区与EF-hand区多序列比对
Fig.4Multiplealignmentforconserveddomainsandmotifsinauto-inhibitoryandEF-handregionsofJ.curcasCDPK
2.4 小桐子CDPK及相关激酶基因家族染色体定位
依据Wu等[15]构建的小桐子高密度遗传连锁图谱,在染色体水平定位每个小桐子CDPK及相关激酶基因,结果表明,除11号染色体没有基因分布外,28个小桐子CDPK及相关激酶基因(JcCRK4基因没有染色体定位信息)不均匀地分布于其余10条染色体上,其中,6号染色体上的基因数量最多(6个),且发现该基因家族的串联复制基因JcCDPK7/JcCDPK9,而1、2、3、4、7及10号染色体上的基因较少,各包含2个(图5)。
2.5 小桐子CDPK及相关激酶家族基因的表达分析
基于小桐子叶片、根及种子转录组测序数据,得到小桐子29个CDPK及相关激酶基因的表达数据(图6)。结果表明,29个CDPK及相关激酶基因,在叶片、根及种子中有24个基因都有表达,而3个基因都未鉴定到表达。其中,JcCDPK1、JcCDPK4、JcCDPK8、JcCDPK13及JcPEPRK1.2在3种器官中表达量都较高(log2FPKM>4.0),但JcCDPK9、JcCDPK15及JcCDPK16在3个器官中都没有表达(log2FPKM<0)。其他基因存在器官表达特异性,在叶片、根及种子中表达量最高的基因分别为JcCDPK13、JcCDPK4及JcPEPRK2.2。另外,JcCDPK7在叶片与种子中有表达,而在根中不表达,JcCCaMK在根中有表达,而在叶片与种子中没有表达。

竖线表示基因串联复制 Vertical line indicates tandem duplication;刻度表示厘摩 Scale is in centiMorgans (cM);LG表示染色体 Chromosome
图5小桐子CDPK及相关激酶家族基因的染色体定位
Fig.5ChromosomaldistributionofJ.curcasCDPKanditsrelatedgenefamily
通过DGE数据分析得到11个小桐子CDPK及相关激酶家族基因在低温处理条件下的表达数据(图7)。与对照相比,JcCDPK3在低温胁迫12、24及48 h时都上调表达显著,而JcPEPRK1.1与JcPEPRK2.2仅在低温胁迫24 h上调表达显著。另外,随着低温胁迫时间的延长,JcCDPK11、JcCRK3及JcCCaMK的表达量呈连续上升的趋势,在低温胁迫48 h时,表达量分别较对照提高4.23、7.41和2.25倍。聚类热图显示,其他基因也属于低温诱导表达基因,其中,JcCDPK1在低温胁迫24 h达到最大表达量,较对照提高1.56倍,而JcCDPK13、JcCDPK17、JcPPCK1及JcPPCK2都表现出2次上调表达峰值,分别在低温胁迫48 h、12 h、48 h及12 h达到最大表达量。

图6 小桐子CDPK及相关激酶家族基因的器官差异表达分析Fig.6 Differential expression of J.curcas CDPK and its related kinase gene family in different organs
3 讨 论
有文献[21]报道,在藻类与陆生植物分化之前CDPK家族基因就已经分为4个亚族。双子叶植物拟南芥[8]、杨树[11]及小桐子,单子叶植物水稻[9]与玉米[10]的CDPK家族基因进化分析结果也聚类为4个亚族,暗示CDPK基因功能的分化也是在单、双子叶植物分化之前就已经完成。另外,CDPK属多基因家族,不同物种中数量差异较大,如单子叶植物水稻31个[9]、玉米40个[10],双子叶植物拟南芥34个[8]、杨树30个[11]、草莓15个[22]、桃15个[23]。本研究鉴定的小桐子CDPK基因17个。从以上基因数量可以看出,CDPK家族基因在不同物种之间存在2倍关系。据报道[24],在显花植物进化中,全基因复制事件是导致基因家族成员数目增加的重要途径。以上结果也表明,大部分单子叶植物与部分双子叶植物经历了一次全基因组复制事件,而双子叶植物只有少数发生以上事件,且是在单双子叶植物分化之后发生的,说明小桐子CDPK家族基因在单双子叶植物分化之前就已聚为4类不同功能的亚族,而分化之后,未发生全基因组复制事件。另外,在经历全基因组复制的物种中还发现大量基因片段复制现象(Tandem duplication),如水稻的OsCPK25/26(相似性99.6%)、OsCPK3/16(91.9%)、OsCPK2/14(86.8%)、OsCPK24/28(86.5%)及OsCPK1/15(86.2%)[9],杨树的PtCDPK2/3(相似性93.0%)、PtCDPK5/6(93.0%)、PtCDPK10/11(93.0%)、PtCDPK25/26(93.0%)、PtCCaMK1/2(93.0%)[11]等,而在双子叶植物小桐子中只鉴定到JcCDPK7/JcCDPK9一对基因复制,也证明CDPK基因数量较多的植物在进化中大部分发生了全基因组复制事件,导致大量相似性较高的CDPK基因出现,而未发生复制事件的植物如小桐子只有极少数的基因片段复制。另外,CRK、PEPRK基因家族在拟南芥[8]、水稻[9]与小桐子基因组中都有分布,而PPCK与CCaMK基因家族存在物种特异性,如PPCK基因家族在拟南芥与小桐子中都包含2个成员,而水稻中未鉴定到[9],CCaMK基因家族在水稻与小桐子中都包含1个成员,而在拟南芥中未鉴定到[8]。
转录组表达数据显示,小桐子CDPK及相关激酶基因有3种器官表达模式,第1类有显著的器官表达特异性,如小桐子JcCDPK7在叶片与种子表达,而在根中没有表达,JcCaMK在根中有表达,而在叶片与种子没有表达,相同的研究结果在其他物种也有报道,如烟草NtCDPK1的转录本存在于茎、根及花中,而在叶片中未检测到[25],小麦TaCPK13在叶片、幼穗及未成熟的种子中表达,而在根与茎中不表达[26]。第2类在不同的器官中没有显著表达差异,如小桐子JcCDPK1、JcCDPK4、JcCDPK13、JcCRK1及JcCRK5在考察的3种器官中表达量基本一致,类似研究如番茄LeCDPK1在叶片、茎、根及花中表达量基本相同,小麦TaCPK2在叶片、茎、根、幼穗及未成熟的种子中表达量没有差异[26]。另外,鉴定发现JcCDPK15与JcCDPK16在小桐子不同器官中都未表达。第3类为所有器官都有表达,但存在表达差异性,如蚕豆VfCPK1在各个器官都有表达,但在下表皮和叶片中的表达量显著高于茎与根[27],而小桐子的JcPPCK1在叶片、根及种子中都有表达,但叶片的表达量高于种子,JcCDPK14与JcPEPRK1.1在根与种子中表达量较高,而在叶片中较低(图6)。以上3种表达模式暗示,部分小桐子CDPK及相关激酶基因属于看家基因,在所有器官中都发挥作用,且可能参与大部分代谢途径或信号转导过程;相反,部分基因在特异器官或全部器官中都未见表达,推测可能是表达基因的同源基因,也可能是通过生物或非生物因子诱导才能表达的基因。同时,多数CDPK及相关激酶基因与植物逆境信号转导相关。Sheen[28]发现拟南芥AtCDPK1与AtCDPK1a在干旱与盐胁迫下表达量显著上调。而本研究中JcCDPK3、JcCDPK11、JcCRK3及JcCCaMK在低温胁迫下表达量增加明显,属于小桐子抗冷性及低温信号转导相关的基因(图7)。

图7 小桐子CDPK及相关激酶家族基因的低温胁迫表达分析Fig.7 Expression profiles of J.curcas CDPK and its related kinase gene family under chilling stress
