肝癌组织IFITM3蛋白表达水平及其与肝细胞癌患者手术切除术后肝内肿瘤复发的相关性分析*
2019-01-23代晓楠吕金燕翁文采郑丽丽
代晓楠,吕金燕,翁文采,郑丽丽
肝细胞癌(hepatocellular carcinoma,HCC)是我国最为常见的一种恶性程度很高的恶性肿瘤[1]。调查显示,大多数肝癌很容易发生肝内或远处器官肿瘤转移,即便是在能接受手术切除治疗的早期患者,术后3 a复发率也超过50%[2,3]。因此,针对肝癌复发和转移机制的研究一直是医学界关注的热点。研究指出,肿瘤的转移是一个由多基因参与的过程,涉及多步骤和多环节,每个阶段都会受到一个或多个基因/蛋白的调控,而干扰素诱导跨膜蛋白(interferon-induced transmembrane protein,IFITM3)基因家族成员就在其中发挥着重要的作用[4,5]。IFTIM3基因是IFITM家族中的一员,有研究证实该基因编码的蛋白参与了结肠癌和乳腺癌等恶性肿瘤的发生和发展,但有关其在肝癌转移复发中的作用及具体机制尚未形成明确的认知[6,7]。本研究采用Western blot法和免疫组化(SP)法检测了肝癌组织IFITM3蛋白表达情况,现将结果报道如下。
1 资料与方法
1.1 一般资料 2015年4月~2016年2月在我院接受根治性手术切除治疗的HCC患者43例,男性31例,女性12例;年龄43~76岁,平均年龄(55.63±3.92)岁。根据全国第四届肝脏外科学会会议修订的HCC诊断标准诊断,且经术后组织病理学检查证实。其中伴随肝内卫星转移灶者29例,无肝内转移灶者14例;低分化癌21例,中分化癌11例,中高分化癌11例。所有患者均为首次发病,手术前未接受过任何放化疗。术中取肝癌组织和距离肿瘤2 cm以上的癌旁组织,置于液氮中保存。本研究获得医院医学伦理委员会批准,患者均签署知情同意书。
1.2 主要仪器与试剂 BX41型显微镜(OLYPMPUS,日本),YSP-300生物组织自动脱水机(Leica,德国),紫外可见分光光度计(Pharmacia Biotech,美国),免疫组化染色抗体孵育盒(中杉,中国),Western blot垂直电泳仪(Eppendorf,德国),荧光定量 PCR 分析仪 7500(ABI,美国),CO2恒温培养箱(医用设备有限公司,中国)。兔抗人 IFITM3蛋白多克隆抗体和鼠抗人 β-catin蛋白单克隆抗体(Proteintech,美国),酶标羊抗鼠 IgG 聚合物、辣根过氧化物酶标记山羊抗小鼠 IgG、DAB显色试剂盒(中杉,中国),苏木素(上海化学试剂有限公司),Western Blot制胶盒和胶片(长城生物技术有限公司),PBS缓冲液(福州迈新生物技术开发有限公司),两步法蛋白提取试剂盒(北京普利莱生物技术有限公司),SDS-PAGE凝胶配制试剂盒、Western一抗稀释液(江苏碧云天)。
1.3 组织IFITM蛋白表达检测 采用Western blotting法,取剪碎后的癌组织和癌旁组织,加入RIPA裂解液,收集组织蛋白,采用BCA法检测总蛋白浓度。将等量的总蛋白加入各孔中进行垂直电泳,卸胶,转膜,用三蒸水漂洗,在封闭液中摇床封闭2 h,以β-actin作为内参照。三蒸水漂洗,加入一抗稀释液,4℃下过夜,室温下加TBST,摇床上清洗,10 min×3次;加TBST漂洗从一抗中取出的膜,10 min×3次,加入二抗稀释液,室温下孵育2 h,室温下在摇床上TBST清洗,10 min×3次;采用HRP-ECL发光法显影。对显影的条带进行拍照,读取IFITM和β-actin灰度值,计算两者的灰度值比。另采用SP法检测,取经福尔马林固定的癌组织和癌旁组织,石蜡包埋、切片,置于60℃烘箱中烤片过夜,室温下将切片置于3%O2H2孵育20 min,PBS冲洗3次,每次间隔3 min。加入一抗50μl,37℃下孵育25 min,PBS冲洗3次,每次间隔3 min;加入二抗50μl,室温下孵育25 min,PBS冲洗3次,每次间隔3 min;加入DAB显色剂50μl显色2 min,自来水冲洗,蒸馏水冲洗,苏木素复染2 min,PBS返蓝1 min,酒精脱水2 s,干燥后用中性树胶封片。判断IFITM3阳性细胞标准:胞质呈棕黄色颗粒状为IFITM阳性染色细胞。在400倍显微镜下判断免疫组化检测结果,随机选择每张切片的5个视野进行观察,计算细胞阳性率和染色强度。由两名病理科医生采用双盲法对每张切片进行观察阅片,取平均值。
1.4 随访 所有入选患者均接受根治性手术切除肿瘤,随访1年,术后每3个月检测血清甲胎蛋白(AFP),行腹部B超检查。当发现肝内有可疑的占位性病灶时,则进行腹部CT检查,根据检查结果确认复发。
1.5 统计学分析 应用SPSS 23.0软件包进行统计学处理,计量资料以±s描述,采用配对资料的t检验,IFITM3蛋白表达阳性率的比较采用x2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 肝癌组织和癌旁组织IFITM3蛋白的表达情况 Western Blot法检测结果显示肝癌组织IFITM3表达水平为(1.2386±0.1901),显著强于癌旁组织的(0.9496±0.0995),差异显著(t=8.832,P=0.000)。此外,不同肿瘤大小、TNM分期、有无肝内卫星转移灶肿瘤间IFITM3表达水平存在显著性差异(P<0.05),而在不同性别、年龄和血清AFP水平患者间比较无显著性差异(P>0.05,表1)。经免疫组化法检测肝癌组织和癌旁组织IFITM3表达,可见IFITM3阳性细胞浆呈棕黄色颗粒状,其中肝癌组织IFITM3蛋白表达阳性率为72.1%(31/43),显著高于癌旁组织的 14.0%(6/43,x2=29.647,P=0.000)。此外,中分化肝癌组织IFITM3蛋白阳性率为90.9%(10/11),低分化肝癌组织为 95.2%(20/21),均明显高于高分化组的9.1%(1/11,x2=14.727,P=0.000;x2=23.748,P=0.000);伴肝内转移组患者 IFITM3蛋白阳性率为93.1%(27/29),而不伴肝内转移组为28.6%(4/14),两者比较差异显著(x2=19.544,P=0.000,图1、图2)。
表1 不同临床和病理学特征患者肝癌组织IFTIM3表达水平(±s)比较

表1 不同临床和病理学特征患者肝癌组织IFTIM3表达水平(±s)比较
例数 IFITM3/β-actin t P性别 1.528 0.134男31 1.3199±0.1362女12 1.2394±0.1971年龄(岁) 0.695 0.491>50 30 1.2651±0.1994≤50 13 1.2213±0.1639 AFP(μg/l) 1.424 0.162>400 19 1.2014±0.1761≤400 24 1.2869±0.2094肝内转移 24.053 0.000有29 1.4936±0.0337无14 1.1093±0.0718 TNM分期 7.825 0.000Ⅰ/Ⅱ期 14 1.0996±0.0573Ⅲ/Ⅳ期 29 1.4002±0.1374肿瘤直径(cm) 8.310 0.000≤5 17 1.1032±0.0617>5 26 1.4025±0.1394

图1 肝癌组织IFITM3蛋白表达情况(SP,400×)
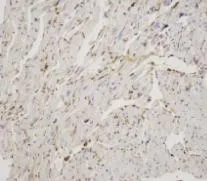
图2 癌旁组织IFITM3蛋白表达情况(SP,400×)
2.2 术后复发与无复发的HCC患者癌组织IFITM3蛋白表达情况比较 对43例患者进行术后随访,发现1年内肝内肿瘤复发患者21例(48.8%);术后复发组癌组织IFITM3蛋白阳性率为81.0%(17/21),未复发组为22.7%(5/22),两者比较差异具有统计学意义(x2=14.578,P=0.000)。
3 讨论
肝癌的复发转移是影响肝癌患者生存时间,导致患者死亡的重要原因,但目前有关肝癌复发转移的具体机制尚不清楚,尤其是在分子调控层面[8]。研究指出,肿瘤的转移复发从分子水平大致有原发肿瘤细胞生长增殖、癌细胞在黏附分子介导下与细胞外黏附、癌细胞释放大量水解细胞外基膜和基质的蛋白水解酶、组织被水解酶破坏后癌细胞通过组织间隙、血管和淋巴管浸润,发展至远处,形成新生的肿瘤组织微血管,癌细胞在新的环境中生长和增殖[9-11]。在上述过程中基因或蛋白的调控至关重要,其中IFITM基因家族有可能在细胞黏附、免疫细胞信号传导、癌细胞迁移等多个阶段都发挥着重要的作用[12]。
IFITM3基因是该家族的成员之一,其位于人11号染色体上,碱基长度约为1.5 kb,可被Ⅰ-Ⅱ型干扰素诱导,编码跨膜蛋白3[13]。该基因最早被发现于经干扰素治疗的神经细胞瘤细胞,其不仅可在细胞膜上表达,还被发现存在细胞质中[14]。IFITM3已经明确在生殖细胞成熟和归巢、免疫细胞调节、细胞增殖、体节形成和心脏发育等不同细胞进程中发挥着作用。它还可与IFITM1和IFITM2等一起抵抗流感病毒、HIV等多种病毒的侵入,具有抗病毒的作用[15-17]。最新的研究指出,IFITM3在多种肿瘤的发生和侵袭中也发挥着作用。IFITM3在结肠癌中呈高表达,且表达水平与肿瘤分期密切相关,在伴随淋巴结转移患者中的表达水平更高[18]。增殖和侵袭等生物学功能明显活跃的肿瘤细胞IFITM3表达增强,因此有学者建议将其表达水平作为判断结肠癌患者预后的指标。在恶性神经胶质瘤,IFITM3蛋白表达呈阳性,且其表达水平与肿瘤恶性程度呈正相关[19]。同时,体外实验显示该基因表达水平降低后,胶质瘤细胞的克隆形成、增殖和迁徙能力都明显降低。上述研究结果均说明,IFITM3可能是一种肿瘤的致癌基因,其在肿瘤的发生和发展中具有重要作用。
本研究则进一步探讨了IFITM3蛋白在肝癌组织中的表达情况及其与肝癌复发之间的关系,结果显示,肝癌组织IFITM3蛋白表达阳性率和蛋白表达水平明显高于或强于癌旁组织,其中肝癌组织IFITM3蛋白阳性率为72.1%,而癌旁组织为14.0%(6/43,P<0.05)。进一步分析不同临床特征患者肝癌组织该基因表达水平可见肿瘤>5 cm,TNM Ⅲ-Ⅳ期和有肝内复发者IFITM3蛋白表达水平要明显强于肿瘤≤5 cm、TNMⅠ-Ⅱ期和无肝内复发者(P<0.05)。此外,低分化和中分化肝癌组织IFITM蛋白阳性率均要明显高于高分化组,伴肝内卫星灶者阳性率也要明显高于无肝内卫星灶者(P<0.05),提示该基因在肝癌组织呈现高表达,其表达水平与肝癌的恶性程度呈正相关,与有关研究[20]结论一致。我们进一步对接受根治术的HCC患者进行1年随访,结果显示HCC复发组癌组织IFITM3蛋白阳性率为 81.0%(17/21),未复发组为 22.7%(5/22),两者比较差异具有统计学意义(P<0.05)。综合上述结果,我们认为IFITM3基因在肝癌的发生、发展、复发等过程中发挥着重要作用,其在肝癌组织中的高水平表达在一定程度上会促进癌细胞的生长、增殖,提高其侵袭和转移能力,这可能成为肝癌分子靶向治疗的一个新方向。