两种大鼠肝癌模型制作方法的对比研究
2019-01-22梁智超姬凤彩孙建新蒋远东阿吉古丽吐尔洪魏后乐
梁智超, 姬凤彩, 孙建新, 蒋远东, 刘 昕, 阿吉古丽·吐尔洪, 魏后乐
(新疆医科大学1公共卫生学院, 2动物实验中心, 3护理学院, 乌鲁木齐 830011)
目前,针对肝癌的实验室研究有很多,研究人员常利用大鼠肝癌模型对肝癌的发生、发展、转移、治疗等进行研究[1-2]。实验室研究具有不受时间限制、个体差异小、研究对象数量容易控制等优点,受到广大研究者的青睐。实验室研究中常利用肝癌动物模型进行研究[1],肝癌动物模型中,又以大鼠肝癌模型易操作、成本低廉应用最为广泛[2]。
肝癌模型的制备方法比较多,包括自发性、诱发性、移植性、基因工程肝癌模型、注射式肝癌模型。自发性模型虽然与人类的发病机理、发病过程很相似,但是肿瘤发生率比较低且不稳定。诱发性肝癌模型起病隐匿、病程较长,肿瘤多为弥漫结节型,合并或不合并肝硬化。基因工程肝癌模型为肝癌的基础理论和临床研究开辟更为理想的途径,但技术要求极高,价格昂贵[3]。移植性肝癌模型又分为肿瘤组织包埋法和直接注射法,现有的实验方法均是将大鼠开腹后,进行相应的操作,手术后的护理操作比较繁琐,但造模周期短,肿瘤发生部位精确,有利于对肿瘤组织的观察[4-5]。
实验研究中常用到的有诱发性肝癌模型和移植性肝癌模型[6]。诱发性肝癌模型的肝癌出现的时间、部位、病灶数等的个体差异比较大,多用于肝癌病因学、发生学、发病机制、遗传学方面的研究[7-8]。移植法肝癌模型是通过开腹手术将瘤块组织包埋在肝包膜下[9-10],肿瘤位于肝脏接种部位,呈圆形或椭圆形,膨胀性和浸润性生长,腹水发生率高。此种模型的优点是肿瘤生长在肝脏,与临床肝癌病例基本相似,实验周期短,模型易于建立,是研究肝癌局部治疗的较好模型[10-11]。两种肝癌模型制作方法均采用Wistar大鼠[12],从造模操作方法的难易程度、肿瘤生长周期、大小、造模过程中产生的并发症、造模的成功率、动物生长状况等进行对比研究。
1 材料与方法
1.1实验动物SPF级Wistar大鼠,雄性, 70~100 g,30只。购自于新疆医科大学动物实验中心,生产许可证:SCXK(新)2016-0003 。
1.2材料Walker-256细胞株,购自于上海通派生物细胞库,货号walker 256细胞株。
1.3方法
1.3.1 肿瘤组织研磨液的制备 Walker-256细胞接种 于Wistar大鼠腋下,待肿瘤组织长出大约1 cm时,将肿瘤组织取出,剔除纤维包膜及坏死组织,超净工作台中在无菌平皿中剪碎,将肿瘤组织放入组织研磨器中,加入少量4℃生理盐水轻轻研磨成匀浆,80目的细胞筛过滤成瘤细胞悬液,用生理盐水调细胞浓度至107个/mL,台盼蓝染色,光镜下瘤细胞计数,活瘤细胞>90%即可将试管放入碎冰中备用。
1.3.2 肿瘤细胞腹水悬液的制备 Walker-256细胞,接种于Wistar大鼠腹腔,传代2代后收集腹水,离心,弃去上清液,留试管下层白色肿瘤细胞液体,将试管放入碎冰中备用。
1.3.3 大鼠分组及模型建立 30只雄性Wistar大鼠随机分为3组,肿瘤组织研磨组、肿瘤细胞腹水悬液组、空白对照组,每组10只,肿瘤组织研磨组(模型1)采用肿瘤组织研磨得到细胞悬液注射肝脏造模;肿瘤细胞腹水悬液组(模型2)采用肿瘤细胞腹腔接种传2代后得到的腹水注射肝脏造模;空白对照组采用0.9%生理盐水注射肝脏造模。造模前将大鼠用3%的戊巴比妥钠按照0.1 mL/100 g的剂量,腹腔注射进行麻醉。待大鼠进入深度麻醉状态后,将大鼠仰卧于试验台接种造模物质。注射部位在大鼠剑突下约0.5 cm,稍偏右侧的位置,注射时先将此部位的皮肤提起,将针头刺入皮下,然后再将针头垂直进针刺入肝脏,进针深度约0.5 cm,接种完成后拔出针头,按压进针部位3~5 min。各组大鼠均常规喂养,每日观察大鼠的饮食、大小便、腹围及精神状态,分组及造模情况见表1。

表1 分组及造模情况
1.3.4 解剖 各组注射造模物质后,各组大鼠每日均正常饮食,观察并记录动物生长情况,于实验第21天禁食不禁水,12 h后眼眶静脉丛取血,分离血清,观察血液指标。颈椎脱白处死大鼠并解剖。取出肝左叶,放入10%的福尔马林中固定,HE染色法制作病理切片,观察肿瘤生长情况。
2 结果
2.1剖检观察结果肿瘤组织研磨组和肿瘤细胞腹水悬液组的大鼠在接种造模物质第5天后较空白对照组出现不同程度的竖毛、精神萎靡、活动减少、采食量下降、消瘦等状况,肿瘤组织研磨组中有2只大鼠出现腹水。各组大鼠于造模物质接种10 d后颈椎脱臼处死,解剖取出肝脏进行观察。空白对照组的肝脏为见肿瘤瘤体,肿瘤组织研磨组和肿瘤细胞腹水悬液组可见略突出于肝脏表面的乳白色菜花样占位性瘤体,肿瘤组织研磨组的瘤体平均直径为0.2~0.5 cm,肿瘤细胞腹水悬液组的瘤体平均直径为1~2 cm。将瘤体剪开可见瘤体为实性、奶酪状乳白色组织,各组造模结果见表2。
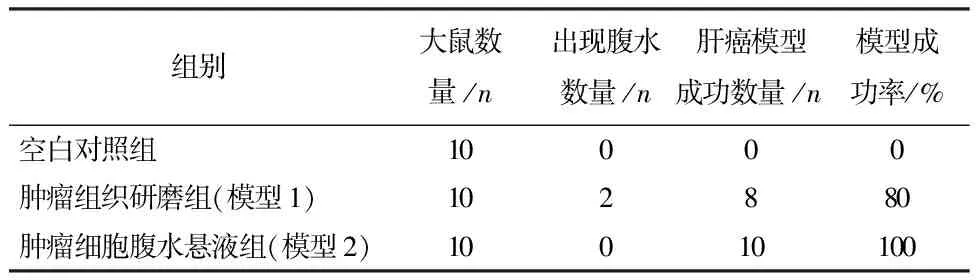
表2 3组造模结果
注:模型成功为不出现腹水且观察到占位性瘤体,显微镜可观察到肿瘤细胞。
2.2病理切片结果光学显微镜下观察,肿瘤组织研磨组的肝小叶基本可见,肝细胞轻微水肿,肝血窦扩张,肿瘤细胞呈团块状分布,中央静脉中可见有肿瘤细胞。肿瘤细胞腹水悬液组的肿瘤细胞呈巢状分布,巢中有不同程度的出血坏死状况,肝小叶的结构基本破坏,肝细胞水肿,肝血窦扩张,中央静脉中可见有肿瘤细胞存在。在400倍的高倍镜下观察,两组模型的肿瘤细胞为椭圆形,均具有胞核大、强嗜碱性浓染、异型性明显、有核分裂象、细胞大小不一、胞质量少的特点。两组模型均可见炎性细胞浸润,见图1~4。
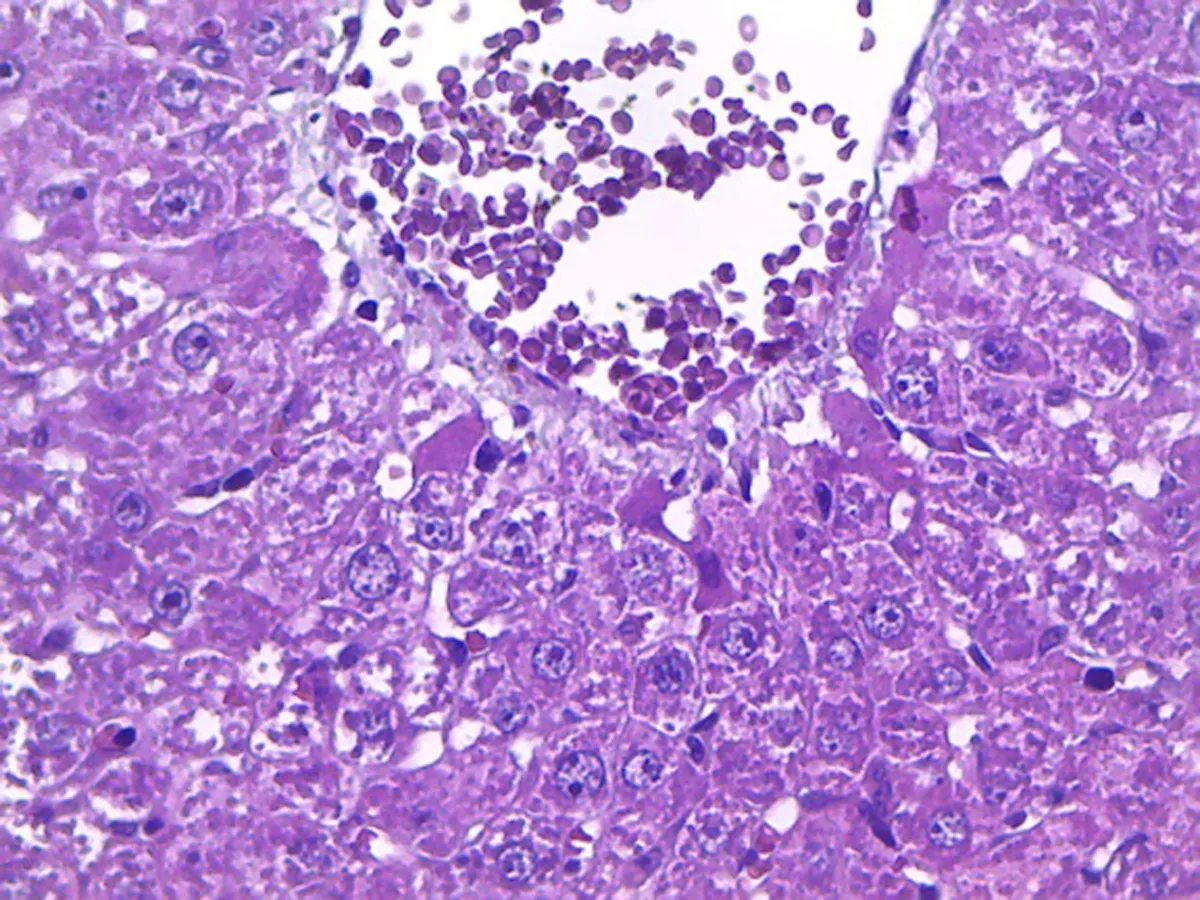
图1 肿瘤组织研磨组肝组织(×400)
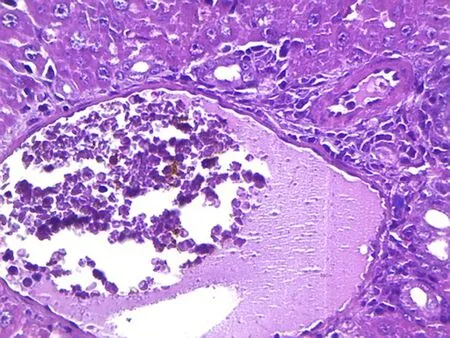
图2 肿瘤细胞腹水悬液组肝组织(×400)
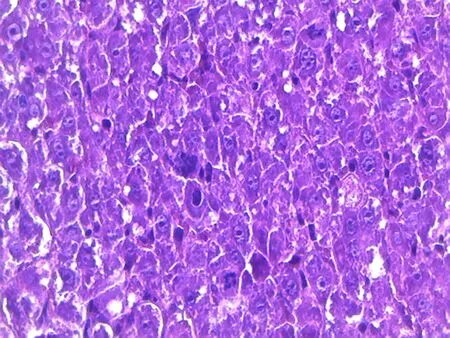
图3 肿瘤组织研磨组肝肿瘤细胞(×1 000)
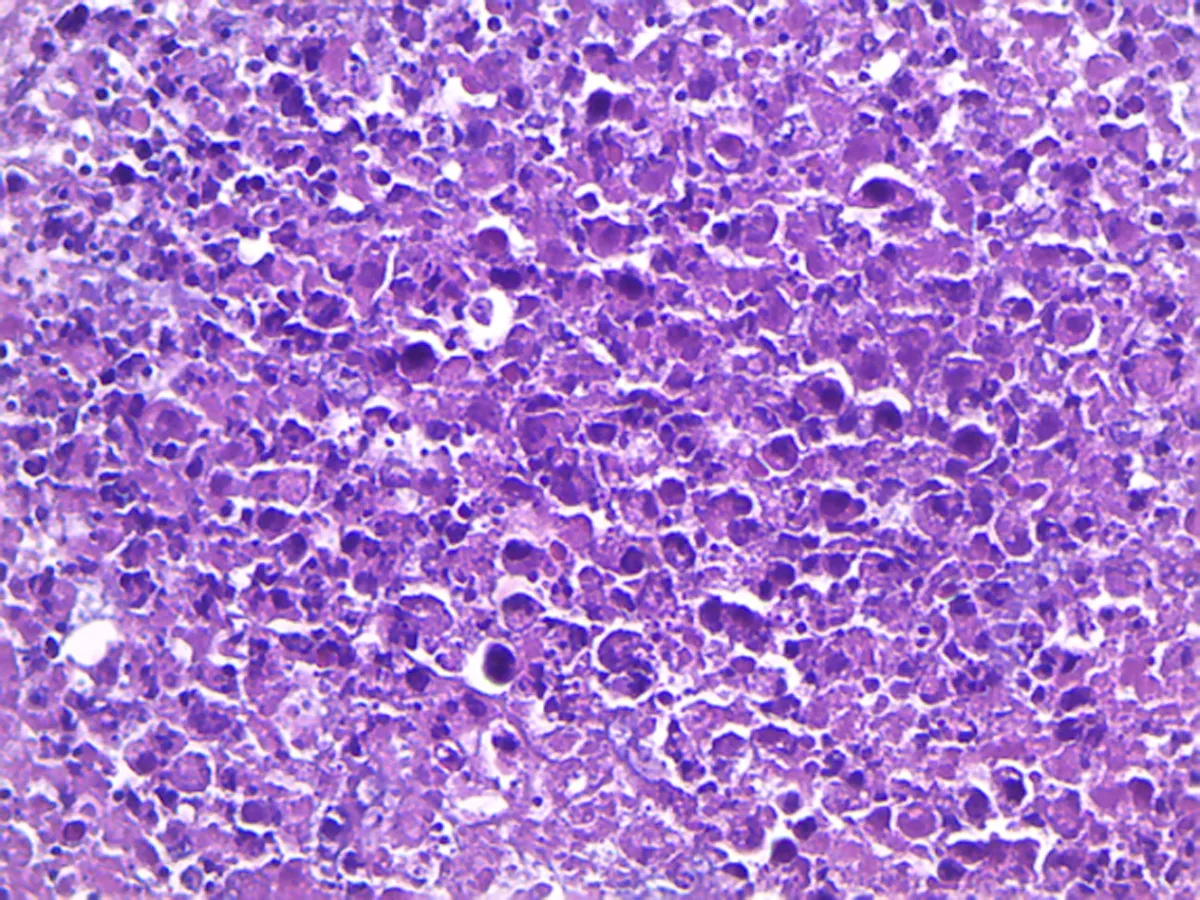
图4 肿瘤细胞腹水悬液组肝肿瘤细胞(×1 000)
3 讨论
3.1大鼠品系和质量的选取通过两次预实验发现,在进行Walker-256细胞腹腔传代时必须选取Wistar大鼠才能造模成功。第一次实验时使用SD大鼠接种腹腔,并未得到肿瘤腹水。在进行肿瘤细胞肝脏接种时也必须使用Wistar造模才能成功。本实验大鼠的质量需要控制在70~100 g的范围内,若Walker-256细胞接种在超过100 g的Wistar大鼠肝脏内,造模成功率很低。
3.2瘤体悬液制备注意事项(1)在采集大鼠腋下瘤体时需要把握时机。 (2)大鼠腋下接种后第10天即可采集瘤体,此时瘤体大约1 cm大小,手感稍有弹性,剖检可见瘤体为实性奶酪样组织,此时采集瘤体做细胞悬液最合适。(3)当接种时间超过10 d后,瘤体有中空的感觉,剖检后发现瘤体中间有血性液体,瘤体边界呈现灰白色,组织易碎,采用瘤体制作的细胞悬液在镜下观察活细胞计数无法达到107个/mL。
3.3肝脏造模本课题组通过反复实验证实,在进行癌细胞肝脏接种时,大鼠必须处于深度麻醉状态,否则在注射进针时大鼠扭动身体将影响接种效果。接种完毕后拔针的同时压住进针部位3 min以上,否则会造成造模物质逆流进入腹腔产生恶性腹水。产生恶性腹水后10 d左右大鼠将会出现死亡的情况。本次实验中肿瘤组织研磨组中有2只大鼠造模未成功,剖检观察发现,肝脏上未出现瘤体,腹腔内有大量红色恶性腹水,可能是接种时针头未进入肝脏,造模物质直接进入腹腔所致。
3.4瘤体生长速度本研究通过对比分析发现,肿瘤组织研磨组的肝脏瘤体小于肿瘤细胞腹水悬液组的瘤体。说明肿瘤细胞腹水悬液制作的肝癌模型的瘤体生长速度大于肿瘤组织研磨组,肿瘤细胞腹水悬液制作的模型更适合用于与肿瘤生长和抑制生长相关的课题研究,而肿瘤组织研磨得到的细胞液则更合适用于实验周期长的研究。由于本次实验旨在探索肝癌模型制作方法,因此,在接种瘤细胞第10天时结束实验,未继续观察大鼠在第10天以后的状态,以及大鼠因肝癌造成的死亡时间,这些均有待今后进一步研究。
3.5病理切片通过病理切片的观察,本研究发现两组模型的肿瘤细胞在形态和排列上没有差别。从肝小叶的基本结构观察,肿瘤组织研磨组的肝小叶比较完整,肿瘤细胞腹水悬液组的肝小叶基本破坏,说明肿瘤细胞腹水悬液组的肝脏损伤程度更为严重。对中央静脉中的细胞进一步观察后发现,两组模型的中央静脉里均存在有肿瘤细胞,表明肿瘤细胞已经进入血液,并向全身转移,与肿瘤组织研磨组相比较,肿瘤细胞腹水悬液组的中央静脉中的肿瘤细胞更多,提示肿瘤细胞腹水悬液组的全身转移速度可能更快。
