自噬相关蛋白参与抗病原感染机制的研究进展
2019-01-22常秋燕李林杰郭富城李凌浩张德荣马忠仁马晓霞
马 鹏,常秋燕,李林杰,郭富城,李凌浩,张德荣,马忠仁*,马晓霞*
(1.西北民族大学 甘肃省动物细胞工程技术研究中心,甘肃 兰州 730030;2.西北民族大学生命科学与工程学院,甘肃 兰州730030)
细胞自噬(Autophage),是细胞在自噬相关基因(Autophagy-related gene,ATG)的调控下利用溶酶体降解自身受损的细胞器和大分子物质的过程[1]。细胞自噬与细胞凋亡、细胞衰老相似,是十分重要的生物学现象,参与生物的发育、生长等多种生命过程[2]。自噬的发生依赖于自噬相关基因(Autophage-related gene,ATG)编码的自噬相关蛋白,已知的有36种ATG蛋白参与自噬及其相关过程,根据参与自噬的不同阶段,它们被划分为不同的功能结构域,如表1所示。如ULK复合体,是由ULK1激酶、ATG13、FIP200以及ATG101这几种蛋白组成,位于信号级联反应的末端,可正向或负向调控自噬反应[3]。
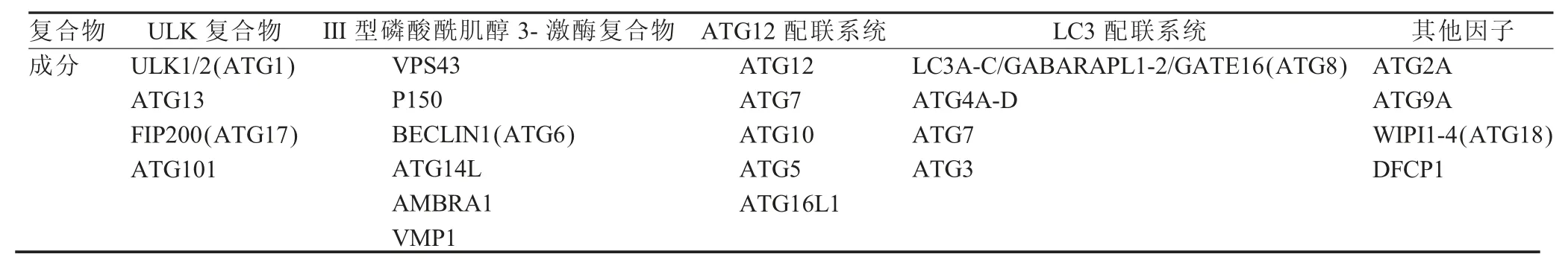
表1 ATG蛋白复合体组成[4]Table 1 The structure of ATG complex[4]
长期以来,研究人员认为ATG蛋白的主要功能是参与自噬,是自噬过程中不可缺少的因素,所以大量的研究集中于此。然而最新的研究表明,这些蛋白单独或共同参与除自噬外的其他重要的细胞生理过程,如基因调控、蛋白转运、凋亡及免疫应答等过程[5-7],如表2所示。本文综述了几种重要的ATG蛋白在调控天然免疫应答在病毒感染后的作用,为研究动物抗病源侵染的重要生理功能提供理论依据。
1 ATG蛋白调控抗病毒天然免疫信号通路
1.1 ATG蛋白调控RLRs信号通路ATG12及ATG5可参与除自噬之外的信号途径。许多RNA病毒感染哺乳动物细胞后产生病毒来源的免疫刺激RNA片段(isRNA)。当细胞被新城疫病毒、流感病毒、日本乙脑病毒等RNA病毒感染后,病毒增殖过程中会产生能被胞质中的RNA解旋酶RIG1识别的5'三磷酸化的RNA片段。其它的病毒如脑心肌炎病毒产生的双链RNA可被另一种RNA解旋酶MDA5识别。这两种解旋酶N端都具有caspase活化和招募的结构域(CARD),可以与其它具有CARD区域的蛋白,如信号分子IFN-b启动子激活因子(IPS1)结合。IPS1的CARD与RIG1或MDA5的CARD结合对于下游信号的传递至关重要,最终 NF-κb,IRF3,IRF7入核并激活IFN及相关细胞因子的转录与翻译。分泌型的IFN-I可通过自分泌或旁分泌的方式激活RNA酶L降解病毒RNA或通过抑制真核翻译起始因子2(eIF2)的活性来阻遏病毒蛋白合成[9-11]。

表2 ATG蛋白非依赖自噬功能[8]Table 2 The function of ATG protein independence autophagy[8]
ATG12-ATG5复合物反向调控isRNA引起IFN的合成。ATG12-ATG5复合物通过结合RNA解旋酶RIG1和MDA5来调节二者结合IPS1的能力,从而阻断IFN的合成。研究表明,在ATG5敲除的纤维原细胞感染水泡性口炎病毒后,IFN-I的产生增加,病毒复制减少。在293细胞中过表达ATG5或ATG12则促进ATG12-ATG5复合物的生成并抑制RIG1或MDA5介导的信号通路,最终导致IFN-I产生减少。此外,ATG7敲除的纤维原细胞中ATG12-ATG5复合物的形成受阻,进而对isRNA的刺激更敏感。研究显示,ATG5或ATG16L1能够负调控 RIG-I样受体介导的信号通路,缺失自噬体的小鼠胚胎成纤维细胞和普通树突状细胞在RNA病毒的侵染下,MAVS结合的线粒体丧失其正常功能从而诱导产生大量活性氧(Reactive oxygen species,ROS),ROS的释放能够继续激活IFN-I 的表达[12-13]。
1.2 调节STING介导的天然免疫应答ATG蛋白也参与了细胞内DNA信号激活STING介导的天然免疫应答,在此过程中,ATG蛋白可以干扰信号转导途径,所以它们发挥了调节因子而非效应因子作用。细胞质中的Toll样或者RIG-I样受体识别双链寡核苷酸后激活天然免疫炎症反应[14]。一种途径是通过炎症小体复合物以及活化的caspase-1介导产生炎症因子IL-1β及IL-18。另一种途径是STING激活后磷酸化IRF3及STAT6,二者最终入核起始IFN基因的翻译[15-16]。
STING激活的具体机制还不清楚,然而,目前发现dsDNA被受体识别后,STING这个跨膜蛋白从内质网中转移到高尔基体中,随后与TANK结合激酶(TBK1)结合并在细胞质中形成聚点,而TBK1参与调解自噬蛋白及自噬受体蛋白 P62,LC3及 ATG9a也在此定位,但 ULK1、ATG5及ATG14L并未出现,表明ATG蛋白参与调节STING信号通路,且此过程独立于自噬作用[17]。此外,当双链DNA刺激ATG7及ATG16/1敲除的细胞时,细胞膜上STING的运输及IFN-β的分泌均表现异常。而当双链DNA刺激ATG9A敲除的细胞时,细胞质中TBK-STING聚点会大量增加,同时IRF3磷酸化作用增强并促进IFN-β,IL-6及CXCL10的分泌[18]。以上现象表明 ATG蛋白通过调节STING及TBK1的结合来调控DNA激活的天然免疫信号通路(图1),而这些作用通常独立于自噬过程,具体的调节机制还需进一步探究。

图1 RIG-I样受体型号通路[19]Fig.1 The signal pathway mediated by RIG-I like receptor[19]
1.3 ATG参与炎症反应最近研究报道显示,ATG可以调节 NF-κB活化。例如,BCL10与自噬接头分子 p62/SQSTM1结合参与调节T细胞受体(TCR)介导的NF-κB的活化[20]。在巨噬细胞中,SQSTM1/p62依赖性清除受损的线粒体来调节NLRP3-炎性小体的激活,SQSTM1/p62的缺失导致炎症小体激活和产生大量的 IL-1β[21]。虽然这种机制限制了过量的IL-1β依赖性炎症,但其它研究已经表明,自噬通过螯合A20来增强特异性组织巨噬细胞中的NF-κB活性,以提高抗真菌免疫力[22]。这一证据表明,自噬可以通过许多途径包括不同细胞类型中的NF-κB活化来调节促炎信号传导。由于自噬在免疫系统中起多重作用,自噬活性的紊乱可能会影响自身免疫的发生[7]。
2 ATG蛋白参与抗动物病原侵染
2.1 抑制病毒复制ATG12-ATG5/ATG16L1蛋白复合物与其它一些自噬蛋白共同参与机体抗细菌、病毒等病原的侵染[23]。宿主与病原均利用自噬相关的细胞器或组份来抑制或促进病毒的复制,而这与传统的自噬途径无关。属于人兽共患病的诺如病毒是一种单链RNA病毒,机体在IFN-γ介导的抵抗该病毒感染时需要一些自噬相关的细胞器或组份以非降解形式参与。在此期间,IFN-γ活化的巨噬细胞促使一部分ATG蛋白阻碍病毒复制复合体的形成。值得注意的是,巨噬细胞感染诺如病毒所产生的IFN-γ的抗病毒作用还需要 ATG12-ATG5、ATG7、ATG16L1的参与,尤其是ATG5,因为病毒在ATG5敲除的细胞中可以正常增殖。同时JAK-STAT信号通路也可以被激活,但此过程并不诱发自噬、溶酶体酶降解作用及自噬体与ATG4B或溶酶体的融合作用。至于上述自噬蛋白干扰病毒复制的机制还不清楚。相反,自噬蛋白beclin1、LC3、ATG4B、ATG5、ATG7和ATG12对丙肝病毒(Hepatitis C Virus,HCV)蛋白翻译、病毒复制及子代病毒的分泌有关键作用,而非干扰病毒生命周期[24-26]。
最近研究显示,通过siRNA screen方法筛选到至少36%的ATG蛋白可参与调控6种病毒的复制,并且通过进一步实验证实ATG13及FIP200这两种蛋白参与调控小RNA科病毒人兽共患病脑心肌炎病毒(Encephalomyocarditis virus,EMCV)及柯萨奇病毒(Coxsackievirus,CV)的复制[27]。研究者还发现,ATG13敲除后对单纯疱疹病毒、泡沫病毒等病毒的复制不产生影响,CV的复制受到了抑制,而EMCV及其它小RNA科病毒的复制能力却提高了。鼠胚胎纤维细胞中ATG13敲除后,流感病毒的复制能力提高,而在U2OS及Hela细胞中ATG13的敲除对该病毒的复制无影响,表明在不同细胞系中,病毒与细胞的相互作用机制是不同的。最终,他们还通过高通量测序筛选出与抗病毒天然免疫、细胞凋亡等重要生理功能相关的一些因子,因此推测,ATG13及FIP200蛋白可能是通过以上机制来调控病毒复制的[27]。
有研究报道,ATG5-ATG12参与口蹄疫病毒(Footand-Mouth Disease Virus,FMDV)的复制。FMDV感染ATG5-ATG12敲低的PK-15细胞,与野生型FMDV相比,病毒的复制能力提高。在FMDV感染后的IBRS-2细胞中过表达 ATG5-ATG12,发现ATG5-ATG12能够正向调控NF-κB信号通路,但在BHK-21细胞中没有显著影响。使用qPCR和ELISA检测到IFN-I产生,以及细胞因子的大量产生,包括:CXCL10、PKR、RIG-I、MDA5等等[28]。
2.2 破坏动物寄生虫纳虫泡自噬蛋白还参与与自噬不相关的抗胞内寄生虫感染作用。弓形虫感染宿主后,寄生在未活化的巨噬细胞中并通过抑制纳虫泡与溶酶体结合来持续增殖[29]。然而活化的巨噬细胞通过两种机制来限制弓形虫增殖,进一步将其杀死并清除。一种是通过CD40-CD40L信号激活自噬的机制,另一种是利用IFN-γ诱发的破坏纳虫泡膜并进一步清除病原及膜碎片的机制,此途径可以通过p47 GTPase IIGP1进行调节且依赖ATG5的非自噬相关功能。研究表明,当弓形虫感染ATG5敲除的巨噬细胞后,观察到细胞中完整的纳虫泡且虫体无法被清除。其可能的机制是ATG5缺失后阻碍了IIGP1向纳虫泡膜的聚集转而出现在胞内的膜泡中,因此推断ATG5的缺失抑制了IIGP1向弓形虫纳虫泡的运输[30]。由于在纳虫泡附近没有发现膜结构组装的自噬体,所以判断此过程不依赖于自噬。然而,在ATG5敲除及野生型的细胞中,观察不到LC3在胞内的定位。在先前的报道称,在弓形虫感染后,星型胶质细胞被IFN-γ激活,IIGP1信号附近可检测到LC3向被破坏的纳虫泡聚集[31-32]。ATG5及 LC3在抗弓形虫的免疫反应中发挥何种关键作用尚未定论。
2.3 清除流产布鲁氏菌感染流产布鲁氏菌是一种胞内寄生菌,它可以侵染多种细胞并在其中增殖。当其被巨噬细胞吞噬内化后形成布鲁氏小体(Brucella-containing vacuoles,BCV),这些膜泡与核内体及溶酶体进行一定程度融合可避免被内溶酶体的降解。BCV的酸化对于激活布鲁氏菌毒力因子(VirB)基因的启动子是必须的,VirB操纵子编码IV型分泌系统[33],该系统可以将细菌LPS释放到宿主细胞中并有助于BCV向内质网的转移,最终在内质网中大量增殖形成内质网衍生型的BCV(rBCVs),细菌在此增殖。布鲁氏菌在巨噬细胞及上皮细胞中增殖的后期会转移到具有自噬性能的膜泡中,称之为自噬BCVs(aBCVs),这对于布鲁氏菌在胞内完成其生命周期及在胞间传递至关重要[33]。aBCVs是内溶酶体系统晚期的组份蛋白,它的产生依赖一些 ATG蛋白如 ULK1、BECLIN1、ATG14L及Ptdins3P参与的自噬体的形成[12]。相反,敲除一些对自噬泡的延伸起重要作用的蛋白,如ATG5、ATG7、ATG16L1、ATG4B及LC3B,或一些对自噬体成熟有关键作用的因子,如UVRAG及RAB9,则不会影响到aBCVs的形成及菌体的繁殖。ATG蛋白在宿主清除布鲁氏菌感染过程中也发挥重要作用,研究表明,敲除了自噬相关蛋白的自噬功能缺陷型HeLa细胞或者ATG基因突变的巨噬细胞中BCV的形成及布鲁氏菌向内质网的运输均不受影响[33]。
2.4 宿主-病原互作ATG12-ATG5/ATG16L1蛋白复合物同其它一些自噬相关蛋白共同参与宿主抗病原如细菌及病毒的侵染[11]。细胞与病毒均利用这些蛋白或者自噬相关的膜结构来促进或抑制病毒复制,而这些过程不依赖于自噬。如宿主细胞在抗诺如病毒感染过程中依赖IFN-γ激活巨噬细胞及相关ATG蛋白的参与来抑制MNV复制复合体的组装,干扰病毒基因复制。值得关注的是,ATG12-ATG5、ATG7及 ATG16L1参与了巨噬细胞中 IFN-γ抗MNV感染作用,但此过程不引起像自噬、溶酶体蛋白酶降解及自噬体与溶酶体或者ATG4B的融合等过程的发生[11]。
3 结论与展望
研究者通过对不同病毒包括人兽共患病病源、动物病源以及人源病毒等的研究,发现ATG蛋白不仅能够通过其本身具有的自噬功能清除入侵的病原体,还能通过其非依赖自噬的功能去调节病毒的复制,例如:调节宿主天然免疫信号通路、与病毒抗原相互作用等等。但是目前对这些自噬相关蛋白在抗病源的功能认知上仍然存在局限性。近年来,通过对宿主免疫性及相关病原致病性的研究发现ATG蛋白单独或与其它ATG蛋白共同作用参与这些过程并且发挥重要的作用,而且这些作用往往不依赖于自噬过程。ATG蛋白除了自噬功能之外在动物病原微生物方面的研究目前还是一个新的领域,相信今后随着ATG蛋白分子生物学特性逐步被揭示,这方面的研究会越来越多。目前,国内外相关实验室大都构建了大多数自噬基因敲除的小鼠品系,这也为揭示ATG蛋白自噬功能之外的其它重要生物学功能提供了必要条件。然而,单独敲除单个ATG基因或几个具有相同功能的ATG基因还不足以掌握其全部的生物学功能。所以,随着分子生物方法的进一步发展,相信会有更优的方法可以供研究者利用,为ATG蛋白在动物病源微生物中重要功能的揭示提供可能,使其更好服务人类社会。
