IFN-λ在抗病毒免疫中的作用
2019-01-22马晓霞常秋燕李林杰张德荣王悦莹赵永清马忠仁
马晓霞,常秋燕,马 鹏,李林杰,张德荣,曹 欣,王悦莹,赵永清,马忠仁*
(1.甘肃省动物细胞工程技术研究中心,甘肃 兰州 730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730010)
免疫系统是机体抵抗病原体感染的第一道防线,它通过模式识别受体(Pattern recognition receptors,PRRs)来识别不同类别病原体的保守分子结构或在细菌与宿主细胞之间定位异常的分子。长期以来,人们普遍将I型干扰素(Interferon-I,IFN-I)或 IFN-α/β 的产生作为机体对抗病毒感染的关键天然免疫防御反应。IFN-I主要通过抑制病毒复制来发挥直接的抗病毒活性,并且可以维持机体正常的天然免疫与适应性免疫系统的细胞免疫功能,因此IFN-I在病毒感染早期发挥抗病毒作用并且可以发挥长期免疫功能[1]。而 IFN-λ的发现较晚,它是一类白介素(IL-28a、IL-28b及IL-29)的总称,并且具有与IFN-I相似的生物学特点,如图1所示。IFN-λ所产生的信号转导效应是需要IL-10R2链和IL-10超家族的其他一些成员以及IFN-λ特异性的IL-28R α链互作来实现的,并且众多的异源二聚体组合形式使IFN-λ在介导信号通路上呈现出更强的可塑性[2]。目前的研究表明,细胞胞质内存在的可以感知菌体成分的 Toll样受体(Bacteria-sensing TLRs)可以广泛诱导IFN-λ的产生,并且IFN-λ可以有效增强上皮组织的完整性而抵抗病原微生物的侵染[3]。在研究丙型肝炎病毒(Hepatitis C virus,HCV)感染所激发的免疫学事件的过程中,除了病毒自身基因组能够在多能干细胞中激活不同种类IFN以及相关IFN刺激基因来实现抗病毒作用外[4],还发现IFN-α和IFN-λ在肝癌细胞中所诱导活化的免疫相关基因的类别具有很高的重叠性,虽然IFN-λ诱导免疫相关基因活化的动力学低于 IFN-α,但 IFN-λ对这些基因活化后的产物具有更持久的抗病毒反应。在对 IFN-α和IFN-λ在B细胞内的反应进行比较后发现,IFN-α诱导的反应比IFN-λ更强烈,并且 IFN-λ可活化的基因同样可以被IFN-α活化。由此推测 IFN-λ介导的信号通路与 IFN-I介导的通路在很大程度上是相似的。
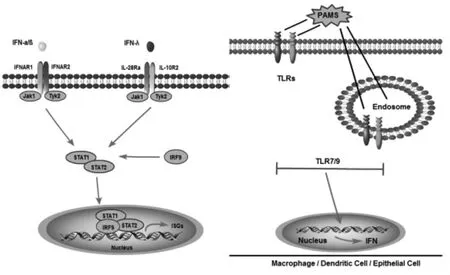
图1 IFN-λ激活 JAK1-STAT信号通路Fig.1 The signal pathway of type IFN-λ
1 IFN-I和IFN-λ的活化
多数病毒侵染细胞后可以同时诱导IFN-I与IFN-λ的表达,并且这两种IFN的表达是通过转录机制来介导的。这一转录机制所涉及到的转录因子包括干扰素调节因子(IFN regulatory factors, IRFs)和 细 胞 核 因 子 κB(NF-κB)。当细胞内受体感应到病原体的存在后,IFN的表达才能活化。表明病毒的遗传物质是一类刺激机体产生IFN的“强心剂”。在胞质中具有DEXD/H盒解旋酶结构的RIG-I和MDA5能够检测到双链RNA和 5'三磷酸RNA的存在,而 Toll样受体(Toll-like receptors,TLR)3和 TLR7/8能够感应到双链RNA和单链RNA在核内的存在[5]。Du等的研究表明,HCV在自身基因组复制过程中所形成的双链RNA结构是IFN表达的一种强效诱导剂,这种双链结构被MDA5模式识别受体识别从而激活IFN-β以及IFN-λ的表达[6]。此外,DNA也是一种诱导IFN产生的潜在诱导剂,其激发过程是通过DNA依赖的干扰素调节因子激活物(DNA-dependent ctivator of IFN-regulatory factor,DAI)探测到细胞质B型DNA的存在,从而诱导IFN的表达。人巨细胞病毒DNA被DAI侦测后可活化IRF3来诱导IFN的表达。进一步研究表明,Ku70虽然是DNA修复蛋白复合物的一个亚基,但是其具有胞内DNA感受器的作用,可以有效诱导IL-29在人源细胞中的表达,并且被归类为一种天然免疫适配因子(Innate immune adaptor,TING),其活化后才能使IFN-λ具有抗击DNA病毒侵染的能力[7]。水疱 -带状疱疹病毒(Varicella zoster virus)侵染真皮细胞后,STING介导的IFN-I和IFN-λ信号通路所发挥的抗病毒作用十分显著[8]。有趣的是,由于某些DNA可作为RNA聚合酶III的扩增模板而产生带有双链结构的5'-三磷酸的RNA,从而有效激活RIG-I,这也在一定程度上表明RNA与DNA在激活IFN相关系统过程中存在干扰现象。虽然病毒侵染激活IFN系统的信号通路多种多样,但是在所有通路中NF-κB和 IRFs是诱发 IFN-I和 IFN-λ表达的重要节点。此外,虽然可溶性IL-6受体与IL-27亚基p28蛋白复合物在介导IFN-I行使抗病毒功能方面具有很强的能力,但是这种复合物同样可以作用于IFN-λ启动子后激活IFN-λ的抗病毒活性[9]。
自从发现IFN-λ及其主要激活机制后,进一步研究与IFN-λ表达调控相关的免疫学机制将有助于解释包括IFN-I和IFN-λ之间免疫效应差异以及激活IFN系统在分子机制方面的必要条件。例如,IFN-α启动子包含一个IRF结合位点决定簇,主要负责诱导基因的表达;而IFN-β启动子的活化过程较为复杂,可通过一个由 IRFs、NF-κB、ATF2/c-Jun和基础转录因子组成的复合物来进行调控,并且发现随机表达的IFN-β仅存在于病毒感染细胞的一个亚结构中。相对于IFN-I启动子而言,3种IFN-λ基因的启动子含有 IRFs和NF-κB的结合位点,具有相同的激活机制。值得注意的是,与IFN-β类似,IL-29基因对IRF-3呈现出很强的依赖性;而IL-28a/b类似于IFN-α,主要由IRF-7诱导。更深入的研究显示,IL-29启动子存在NF-κB结合位点,并且这些结合位点不依赖IRF3和IRF7的作用可独立激活 IL-29启动子,表明IFN-I与IFN-λ的启动子在进化上是独立分开的[10]。虽然激活 IFN-I与IFN-λ的转录因子相同,但是IRF在IFN-I活化过程中的作用更加显著,而NF-κB在IFN-λ活化过程中发挥着关键作用。在一些 MicroRNA中,MicroRNA-21具有明显的调节 IFN-λ在浆细胞样树突状细胞(DC)中活化表达的作用,同时MicroRNA-21也是促进IFN-I产生的效应分子,这也从一定程度辅证了IFN-I与IFN-λ在一些生物学功能方面相近的理论推断[11]。戊型肝炎病毒(Hepatitis E virus,HEV)在侵染人源肝癌细胞以及原代肝细胞后,IFN-I是免疫系统中的主要抗病毒防御与调节因子[12],而 IFN-λ的表达却是HEV稳定感染的“助推剂”[13],这也在一定程度上体现出 IFN-I与IFN-λ在抵抗病毒侵染机制中的“分工合作”,同时也反映出模式识别受体RIG-I、MDA5以及MAVS在介导与IFN活化相关信号通路中的多样性和复杂性。
2 IFN-λ在天然免疫反应中的抗病毒作用
与 IFN-I类似,IFN-λ具有抗病毒功能。重组人源IL-29和IL-28a可以有效减弱单纯疱疹病毒(Herpes simplex virus,HSV)在 HePG2细胞中的复制和对细胞的毒性[14]。当流感病毒侵染肺脏后,外源IL-28a/b具有很强的抗病毒活性,这在一定程度上表明IFN-λ在黏膜免疫方面发挥重要作用[15]。HIV侵染人巨噬细胞后,IL-29和IL-28a可以有效抑制HIV在细胞中的活性,而IFN-λ甚至可以有效阻止耐药性HIV侵入巨噬细胞[16]。这些实验结果表明,IFN-λ在抗击人类病毒侵染过程中其抗病毒功能与IFN-I极为相似,表明二者在一些生物学功能上具有相似性。但是 IFN-I与 IFN-λ作用的效应靶细胞不同。IFN-I的受体IFNARs可在多种哺乳动物细胞中表达,而 IFN-λ受体IL-28Rα仅能在上皮细胞或者免疫细胞(DC和巨噬细胞)中表达。因此,IFN-λ的免疫功能在黏膜组织中的作用更加明显。
随着IFN-λ体外抗病毒活性的不断被证实,研究者开始利用小鼠模型来研究IFN-λ在体内的抗病毒功能。当疱疹类病毒感染小鼠后,利用外源重组IFN-λ可以有效抵抗如HSV和牛痘病毒在小鼠表皮中的增殖。Hashimoto等研究表明,腮腺炎病毒能够借助RIG-I与MAVS模式识别受体途径,在 IRF3的参与下,激活 IFN-λ与 IFN-β编码基因,从而令机体进入抗病毒模式[17]。为了评估IFN-I与IFN-λ在抗病毒方面的权重,研究人员利用重组 IFN-λ治疗被流感病毒侵染的缺失IFN-I受体的小鼠(IFNAR-/-基因鼠)后显示,外源重组IFN-λ可以在患鼠肺部发挥有效的抗病毒效应[18]。这些实验进一步证实IFN-λ在抗击病毒侵染过程中发挥着与IFN-I相似的功能。由此推测,在IFN-I存在的情况下,IFN-λ似乎是一个“双保险”。这也给机体免疫系统提出了一个新的问题,病毒表现出来对IFN-I免疫逃避的功能对IFN-λ是否也有效?然而,当酪氨酸激酶 2(Tyrosine kinase 2,TYK2)这种在 IFN-I和 IFN-λ以及众多IL相关信号转导中十分重要的信号分子活性受到抑制时,虽然IFN-I的抗病毒效果明显降低,但是IFN-λ与自然杀伤细胞组成的抗病毒防线依旧抵抗着病毒侵染[19]。
一些DNA或者RNA病毒产生的病毒蛋白可以靶向作用于激活IFN-I和IFN-λ的调控元件,使这些病毒逾越IFN-I和IFN-λ在机体内建立的免疫防线。利用乳鼠作为感染模型发现,轮状病毒可以通过降解IFN-λ的受体来阻止STAT介导的IFN受体的激活,从而使IFN-λ对轮状病毒的侵染“束手无策”[20]。埃博拉病毒VP24蛋白通过降低IRF3活性来降低IL-29基因的表达水平,从而实现对IFN-λ的抗病毒防线的逾越[21]。HSV-1可以借助 VP11/12蛋白来逃避干扰素基因激活因子(Stimulator of interferon genes,STING)介导的DNA传感器对其DNA基因组的识别,避免IFN-λ活化表达而实现病毒的侵染[22]。
3 IFN-λ在适应性免疫中的免疫调节
IFN-λ除了在天然免疫中发挥抗病毒功能[23],在适应性免疫反应过程中也发挥着调节作用。尤其是在局部免疫反应的调节过程中,IFN-λ具有活化固有免疫细胞(Resident immune cell)的能力,实现对局部感染或者癌细胞转移等疾病的局部免疫应答反应[24]。研究表明,在细胞分化过程中,DC可捕获IFN-λ受体复合物,通过这个受体活化耐受性 CD4+、CD25+及 Foxp3+调节 T细胞 (Treg)的增殖反应。进一步研究显示,与辅助性T细胞(Th细胞)调节IFN-I生发过程不同,IFN-λ可促使 DC成熟,诱导 T细胞分化增殖并且降低Treg细胞的分化增殖能力[25]。对于外周血单核细胞而言,IL-29诱导由单核细胞靶向作用导致的促炎细胞因子(Proinflamatory cytokine)的表达。此外,IFN-λ可以在不影响其自身活性的基础上特异性调节Th细胞的活性,从而下调IL-4和IL-13的表达,进而在Th1型和Th2型动态平衡中使Th细胞分化趋向于Th1型,这在一定程度上促进了IFN-I的产生。由于IFN-λ受体存在于人源CD4+T细胞和记忆CD4+T细胞表面,IFN-λ能够抑制中枢记忆T细胞转变为效应记忆T细胞。研究者利用IL-28b作为疫苗佐剂,结果显示IL-28比IL-12更具有调节适应性免疫反应的能力,并且能够提高脾脏内CD8+T细胞的数量,提高特异性抗原从CD8+T细胞的脱颗粒效果[26]。当病毒侵染机体后,机体诱导产生的IFN-λ可以有效阻止Th2型的分化增殖,促使 Th1型细胞分化增殖,使机体在抗病毒能力上达到最佳的T细胞环境。在HCV感染的急性期,一旦IL-28b基因被活化,其多态性将会间接调节自然杀伤细胞的生物学表型以及免疫学功能,使IFN-λ与自然杀伤细胞组成抗击HCV侵染的免疫防线[27]。
4 IFN-λ在疾病治疗中的应用
黏膜免疫在人类免疫防御系统中占有重要的位置,IFN-λ在黏膜免疫反应中通过抑制Th2型反应而促进Th1型的分化增殖来实现抗病毒作用。除了IFN-λ突出的抗病毒功能,其在抗肿瘤、抗炎症反应以及维持机体生理动态平衡方面也发挥着突出作用[28]。实验表明,IFN-λ能够有效抑制鼻病毒在人支气管上皮细胞中的复制并且阻止哮喘类过敏反应的进程[29]。利用小鼠哮喘模型研究表明,外源表达的IL-28a对哮喘临床症状有显著的缓解作用[30],并且IL-29在类风湿性关节炎的治疗中也表现出明显的治疗效果[31]。这也为利用IFN-λ作为免疫调节剂及作为临床候选药物提供了参考依据。在利用小鼠感染模型来研究黄热病毒致病机制的过程中,IFN-λ在维持小鼠血脑屏障完整性以及阻止病毒进入大脑组织的过程中发挥着重要的抗病毒作用[32]。目前,IFN-λ体内抗病毒的相关研究结果还是基于小鼠模型获得的,但是毕竟人类和啮齿类动物在生理学基础上存在一定的差异。可以肯定的是,IFN-λ在人类呼吸道抗击病毒感染(如流感病毒)或者是哮喘等变态反应中发挥着举足轻重的作用[33]。IFN-λ受体 IL-28Rα链在人肝细胞中存在,可以与人源IFN-λ互作,但是鼠肝脏细胞对鼠源 IFN-λ的敏感性较差[15,34]。研究表明,IL-28b基因中的单核苷酸多态性与HCV感染的自发清除频率的升高/降低具有相关性[35]。在研究Zika病毒致病机制的过程中显示缺乏IFN-λ信号通路的胎儿其胎盘和胎儿中病毒的复制水平增加,但当利用IL-28a进行干预性治疗后,可以明显降低胎儿体内Zika病毒的滴度[36]。研究者评估了IFN-α、IFN-β及 IFN-λ在临床治疗 HCV感染的效果后显示,IFN-β和IFN-λ在抵抗HCV侵染方面具有明显的优势[37]。IFN-λ还是一大类肠道病毒(例如,呼肠孤病毒、诺如病毒以及轮状病毒)潜在的治疗性免疫调节剂[38]。在一些自身免疫性疾病例如系统性红斑狼疮(Ssystemic lupus erythematosus)的临床症状与IL-28b的表达水平相关[39]。在癌症治疗方面,β链蛋白介导的信号通路可以与IFN-λ介导的信号通路互动,使涉及到STAT3和DKK1模式的β链蛋白信号通路失活,导致IFN-λ诱导癌细胞发生凋亡[40]。这些研究成果为开发以IFN-λ为免疫调节型的药物提供了令人鼓舞的参考依据。但是,由于IFN-λ在一些自身免疫性疾病(例如狼疮肾炎)起着重要的免疫调节作用,在对症治疗后机体IFN-α在血液和病变组织中的表达水平明显降低的前提下,IFN-λ在相应组织中的表达水平依旧很高,并且在很大程度上干扰治疗效果[41-42]。这也为以 IFN-λ为治疗靶标开发一些缓解特定自身免疫疾病的药物提供了可能。
5 小结与展望
自从2003年IFN-λ作为新型的IFN样细胞因子被发现以来,研究者对其生物学功能进行了广泛的探究。基于IFN-λ免疫学功能的研究报道,IFN-λ在天然免疫反应的黏膜免疫中发挥着重要作用。由于IFN-λ具有的独特受体,某些对 IFN-α/β逃逸的病毒可能对 IFN-λ敏感。同时,受体表达及其在细胞表面的丰度差异性分布显示IFN-λ在一些上皮细胞及免疫细胞中发挥着相对独立和特异性的抗病毒作用[43]。除此之外,IFN-λ在适应性免疫反应中也具有重要的调节作用。由于IFN-λ在激活抗病毒免疫反应的持久性,使其具有成为临床上治疗慢性病毒性感染的潜在“种子选手”。目前,在抗病毒治疗领域急需要解决的问题是:进一步了解IFN-λ的基础生物学与抗病毒分子机制。例如,IFN-λ基础免疫学功能、IFN-λ与其受体互作的早期效应机制、具体的IFN-λ介导的信号通路等。IFN-λ在天然免疫和适应性免疫反应过程中的多能性促使研究者需要作出鉴别,即IFN-λ在两种免疫反应体系中处于拮抗效应还是实现一种“双赢”的效应。这为开发IFN-λ成为类似于疫苗佐剂类的免疫调节剂提供指导建议。
