副猪嗜血杆菌链霉素耐药基因rpsL、rrs分析和关键位点的鉴定
2019-01-22王婉蓉马小雨曹三杰黄小波文翼平
王婉蓉,代 科,马小雨,杨 振,曹三杰,黄小波,赵 勤,伍 锐,文翼平
(四川农业大学 动物医学院猪病研究中心,四川 成都611130)
副猪嗜血杆菌(Haemophilus parasuis,HPS)是一种条件性致病菌,随着世界养猪业的发展,HPS病已成为全球范围内影响养猪业的典型细菌性疾病之一,该病近年来给养猪业带来了严重的经济损失[1]。使用抗生素是目前控制和治疗HPS病的重要措施,但也引起了HPS耐药性的问题。该致病菌极易对链霉素(Streptomycin,SM)产生耐药。SM通过与结核分枝杆菌和球形芽孢杆菌等16S rRNA(rrs基因编码)和核糖体蛋白S12(rpsL基因编码)结合造成其核糖体合成异常或产生无功能的蛋白质,导致细菌新陈代谢等生命活动障碍[2]。目前关于SM抗性的研究报道主要见于结核分枝杆菌,大多数SM抗性突变体的产生是由于rpsL基因错义突变造成的,其中,K43R和K88R是较常见的突变,与高水平的耐药性有关[3-7]。本研究采用甲基磺酸乙酯(EMS)对HPS进行化学诱变。EMS是一种广泛用于诱导植物和细菌整个基因组随机突变的化学诱变剂,可以导致单一碱基对改变而形成点突变[8]。利用EMS的高频随机突变特性和相应的筛选、测序方法,可能会发现造成相应表型差异的分子基础(基因突变位点),例如Redfield团队采用EMS对低自然转化频率的流感嗜血杆菌KW20进行诱导和筛选,多次发现了提高自然转化频率的基因突变位点[9-10]。
现已有较多关于细菌对SM耐药性分子机制的相关报道,而关于HPS SM耐药性的分子机制还鲜有报道。本研究通过EMS诱导并筛选SM抗性突变体,然后对转化子的rpsL和rrs基因进行测序分析,鉴定SM抗性突变位点,与文献报道的其它细菌的SM抗性点突变位置进行比对,判断HPS的SM抗性位突变来源是否与研究的其它细菌的突变情况一致;采用位点引导性点突变技术及自然转化法对HPS的rpsL基因进行定点突变,并通过对该突变株SM抗性水平检测以进一步验证筛选出的点突变与SM抗性的关联性,为完善HPS耐SM分子机制的研究提供一定参考。
1 材料与方法
1.1 菌株、质粒及试剂HPS SC1401由四川农业大学动物医学院猪病研究中心分离、鉴定并保存;pK18mobSacB自杀质粒培养在大肠杆菌DH5α感受态细胞中;胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)购自美国BD公司;LA培养基、LB培养基购自Hopebio公司;新生牛血清购自Gibco公司;添加有新生牛血清和NAD的胰蛋白胨大豆琼脂培养基(TSA++)、添加有新生牛血清和NAD的胰蛋白胨大豆肉汤(TSB++)均购自Difco公司;硫酸卡那霉素(100 mg/mL)、链霉素(100 mg/mL)购自TIANGEN公司;烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide,NAD)购自 TaKaRa公司;质粒小量提取试剂盒(E.Z.N.ATMPlasmid Miniprep Kit)、细菌基因组提取试剂盒购自OMEGA公司;诱导剂甲基磺酸乙酯(EMS)购自BIOSHARP公司;点突变试剂盒购自北京全式金生物技术有限公司。
1.2 HPS野生型菌株对SM最小抑菌浓度(MIC)、最小杀菌浓度(MBC)的测定无菌配制16 384 μg/mL的SM储存液,参照文献[11],采用96孔板和2倍倍比稀释法测定HPS SC1401对SM的MIC、MBC值,其中,测定MBC时SM的浓度梯度为8 μg/mL~8 192 μg/mL。
1.3 HPS最适EMS诱变浓度的筛选无菌条件下,将HPS SC1401菌株划线接种于TSA++平板过夜培养,挑取单菌落接种于3 mL TSB++,置于空气摇床过夜培养制成菌悬液。配制2.68 nmol/L的EMS,将 3 mL菌悬液分别与浓度为 0(对照组)、1.34 nmol/L、2.68 nmol/L、4.02 nmol/L、5.36 nmol/L(实验组)的EMS混和,于37℃摇床过夜培养。观察HPS的生长情况,以不抑制细菌生长的最大EMS浓度作为其最适诱变浓度。
1.4 诱导后的SM抗性突变菌株rpsL和rrs基因的扩增及序列分析在SC1401菌液中加入EMS,使其终浓度为1.3中测定的最适诱变浓度,于37℃摇床培养 12 h~24 h,取 200 μL诱变的第一代细菌(F1)接种到2 mL新鲜无抗性的 TSB++中使细菌的活力得以恢复,于37℃摇床培养12 h~24 h。采用相同方法诱导得到F2、F3等,一直诱导到F11代。每诱导一代,取150 μL菌液涂布于SM浓度为60 μg/mL(按 1.2中测定的 MIC结果)的 TSA++平板上(TSA++SM),37℃培养12 h~24 h。随机挑取平板中的单菌落,进一步培养在SM浓度为100 μg/mL的TSB++肉汤中(TSB++SM),置37℃摇床培养12 h,对筛选的能在TSB++SM中生长的疑是SM突变菌株进行突变位点分析。
根据GenBank登录的HPS SC1401菌株全基因组(CP015099)中rpsL和rrs基因序列,利用软件Primer Premier 5.0设计rpsL和rrs基因扩增引物(表1),引物由英潍捷基(上海)贸易有限公司合成。参照细菌基因组DNA提取试剂盒说明书提取上述筛选出的不同代次SM抗性突变菌株的基因组。以该基因组为模板分别PCR扩增rpsL基因和rrs基因,反应程序为:98℃ 3 min;98℃ 30 s,56℃ 30 s,72℃ 1 min,30个循环;72℃ 8 min。PCR产物由海英骏公司测序。用DNAMAN 6.06软件对SM抗性突变菌株的rpsL基因、rrs基因与未突变的HPS SC1401菌株的相应基因序列进行比对分析,鉴定突变位点,对突变位点与抗性水平之间的关系进行初步分析。
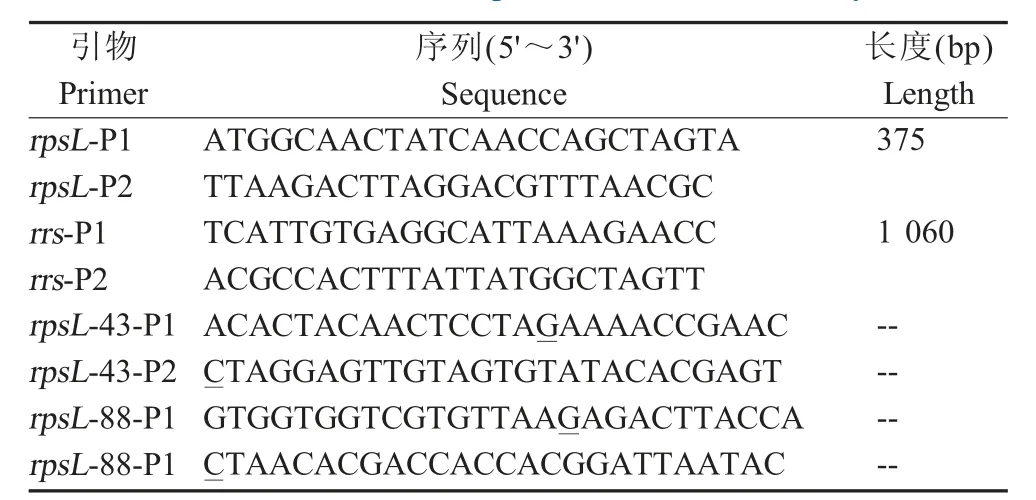
表1 HPS菌株SC1401的rpsL和rrs基因扩增引物Table 1 Primers sequence used in this study
1.5 SM抗性定点突变株的构建和PCR测序分析根据1.4对SM抗性菌株rpsL基因与rrs基因的测序结果分析后,针对筛选出来的SM抗性菌株的rpsL基因点突变位置进行人工定点突变,以验证突变菌株产生SM抗性的基因。以HPS SC1401的基因组DNA为模板,采用rpsL-P1/P2引物扩增整个rpsL基因序列并连接到自杀载体pK18mobSacb中,构建野生型质粒pkrpsL。参照点突变试剂盒说明书,采用primer 5.0设计突变引物rpsL-43-P1/P2和rpsL-88-P1/P2(表 1),并通过反向 PCR获得用于构建rpsL基因特定位点(128号和263号位碱基,即rpsL基因ORF第43号和第88号位密码子)突变质粒pkrpsL43(A128G)和 pkrpsL88(A263G)。采用自然转化的方法将以上两种突变型质粒分别转化到亲本株中,产生SM抗性点突变菌株1401D43和1401D88。使用TSA++SM筛选培养,对该两株抗体菌株进行rpsL基因的PCR扩增,并对PCR产物进行测序验证。
1.6 SM抗性突变菌株MIC、MBC测定及抑菌环试验采用1.2的方法对EMS诱导产生的F7-1和F8-1(随机选取EMS诱导的第7代和第8代SM抗性菌株的其中一株)以及SM定点抗性突变的菌株1401D43、1401D88分别测定 MIC、MBC。并将其与野生型HPS SC1401MIC、MBC进行比较分析。
对亲本株 SC1401和各突变株 CF7-1、F8-1、1401D43及1401D88上适当稀释,保证各组OD600nm相同。取上述100 μL稀释菌液涂布于TSA++平板,静置数分钟后将平板划分为两部分,将牛津杯垂直轻放于区域中心的琼脂表面,轻压使之无缝接触。分别将 8 192 μg/mL、4 096 μg/mL的 SM 溶液各100 μL加入牛津杯中,置 37℃培养 12 h~24 h。观察并测量各个菌株抑菌圈的大小。
2 结果与讨论
2.1 HPS野生菌株SC1401的MIC、MBC测定结果通过二倍倍比稀释法测定HPS亲本株SC1401对SM的MIC和MBC,结果显示SC1401的MIC为24 μg/mL,MBC 为 32 μg/mL,因此,在后续试验中使用浓度为60 μg/mL的 SM对 HPS SC1401筛选SM抗性突变菌株。
2.2 HPS SC1401最适EMS诱变浓度的筛选将系列梯度浓度EMS和HPS混合培养,结果显示高浓度EMS具有较强的抗菌活性。EMS浓度为2.68 nmol/L、4.02 nmol/L、5.36 nmol/L的离心管中未见到絮状菌,浓度为1.34 nmol/L的离心管中可见絮状菌,但菌浓度(比浊法)比对照组(EMS浓度为0)低。表明当EMS终浓度高于2.68 nmol/L时,对HPS的生长具有抑制作用,因此诱导HPS SC1401突变的EMS最适浓度为1.34 nmol/L。
2.3 SM抗性突变菌株的筛选及耐药基因测序分析以最适浓度1.34 nmol/L的EMS间断诱导HPS SC1401菌株,经过TSA++SM筛选,显示 F1、F2、F3和F7至F11代的HPS均产生了SM抗性,对阳性转化子进行基因组提取、rpsL和rrs基因PCR扩增以及测序分析。结果显示,F1、F2、F3代的耐药菌的rpsL和rrs基因并未发生突变,而 F7~F11代的SM耐药菌株均仅rpsL基因发生突变,突变位点为rpsL基因的第43号位密码子和88号位的密码子,未发现其它位点发生突变,并且也未发现43号和88号密码子同时发生突变的耐药菌株。突变位点的密码子由AAA突变为AGA,其对应编码的氨基酸由Lys(赖氨酸)突变为Arg(精氨酸),这与报道的结核分枝杆菌结果一致[3]。也未发现rrs基因发生突变。尽管HPS与结核分枝杆菌的rpsL基因仅有58.67%相似性,但其抗SM的分子机制(突变位点及类型)却呈现出高度的相似性,表明这两种细菌抗SM的分子机制类似。
根据测序结果统计分析(表2),在诱变产生的耐药菌中,rpsL基因中这两个区域比rrs和其它基因位点更容易发生突变,由此推测rpsL基因第43号位和第88号位密码子突变是阻碍SM与细菌核糖体结合的主要突变位点。虽然有关报道表明rrs基因也与SM抗性有关,但本研究并未在rrs基因中发现任何突变,这可能是由于该基因突变未能引起高耐药水平而低于本实验检测限;或该基因突变效率不高而未能有效筛选出来,因此在HPS中,rrs基因突变是否引起SM耐药水平的提高以及具体的突变位点和突变类型有待进一步研究。F1、F2和F3代SM耐药菌基因测序结果提示,使用EMS诱导得到的前几代耐药菌产生的抗性可能不稳定,容易回复至SM敏感水平。
2.4 HPS SM抗性定点突变株的构建及突变位点测序验证对TSA++SM筛选得到的阳性转化子进行测序分析。采用表1中的引物扩增1401D43和1401D88的rpsL基因,并对PCR产物进行测序验证。结果显示,筛选得到的抗性菌株1401D43和1401D88分别在预期密码子位置(rpsL基因ORF第43号和第88号位)发生了点突变,均由AAA突变成了AGA,其编码的氨基酸残基由Lys(赖氨酸)变成了Arg(精氨酸)。表明,通过人工定点突变试验构建了SM抗性定点突变株,其突变位置与EMS诱变突变菌株一致。
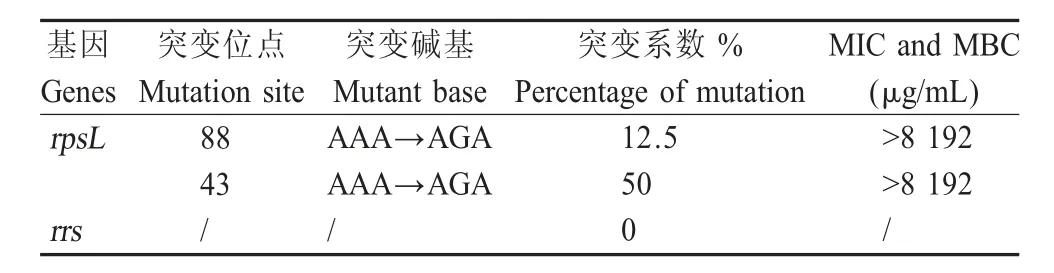
表2 SM抗性菌株rpsL、rrs基因测序结果分析Table 2 Analysis of the sequence of rpsL and rrs of SM resistant strains
2.5 SM抗性突变菌株MIC、MBC及抑菌环试验结果经检测,EMS诱导的抗性突变株F7-1和F8-1的MIC和MBC均高于8 192 μg/mL,表现出对SM完全耐药(表 3);抗性突变菌株 1401D43、1401D88的 MIC和 MBC同样高于 8 192 μg/mL,二者表型相符。表明不论是EMS诱变突变菌株还是定点点突变菌株均对SM完全耐药。由此判断HPS的SM耐药性与rpsL基因突变相关。1401D43和1401D88与EMS诱变突变菌株表型一致,进一步验证了rpsL基因第43号位和第88号位密码子突变与SM抗性产生有关。
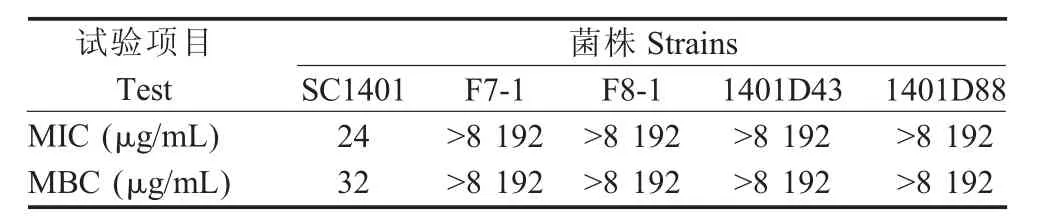
表3 HPS对SM的MIC、MBC测定结果Table 3 Detection of MIC and MBC of H.parasuis strains to SM
抑菌环试验结果显示抗性突变菌株F7-1、F8-1、1401D43和1401D88可以在置有SM溶液浓度为8 192 μg/mL 和 4 096 μg/mL 牛津杯的 TSA++上形成完整的菌苔,而亲本菌株SC1401则形成了直径为40 mm的抑菌环(图1),表明突变菌株比亲本株SM的抗性更高。由此推测rpsL基因第43号位密码子和第88号位密码子的突变和高SM抗性有关,这与巴塞罗那地区的结核分枝杆菌的研究结果类似[12]。这两个位点的突变很有可能是导致SM耐药的主要原因。

图1 SM抗性突变菌株抑菌环试验结果Fig.1 Inhibition ring test of SM resistant strains
本研究建立了EMS间歇诱导HPS突变的方法,并筛选出导致HPS对SM完全耐药的主要突变位点。结果显示,HPS的SM抗性主要由HPSrpsL基因第43号和第88号密码子突变引起,初步判断这种突变导致HPS核糖体蛋白S12翻译异常,致使HPS对SM耐药性的产生。本实验对HPS采用EMS诱导产生SM抗性菌株的方法和定点突变产生SM抗性菌株的方法为该菌的遗传操作提供了新的参考,同时为完善HPS SM耐药性的分子研究提供一定的参考依据。
