大熊猫源杯梗孢属真菌(Cyphellophora pluriseptata)的分离鉴定与致病性研究
2019-01-22马晓平姜尧章张和民曹三杰王承东左之才李德生凌珊珊夏介英王平峰
马晓平,姜尧章,张和民,古 玉,曹三杰,王承东,左之才,李德生,凌珊珊,夏介英,王平峰
(1.四川农业大学 动物医学院,四川 成都 611130;2.中国大熊猫保护研究中心,四川 雅安 625000;3.四川农业大学 生命科学院,四川 雅安 625014;4.四川省中医药科学院,四川 成都 610041)
大熊猫被公认为自然遗产和活化石,其作为“国宝”在我国外交上发挥着重要作用。大熊猫真菌病主要侵害其皮毛,也可侵害其皮肤或深部器官,不仅影响其生长发育和外观形象,而且降低抵抗力,增加发病率和死亡率。引起大熊猫皮肤病的病原种类不一,有石膏样毛癣菌引发的体癣病,毛霉所致的脱毛症,白色念珠菌引起体表红疹。张悦天等通过致病性试验发现大熊猫源石膏样小孢子菌对小鼠皮肤致病性强[1]。马晓平等发现枝孢样枝孢霉引起大熊猫体表水肿、脱毛等[2]。同时,也发现部分真菌引起大熊猫深部真菌感染。
暗色真菌是指菌丝和(或)孢子的细胞壁具有黑色素样颜色的一组真菌,可引起人类皮肤甚至多种组织的感染[3]。暗色丝孢霉病是由一大组条件致病性暗色真菌引起的浅表组织、皮肤、角膜、皮下组织甚至系统性感染[4]。其病原真菌种类繁多,包含50余属100余种暗色真菌,较重要的致病性暗色真菌包括链格孢、离蠕孢、斑替枝孢霉、旁孢霉、外瓶霉、裴氏着色霉、马杜拉分支菌属、瓶霉菌属、足放线病菌属、柱霉属、皮炎瓶霉属。预计仍然会有新的致病性暗色真菌被发现[5]。
暗色丝孢霉病的诊断通常是通过病原分离、孢子和菌丝的形态学特征和分子生物学特异性鉴定。取分泌物、脓液,最好是活组织进行培养有助于确诊。将标本接种于沙氏琼脂斜面上在25℃~30℃下培养4周,大多数致病真菌经过1~2周均可形成可见菌落。菌落为绒毛样或酵母样,呈灰色、暗绿色、暗棕色或黑色。根据其产孢结构特点进行鉴定[4]。大熊猫由暗色真菌枝孢样枝孢霉引起的暗色丝孢霉病在之前已有报道[2]。
杯梗孢属(Cyphellophora)真菌于1962年首次报道,并在人的皮肤和指甲中首次分离到Cyphellophora de Vries[6]。Vries等人于 1984年在人的皮肤和指甲中首次发现Cyphellophora pluriseptata[7],随后Bittencourt等人于 2002年报道由C.pluriseptata引起的患者左耳部大面积浸润的一例皮下暗色丝孢霉病[8]。其余未见关于C.pluriseptata的其他研究报道。本实验从自然发病的大熊猫患病处皮屑中分离到了一株真菌,对其进行形态学和分子生物学相结合的鉴定,结果其为C.pluriseptata,并对该菌进行了小鼠致病性和药敏试验。本实验填补了国内关于C.pluriseptata研究的空白,对大熊猫及人类的暗色丝孢霉病的防治奠定基础。
1 材料与方法
1.1 患病熊猫临床表现及病料样品采集某动物园一雌性大熊猫和同舍6月龄双胞胎幼崽脱毛,皮肤增厚出现肉芽肿等临床表现,其余精神食欲未见异常。脱毛区域用75%酒精消毒,用无菌刀片刮取患部至微微出血后取皮屑和被毛放置于无菌的黑色纸袋中密封,保存于4℃保温袋中送实验室。
1.2 实验动物及主要试剂实验用SPF级昆明小鼠购自四川省中医药科学院。放线菌酮以及氯霉素购自Amresco公司;酵母基因组DNA提取试剂盒(离心柱型)等分子生物学试剂均购自天根生化科技(北京)有限公司;GreenView购自成都博瑞克生物技术有限公司;伏立康唑、氟康唑、氟胞嘧啶等药敏纸片购自丹麦Rosco公司;含放线菌酮和氯霉素的沙堡弱氏葡萄糖蛋白胨培养基、沙堡弱氏葡萄糖蛋白胨培养基(SDA)均按文献报道的方法配制[1]。
1.3 患病大熊猫皮肤病的初步诊断无菌取大熊猫患处病健结合部皮屑、毛发数根,放置于载玻片上,滴加100 g/L KOH溶液两滴后盖上盖玻片,静置10 min镜检观察是否存在真菌菌丝、孢子,及其形态和排列等,即可做出初步诊断[1]。
1.4 真菌的分离培养与纯化将初步确诊的真菌性皮肤病样品接种到加入放线菌酮以及氯霉素的SDA培养基中,25℃恒温培养,每天观察1次。1周后,将单菌落接种到SDA培养基进行纯化,25℃培养,用以进行形态学和分子生物学鉴定、致病性试验以及药敏试验。
1.5 真菌分离株的形态学鉴定取单菌落接种于SDA培养基中观察菌落特征。用铜圈法制作菌株小培养以观察菌丝以及孢子形态。待接种的菌株产生孢子后,轻轻取下盖玻片置于载玻片上,利用棉兰染色、镜检并拍照。
1.6 真菌分离株的分子生物学鉴定
1.6.1 引物的设计与合成真菌内转录间隔区(Internal transcribed spacer,ITS)通用引物 ITS1(5'-TCC GTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCT TATTGATATGC-3')[2]由成都擎科梓熙生物技术有限公司合成。
1.6.2 真菌ITS区的PCR扩增按照酵母基因组DNA提取试剂盒说明书提取已纯化真菌菌落的DNA,以ITS1/ITS4为引物对其进行PCR扩增。采用50 μL反应体系,反应条件:95℃ 3 min;95℃30 s、55℃ 30 s、72℃ 1 min,35个循环;72℃10 min,4℃保存。扩增产物经1%琼脂糖凝胶电泳检测。
1.6.3 序列分析PCR产物由成都擎科梓熙生物技术有限公司测序。将已测定序列提交至GenBank,并获得序列号。在NCBI中用BLAST程序与Gen-Bank数据库中的相应基因序列进行相似性分析,用MEGA 6.0软件进行多重序列比较,并用近邻结合法(Neighbor-joining method)构建种系发生树,并通过1 000次自展分析(Bootstrap)对种系发生树进行置信度检测。
1.7 真菌分离株的动物致病性试验反复冲洗SDA培养基上25℃培养7 d的真菌分离株菌落,并用无菌生理盐水混匀制成浓度为1×107cfu/mL的菌悬液。将27只体况相近的6周龄~8周龄健康SPF昆明小鼠(雌雄不限)随机分为A、B、C 3组,每组9只。A组为免疫抑制组,B组为免疫正常组,C组为空白对照组。饲养一周消除应激反应后,A组用环磷酰胺和青霉素钠进行免疫抑制,腹腔注射环磷酰胺50 mg/kg和青霉素钠15 mg/只,隔天注射一次,连续3次,B组和C组注射相同剂量的生理盐水。A、B、C 3组再分别分为皮肤涂擦组A1、B1、C1,皮下注射组A2、B2、C2以及腹腔注射组 A3、B3、C3,每组3只。A1、B1组小鼠在实验前剪除背部约3 cm×2 cm的毛发。消毒后,用无菌粗砂纸磨破小鼠背部皮肤至点状渗血为宜,然后涂布菌悬液,A2、B2组分别在小鼠皮下注射菌悬液0.1 mL,A3、B3组小鼠在腹腔注射0.1 mL菌悬液。C1组小鼠皮肤涂擦生理盐水,C2组小鼠在皮下注射0.1 mL生理盐水,C3组小鼠在腹腔注射0.1 mL生理盐水。每日观察接种处皮肤是否有红斑、脱屑、结痂和毛发生长变化。若小鼠出现严重症状导致提前死亡则将该小鼠解剖并取小鼠患部进行逆培养,并提取真菌菌体DNA进行分子生物学鉴定。感染后第7 d,统一迫杀并解剖小鼠,肉眼观察主要器官的病变,并取接种处皮肤、病变明显的脏器用10%中性福尔马林固定,制作切片,进行HE染色,PAS染色并在光学显微镜下进行病理组织学观察及拍照。
1.8 真菌分离株的药敏试验将待测菌株菌悬液利用分光光度计调整其浓度为0.5麦氏比浊管透光度,约为5×105cfu/mL,再用生理盐水1:1稀释。按丹麦Rosco真菌药敏纸片扩散法标准,取0.5 mL菌液倾注于9 cm平皿,用玻棒将菌液涂布均匀,25℃干燥 10 min后贴药敏纸片。25℃培养24 h~36 h后测量。抑菌圈直径≥20 mm的记为敏感;抑菌圈直径在12 mm~19 mm范围内的记为中介;抑菌圈直径≤11 mm的记为耐药。
2 结果与讨论
2.1 患病大熊猫皮肤病的初步诊断在显微镜下观察到大熊猫患处皮屑及毛发存在菌丝和孢子,结合患部被毛部分脱落,皮肤层增厚出现肉芽肿,初步诊断该大熊猫患真菌性皮肤病。
2.2 真菌的分离纯化及形态学特征从皮屑和毛发样品中分离到1株真菌(编号为:JYZ030101)。该真菌在25℃,SDA培养基上生长良好,菌落干燥,呈墨绿色霉菌型菌落,边缘较整齐,除边缘外均生长墨绿色短毛(图1A)。显微特征观察显示菌丝呈管状不规则分布,可见杯状产孢结构以及大小不一的孢子(图 1B)。
2.3 真菌分离株的分子生物学鉴定经PCR方法扩增菌株JYZ030101的ITS区,获得617 bp的目的基因片段。序列提交 GenBank(KY283137)。用BLAST程序与GenBank数据库中收录的相关基因序列比对,显示分离株ITS区基因序列与C.pluriseptata(JQ766429.1)的ITS基因序列的相似性达 99%。采用邻接法经过1 000次自展分析得到系统发育树(图 2),分离株以 95%的支持率与C.pluriseptata聚在同一分支。表明分离株即为C.pluriseptata。
真菌核糖体RNA(rRNA)基因是串联重复排列的结构,每个重复结构编码18S、5.8S和26S基因,在两个不同的区域间存在ITS和基因间隔区[9]。ITS基因具有准确、快速、引物通用性强、便于高通量测序与分析等优点,因此被广泛应用于真菌系统发育、种间和种内遗传多样性研究[10]。近年,真菌rDNA ITS区测序后的BLAST分析已广泛应用于菌种的分子鉴定,相似性超过98%的菌株可认定为同一菌种[10]。本实验使用相邻接近法构建种系发育树,结果显示分离株JYZ030101与C.pluriseptata聚为同一支,置信度检测结果为99%,因此结合形态学与BLAST比对结果将JYZ030101鉴定为C.pluriseptata。

图1 C.pluriseptata的形态特征Fig.1 The morphological characteristics of C.pluriseptata
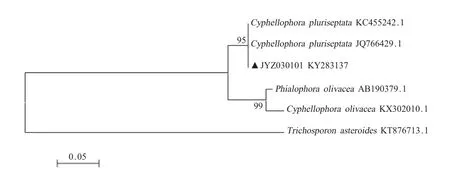
图2 C.pluriseptata系统发育树Fig.2 Phylogenetic tree based on the ITS sequences of C.pluriseptata
2.4 真菌分离株的致病性试验
2.4.1 实验动物临床症状涂擦注射菌悬液一周后,实验组小鼠精神食欲较差,被毛杂乱无光。对照组小鼠精神食欲没有明显变化。免疫抑制皮下注射组A2组小鼠注射处形成肉芽组织,中央凹陷,出现溃烂结痂(图3A)。涂擦组A1、B1小鼠涂擦部位没有明显变化,外伤基本痊愈,毛发开始生长。
2.4.2 剖检变化A2组小鼠皮下注射部位形成肉芽肿,表皮溃烂结痂。A3组一只小鼠皮肤肌肉组织苍白,肝脏颜色变暗。B组无明显变化。
2.4.3 真菌分离株接种小鼠后的病理组织学变化实验组小鼠皮肤主要为感染性肉芽肿,HE染色的病理切片可见肝脏脓肿,充血,小血管扩张且界限不明显、病灶呈现中性粒细胞为主的炎性细胞浸润,肝细胞增生、坏死、明显变形(图3A、3B)。肌肉坏死(图3C)。皮肤病变处细胞坏死,有成纤维细胞和大量炎性细胞浸润,表皮组织消失机化(图3D)。PAS染色在感染组织中可见形态各异的菌丝及圆形或卵圆形真菌孢子(图3E、3F)。
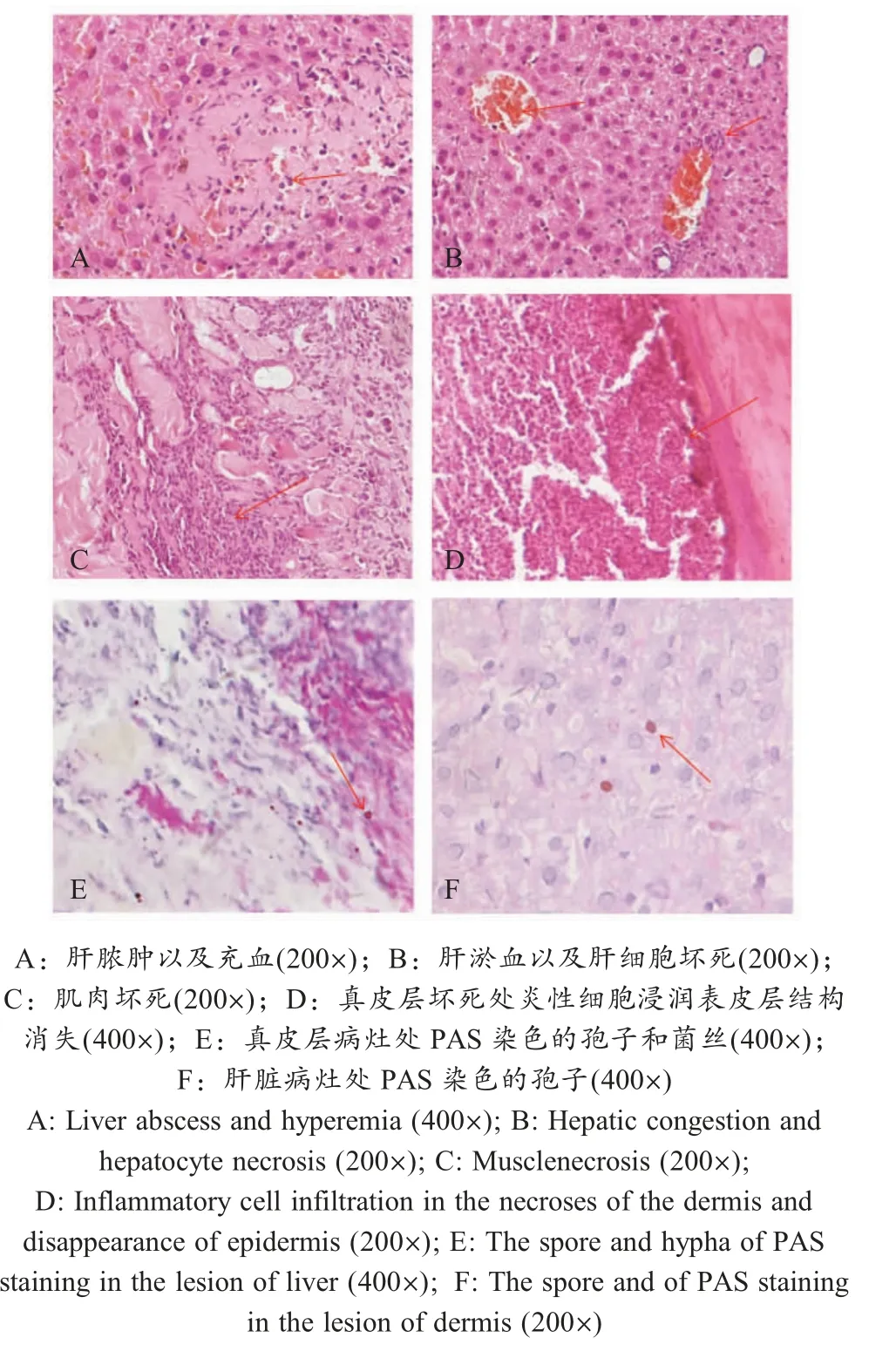
图3 小鼠组织病理变化Fig.3 Histopathological changes in the tissues of infected mice
取感染小鼠的病变区域逆培养真菌,提取DNA用ITS通用引物PCR扩增以后进行序列比对,结果表明与分离析(JYZ030101)的相似性为100%。致病性试验结果表明临床分离株(JYZ030101)通过不同的感染方式均可引起免疫抑制组小鼠不同程度的感染,而正常组和空白对照组均未见感染,表明该菌为条件致病菌。
2.5 药敏试验结果试验结果显示C.pluriseptata分离株对特比萘芬、氟胞嘧啶、伊曲康唑和两性霉素B表现为耐药,对克霉唑和咪康唑表现为中度敏感,对酮康唑、氟康唑和伏立康唑均表现为敏感(表1)。
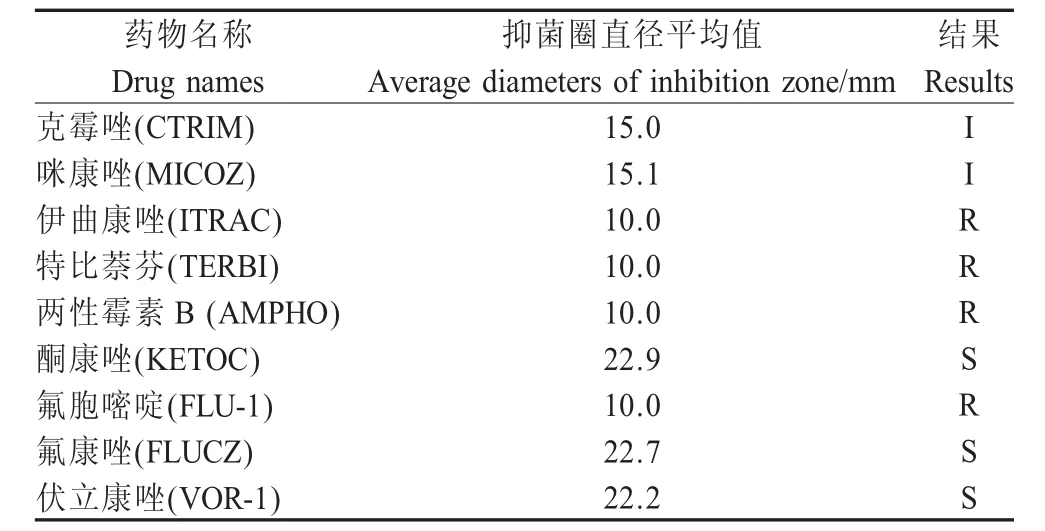
表1 C.pluriseptata对9种抗真菌药物敏感性Table 1 The susceptibility of C.pluriseptata to nine antifungal drugs
虽然皮肤癣菌感染和酵母菌感染在浅表皮肤真菌感染病例中占多数,但暗色真菌感染的报道也时有出现。有文献报道了人体体表分离的杯梗孢属和瓶霉属真菌共81株的药物敏感性试验,其中包括C.pluriseptata[3]。试验显示氟康唑对该菌的效果最差,特比萘芬效果最好,这两个结果与本实验有差异。而本实验结果显示C.pluriseptata对氟康唑敏感而对特比萘芬耐药,这可能是因为分离菌的来源不同,菌株有一定差异,导致药敏结果的差异。另外二者的菌株数均比较少,普遍性不强。该病例初步诊断为真菌性皮肤病后按照临床经验随机使用酮康唑乳膏涂擦患部,连续2周以后痊愈,在后期的药敏试验显示该菌的确也对酮康唑敏感。
临床上对C.pluriseptata相关研究十分有限,相关病例也比较少见,在动物感染试验中,可见其对免疫抑制组小鼠肝脏和真皮层的损害较重。表明该菌对免疫力低下的动物有造成侵袭性感染的可能。所以对该菌进行分离鉴定以及药物敏感性实验显得尤为重要。
