三种复合益生菌对菌群失调模型小鼠补偿生长和免疫功能的影响
2019-01-22付玉洁郑从森陈晓良钟浩杰李鹏升杜修贤
付玉洁,郑从森,陈晓良,叶 丰,钟浩杰,赵 欣,李鹏升,杜修贤
(沈阳工学院 生命工程学院,辽宁 抚顺 113122)
现代集约化养殖中,养殖户为充分利用土地建筑资源、增加经济效益,追求高密度、高生长速度,加之在动物饲养和疾病诊治中不合理的抗生素使用,使动物长期处于高应激状态,机体出现免疫力低下和抗生素相关性腹泻(AAD)等问题,降低其生长性能。目前研究表明使用头孢拉定和庆大霉素抗生素混合液对小鼠造模能够导致其肠道菌群多样性降低及真菌等部分致病菌的异常增殖[1-2],并对肠粘膜造成典型三度菌群失调[3],引起AAD症状。近些年对于益生菌的研究表明,饲喂益生菌具有帮助动物恢复肠道屏障的完整性和功能、增加肠粘液、改善肠道先天免疫、减少腹泻、中和肠毒素、促进营养消化能力、活化全身免疫系统、促进抗炎反应、刺激动物的特异性或非特异性免疫等作用[4-6]。因此,采取益生菌制剂对动物机体肠道微生态系统进行干预管理,在缓冲肠道应激、预防腹泻、纠正AAD、激发生长潜力、提高生长性能等方面很受关注。本实验以“好氧菌、兼性好氧菌、厌氧菌”为复配原则,复配成3种复合益生菌,即Ⅰ号复合益生菌(肠膜芽孢杆菌、凝结芽孢杆菌、屎肠球菌、粪肠球菌、丁酸梭菌),Ⅱ号复合益生菌(肠膜芽孢杆菌、凝结芽孢杆菌、植物乳杆菌、粪肠球菌、丁酸梭菌),Ⅲ号复合益生菌(肠膜芽孢杆菌、凝结芽孢杆菌、酿酒酵母、植物乳杆菌、丁酸梭菌)。对比研究补充3种复合益生菌对菌群失调模型小鼠的补偿生长和免疫功能的影响,为益生菌在畜禽促生长和提升免疫力应用中提供参考依据。
1 材料与方法
1.1 菌种、实验动物与主要试剂70只25日龄,体质量17 g~20 g的SPF级昆明鼠,雌雄各半,购自辽宁长生生物有限公司;植物乳杆菌(Lactobacillus plantarum)、凝结芽孢杆菌(Bacillus coagulansDH156)、丁酸梭菌(Clostetidium butyricumQA-08)购自中国普通微生物菌种保藏管理中心;酿酒酵母(Saccharomyces cerevisiaeBLNJ03)购自武汉大学中国典型培养物保藏中心;屎肠球菌(Enterococcus faeciumR-026)、肠膜芽孢杆菌(Bacillus mesentericus TO-A)、粪肠球菌(Streptococcus faecalisT-110)由沈阳工学院动物科学教研室保留菌种;硫酸庆大霉素购自河南润宏制药股份有限公司(批号:1707111);头孢拉定购自广州白云山医药集团股份有限公司(批号:2160032);营养肉汤、YEPD液体培养基、MRS肉汤、脑心浸液肉汤等均购自青岛海博生物科技有限公司;绵羊压积红细胞(SRBC)、豚鼠血清(实验室自制);氢化可的松、SA缓冲液等均购自上海善然生物科技有限公司;都氏试剂购自Sigma公司;印度墨汁购自上海源叶生物科技有限公司。
1.2 复合益生菌制备取好氧菌(肠膜芽孢杆菌、凝结芽孢杆菌)、兼性厌氧菌(粪肠球菌、屎肠球菌、酿酒酵母、植物乳杆菌)、厌氧菌(丁酸梭菌)等纯化菌种复壮后,用液体培养基扩大培养,平板计数后4℃保存(每周纯培养1次)。用时离心收集菌体,用生理盐水按配方调整菌数,即:Ⅰ号复合益生菌(肠膜芽孢杆菌 0.5×108cfu/mL、凝结芽孢杆菌 0.4×108cfu/mL、屎肠球菌 1×108cfu/mL、粪肠球菌 1×108cfu/mL、丁酸梭菌4.6×108cfu/mL);Ⅱ号复合益生菌(肠膜芽孢杆菌0.5×108cfu/mL、凝结芽孢杆菌0.4×108cfu/mL、粪肠球菌 1×108cfu/mL、植物乳杆菌 1×108cfu/mL、丁酸梭菌 4.6×108cfu/mL);Ⅲ号复合益生菌(肠膜芽孢杆菌0.5×108cfu/mL、凝结芽孢杆菌 0.4×108cfu/mL、酿酒酵母 3×108cfu/mL、植物乳杆菌 1×108cfu/mL、丁酸梭菌 4.6×108cfu/mL)。
1.3 实验动物预处理70只SPF级昆明鼠,适应饲养4 d后,参照文献[2-3]进行菌群失调造模,取14只小鼠灌胃生理盐水作为正常组,另取56只小鼠灌胃头孢拉定和庆大霉素抗生素混合液构建菌群失调模型,均按剂量0.35 mL/次,2次/d,连续5 d,直至造模小鼠全部出现粪便稀软等AAD症状。
1.4 实验设计将预处理模型小鼠分为5组,每组14只(雌雄各半),即正常组、模型组、实验Ⅰ组、实验Ⅱ组、实验Ⅲ组。各组小鼠给予复合益生菌的方式、灌胃体积和天数,见表1。实验期为30 d,在第20 d时参照文献[7]方法,对除正常组外各组模型小鼠进行HY免疫抑制,即自第20 d时隔天1次,连续5次对小鼠肌内注射40 mg/kg HY;饲养条件控制在22℃~24℃,自然照明,自由饮水和采食。
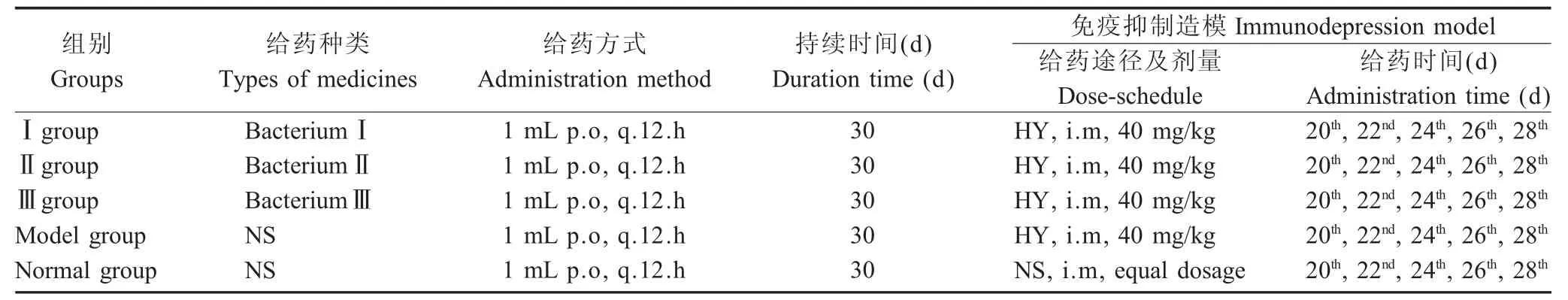
表1 实验设计Table 1 Experimental design
1.5 小鼠周平均增重测定实验期间每周测定一次各组小鼠的体质量并计算其体质量差值。
1.6 小鼠单核-巨噬细胞吞噬指数和脾指数测定实验第29 d,参照文献[7]按0.1 mL/10 g尾静脉注射印度墨汁后,立刻计时,在第2 min和10 min(t2、t10)时尾尖取血 20 μL,混入 1 mL Na2CO3溶液,测其A600nm值。迫杀小鼠,取其脾脏、肝脏称重。计算单核-巨噬细胞吞噬指数和脾指数:单核-巨噬细胞吞噬指数=体重/(脾重+肝重)×K1/3,K=(lgA1-lgA2)/(t2-t10);脾指数(mg/kg)=脾重/体重。
1.7 绵羊红细胞诱导小鼠足跖增厚度测定在第25 d,参照文献[7],按随机数字表法在每组分别选定6只小鼠(雌雄各半),每只鼠腹腔注射0.2 mL 2%(v/v)SRBC致敏。SRBC免疫第5 d测定SRBC致敏小鼠的右后足跖部厚度后,于该处皮下注射20 μL 20%(v/v)SRBC,24 h后用游标卡尺测量由迟发型变态反应引起的右后足跖部厚度。公式:足跖增厚(mm)=注射后厚度值-注射前厚度值。
1.8 小鼠半数溶血值(HC50)测定在第30 d,参照文献[7],眼球采血迫杀SRBC致敏小鼠,分离血清,取血清20 μL,加 SA液4 mL,取稀释后血清1 mL置于试管,依次加0.5 mL 10%SRBC、1 mL补体(用SA液1∶8稀释),另设不加血清对照管。37℃恒温水浴20 min后,冰浴终止反应。2 000 r/min,10 min离心取上清1 mL,加都氏试剂 3 mL。同时设半数溶血对照管,分别加0.25 mL 10%SRBC、3.75 mL都氏试剂,充分混匀,静置10 min。于540 nm处测定吸收度(ABS)值。
1.9 统计学方法试验数据用平均值±标准差(±SD)表示,采用SPSS24.0软件处理数据,组间均数比较用t检验,方差不齐的数据选择非参数检验分析,p<0.05为显著性差异。
2 结果
2.1 复合益生菌对菌群失调模型小鼠的补偿生长作用连续30 d灌胃复合益生菌,记录各组小鼠平均周增重。结果显示,各益生菌实验组小鼠给药后第1周平均周增重均显著高于模型组和正常组(p<0.05)。各实验组小鼠第2周、第3周平均周增重组间差异不显著(p>0.05),但各益生菌实验组小鼠平均周增重优于正常组和模型组,呈增长趋势。第4周时经HY处理的各实验组小鼠平均周增重均极显著低于正常组(p<0.01),其中补充Ⅰ号和Ⅱ号复合益生菌的试验Ⅰ组和Ⅱ组小鼠平均周增重显著高于模型组(p<0.05)(图1)。以上结果表明持续补充3种复合益生菌均能够有效促进菌群失调小鼠生长,帮助重建肠道菌群,增强小鼠消化机能,其中Ⅰ号和Ⅱ号复合益生菌能够有效减轻因免疫抑制应激导致的负生长,帮助小鼠恢复体质。
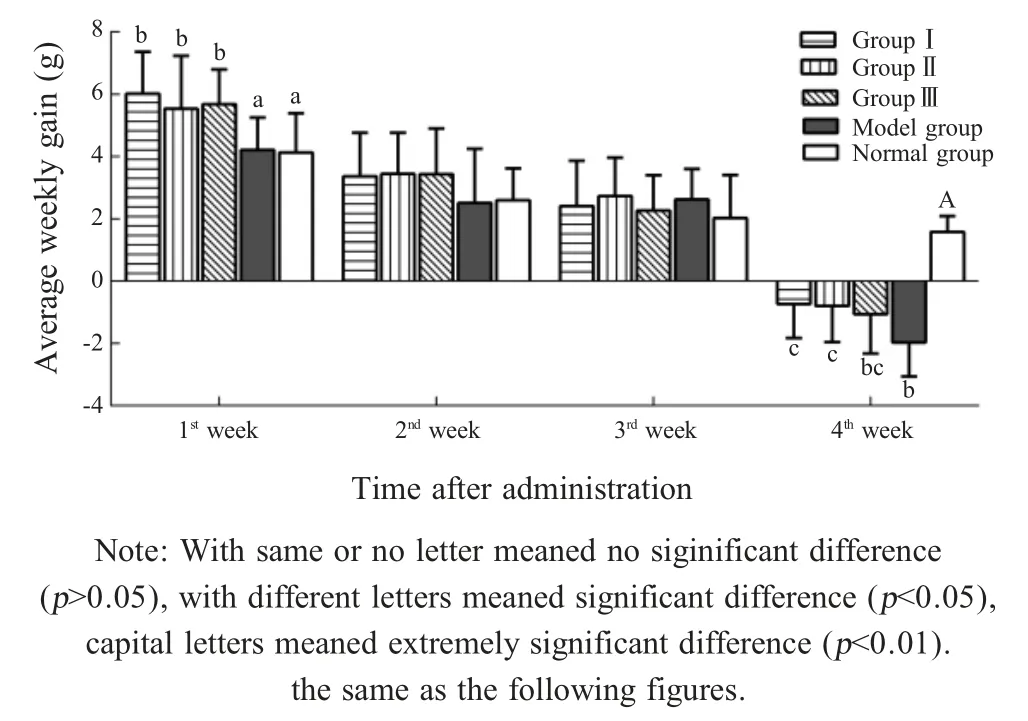
图1 各组小鼠平均周增重比较(±SD,n=14)Fig.1 Comparison of the average weekly gain of the mice in each group(±SD,n=14)
2.2 复合益生菌对菌群失调模型小鼠单核-巨噬细胞吞噬指数和脾指数的影响末次肌注HY后次日,即给药第29 d时测定各组小鼠单核-巨噬细胞吞噬指数和脾指数。结果显示,末次肌注HY第2 d,各实验组小鼠的单核-巨噬细胞吞噬指数和脾指数均极显著低于正常组(p<0.01),表明菌群失调模型小鼠机体免疫力处于低下状态。各益生菌实验组小鼠的单核-巨噬细胞吞噬指数均优于模型组,其中试验Ⅰ组显著高于模型组(p<0.05)。各益生菌实验组小鼠的脾指数均显著高于模型组(p<0.01或p<0.05)(图2)。以上结果表明持续补充3种复合益生菌均可显著促进免疫低下的菌群失调模型小鼠脾脏发育,其中Ⅰ号复合益生菌能够显著提高模型小鼠的单核巨噬细胞吞噬功能,具有增强机体非特异性免疫功能。
2.3 复合益生菌对菌群失调模型小鼠足跖增厚度和HC50的影响于SRBC免疫第5 d,即第给药30 d时测定各组小鼠的迟发型变态反应-足跖增厚度和HC50。结果显示,经SRBC免疫第5 d时,经HY处理的各实验组小鼠足跖增厚度和HC50均显著低于正常组(p<0.05),表明菌群失调模型小鼠机体免疫力处于低下状态。实验Ⅰ组和Ⅱ组小鼠的足跖增厚度显著高于模型组(p<0.05)。各益生菌实验组小鼠的HC50显著或者极显著高于模型组(p<0.05或p<0.01)(图3)。表明持续补充3种复合益生菌均能够显著提高模型小鼠血清中抗SRBC抗体(溶血素)水平,其中Ⅰ号、Ⅱ号复合益生菌能有效增强小鼠迟发型变态反应,具有提升小鼠细胞免疫水平,增强机体特异性免疫功能的作用。
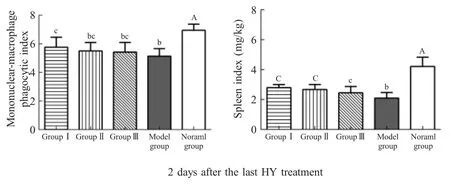
图2 各组小鼠单核-巨噬细胞吞噬指数和脾脏指数的测定(±SD,n=8)Fig.2 Determination of the mononuclear-macrophage phagocytic index and spleen index in each group(±SD,n=8)
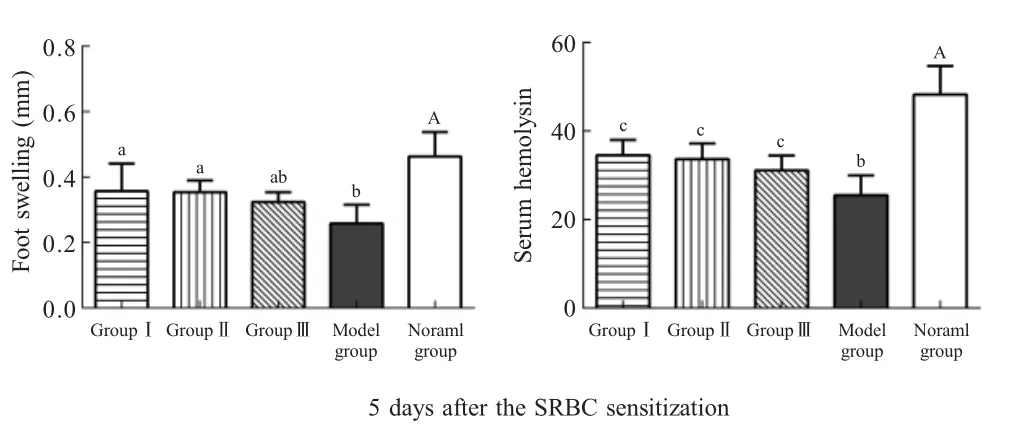
图3 各组小鼠足跖增厚度和血清溶血素水平的测定(±SD,n=6)Fig.3 Determination of the foot swelling and serum hemolysin in each group(±SD,n=6)
3 讨论
越来越多的研究表明饲料中添加复合益生菌剂能够显著提高动物生长性能[8-10]。本研究结果显示,经抗生素菌群失调造模后,造模小鼠持续服用3种复合益生菌均能够显著促进其补偿性生长。表明给抗生素诱导的菌群失调模型小鼠灌胃复合益生菌后,复合菌剂中好氧芽孢杆菌、兼性厌氧菌能快速增殖消耗肠内氧气,营造厌氧环境,与厌氧丁酸梭菌共同促进肠道原厌氧益生菌增殖,快速补偿缺失的益生菌种类及数量,与病原菌竞争粘附位点和营养物质,重建肠道内环境菌群平衡,增强肠道对营养物质吸收,有效补偿模型小鼠的生长。此外,本研究结果显示,给药第4周时经HY处理的各实验组小鼠平均周增重均极显著低于正常组(p<0.01),其中补充Ⅰ号和Ⅱ号复合益生菌的实验Ⅰ组和Ⅱ组小鼠平均周增重显著高于模型组(p<0.05),其中实验Ⅲ组小鼠体质量下降明显。表明注射HY免疫抑制的菌群失调模型小鼠,需要消耗一定能量抵抗免疫抑制应激和维持肠道菌群平衡而导致体质量减轻。而补充益生菌的各实验组,能有效维持小鼠重建的肠道菌群平衡,增强肠道对营养物质吸收,抵抗应激反应。其中补充含酿酒酵母的Ⅲ号复合菌试验组小鼠体质量下降明显,可能是模型小鼠处于免疫抑制状态时,肠道酵母菌过度生长,转变为机会致病菌进而影响小鼠生长,如Llopis等研究表明从22种商业产品中分离出的商品编号为 D2、D4、D14的酿酒酵母菌株,经静脉接种和口服接种抗生素治疗(损伤胃肠粘膜)和地塞米松免疫抑制治疗的模型小鼠,表现出不同程度致病性,表明酿酒酵母是一种机会致病菌[11]。因此,关于本实验中Ⅲ号复合菌中酿酒酵母在菌群失调小鼠经历免疫抑制后是否表现出机会致病性、其增益作用如何、肠道菌群结构稳定性和丰度变化等尚需进一步研究确定。
非特异性免疫,是机体始终开启的以提供快速保护的先天性免疫,也是特异性免疫的基础。脾脏被认为是血液源抗原的专职淋巴结,入侵血液的异物能够被迅速激活的血液单核-巨噬细胞全部捕获而清除。常将脾指数、单核-巨噬细胞吞噬指数作为评价非特异性免疫功能的指标[7]。史自涛等研究显示饲喂粪肠球菌能显著促进断奶仔猪肝脏和脾脏的发育[12],Strompfova等研究表明粪肠球菌可显著提高血清中总蛋白含量和白细胞吞噬指数[13],Dvorožňáková等研究表明饲喂(屎肠球菌、肠球菌、发酵乳杆菌、植物乳杆菌)复合菌能显著提高感染旋毛虫小鼠第1至3周内的血液白细胞吞噬活性[14]。本研究结果显示,持续口服3种复合益生菌均能显著提高免疫抑制小鼠的脾脏指数,其中Ⅰ号复合益生菌能显著升高其单核-巨噬细胞吞噬指数,具有增强模型小鼠非特异性免疫力的作用。原因可能是益生菌及其代谢产物中免疫激活物质作为免疫调节剂,通过刺激胃肠道免疫反应增加上皮细胞和免疫细胞的数量,提高巨噬细胞吞噬活性和刺激抗体产生来帮助免疫系统发育[2],进而增强小鼠机体的非特异免疫功能。
特异性免疫,又称获得性免疫,包括由B淋巴细胞介导的体液免疫和T淋巴细胞介导的细胞免疫,二者相辅相成,为机体提供最后的免疫防御。通过测定迟发型变态反应-足跖增厚度和血清溶血素水平是评价机体细胞免疫功能、体液免疫状态的常用方法[7]。据报道,益生菌能够调节 NF-κB和丝裂原活化蛋白激酶(MAPK)等信号转导,刺激肥大细胞、巨噬细胞等分泌各种细胞免疫分子,参与炎症反应,提高T淋巴细胞和B淋巴细胞活力,启动特异性免疫应答[15-16]。本研究结果显示,实验Ⅰ组和Ⅱ组小鼠的足跖增厚度显著高于模型组(p<0.05),各益生菌实验组小鼠的HC50显著或者极显著高于模型组(p<0.01或p<0.05)。与潘香香等的复合益生菌(植物乳杆菌、肠膜明串珠菌、干酪乳杆菌)能显著提高小鼠特异性免疫功能结果相似[17]。表明持续补充3种复合益生菌均能显著提高模型小鼠血清中抗SRBC抗体(溶血素)水平,其中Ⅰ号、Ⅱ号复合益生菌能有效增强小鼠迟发型变态反应。相比之下,持续补充Ⅰ号和Ⅱ号复合益生菌,更有助于限制免疫抑制状态下的造模小鼠肠内真菌的过度增殖,降低真菌逃避宿主防御机制并表现出机会性感染的几率,维持原有肠道微生态系统处于平衡状态;同时各正常菌群包括口服的益生菌能够充当免疫佐剂,活化肠道管壁内弥散性淋巴组织,使SIgA分泌增强,提高免疫识别力,诱导巨噬细胞和T、B淋巴细胞产生细胞因子,通过淋巴细胞再循环而活化全身免疫系统[18],增强宿主免疫功能。
综上所述,补充复合益菌Ⅰ号和Ⅱ号对模型小鼠的补偿生长、单核-巨噬细胞吞噬功能、足趾增厚度、血清溶血素水平的增强效果优于含酿酒酵母的Ⅲ号复合菌,并且显著高于正常组和模型组。表明采用复合益生菌Ⅰ号和Ⅱ号对畜禽肠道微生态系统进行干预管理,能有效纠正AAD,缓解机体应激反应,提升机体免疫力,提高生长性能的作用。此外,本研究仍需从3种复合益生菌在菌群失调小鼠经历免疫抑制后其肠道菌群结构稳定性和丰度变化、酿酒酵母是否具表现机会致病性、对其肠道绒毛和隐窝影响等方面进一步研究确定。
