布鲁氏菌DnaK基因缺失株的构建及其功能初步评价
2019-01-22张俊波印双红易继海方维焕王嘉福李志强陈创夫
张俊波,印双红,易继海,张 红,方维焕,王嘉福,郭 飞,李志强,陈创夫
(1.铜仁学院 农林工程与规划学院/铜仁市文化科技产业创新研究中心,贵州 铜仁 554300;2.浙江大学 动物科技学院,浙江 杭州 310058;3.铜仁学院大健康学院,贵州 铜仁 554300;4.石河子大学 动物科技学院,新疆 石河子 832000;5.商丘师范 学院生物与食品学院,河南 商丘 476000)
布鲁氏菌病是一种严重危害人和家畜健康的人兽共患传染病[1]。布鲁氏菌为革兰氏阴性的兼性胞内寄生菌,其急性期的临床特点主要为发热、关节和肌肉痛等;动物布鲁氏菌病的特点是生殖器官坏死和肉芽肿的形成,引起流产、睾丸炎及关节炎等症状。全国的布鲁氏菌病疫情形势严峻,因此研究布鲁氏菌及其对宿主细胞的致病机制,为布鲁氏菌疫苗研发和和防控提供参考依据,对国民经济的发展和社会的安全具有重大的意义。
布鲁氏菌毒力基因依据同源性分析,从功能上可划分为12类,包括184个毒力基因[2],其中较为重要的毒力因子包括表面分子、分泌/转运系统、调控系统、金属离子获取系统、氨基酸代谢系统、糖代谢系统、DNA/RNA代谢系统、维生素获取因子/共栖因子、应激蛋白/泛素、氧化还原参与分子、氮源代谢分子、暂不可分类分子、未知蛋白分子。热休克蛋白70(DnaK)基因归属应激蛋白/泛素毒力因子。目前对DnaK基因的具体功能还不清楚,为此,本研究利用同源重组方法构建粗糙型布鲁氏菌M5-90疫苗缺失株 M5-90ΔDnaK,并在细胞模型中验证其毒力,通过小鼠模型验证其免疫效果,为进一步研究该基因的功能和疫苗开发提供科学依据。
1 材料与方法
1.1 主要实验材料羊种布鲁氏菌M5-90疫苗株、大肠杆菌E.coliDH5α克隆菌株和pUC19K质粒均由新疆地方与民族高发病教育部重点实验室提供;人胚胎滋养层细胞(HPT-8)由本实验室保存;引物Oligo由通用生物系统(安徽)有限公司合成;pMD18-T载体、限制性内切酶、T4连接酶、DNA Maker均购自TaKaRa公司;TaqDNA聚合酶、dNTP、琼脂糖凝胶回收试剂盒、质粒DNA小提试剂盒均购自天根生化科技(北京)有限公司;蛋白Marker由军事医学科学院惠赠;IPTG购自生工生物工程(上海)有限公司;细胞因子ELISA检测试剂盒购自美国GBD公司;小鼠布鲁氏菌IgG ELISA检测试剂盒购自RD公司;6周龄雄性BALB/c小鼠购自新疆实验动物中心。
1.2 pMD18-T-ΔDnaK-Kana重组质粒的构建根据羊种布鲁氏菌标准株16MDnaK基因(29594878)上下游同源臂基因序列和pUC19K质粒携带的Kan+基因序列设计相应的引物(表1)。以布鲁氏菌M5-90疫苗株的基因组为模板,以DnaK-N-F、DnaK-N-R为引物扩增DnaK基因上游同源臂(N端);以DnaK-C-F、DnaK-C-R为引物扩增DnaK基因下游同源臂序列(C端);以 pUC19K为模板,Kana-F、Kana-R为引物扩增Kana基因。将DnaK基因下游同源臂及Kana基因片段通过融合PCR融合后鉴定正确的融合片段由上海生工生物工程技术服务有限公司测序。将鉴定正确的融合片段克隆至pMD18-T载体,构建重组质粒pMD18-T-ΔDnaK-Kana。
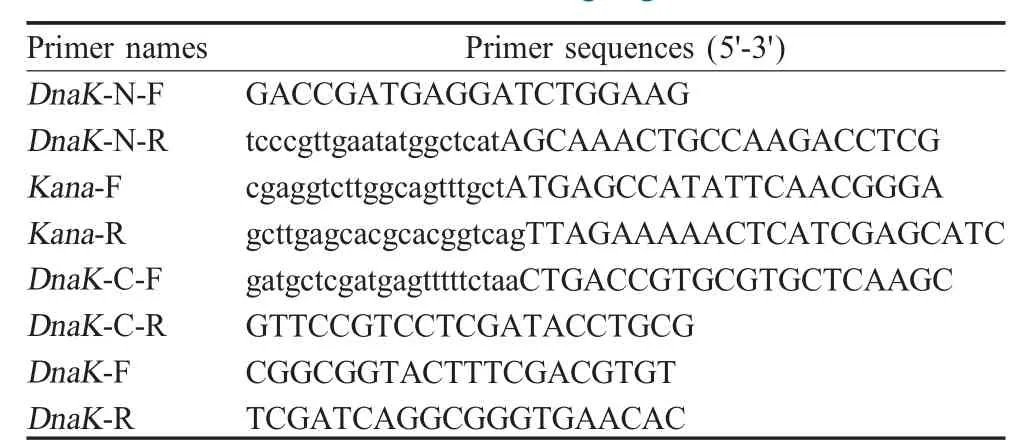
表1 目的基因扩增的引物序列Table 1 Primers for the target gene of Brucella
1.3 布鲁氏菌M5-90ΔDnaK缺失株的筛选与鉴定取500 ng同源重组质粒 pMD18-T-ΔDnaK-Kana电转化至 100 μL预先制备的布鲁氏菌感受态细胞中[3],转化菌株涂布于含有卡那霉素(50 μg/mL)的TSB平板培养基筛选 M5-90ΔDnaK缺失株。以DnaK-F/DnaK-R为引物扩增DnaK部分基因对M5-90ΔDnaK进行鉴定。挑取具有卡那霉素抗性的菌落,分别划线至卡那霉素抗性的TSB平板培养基和氨苄青霉素的(50 μg/mL)TSB平板培养基,连续纯化传代20代后,挑取只有卡那霉素抗性菌落,用上述PCR鉴定方法检测每一代重组菌的遗传稳定性。
1.4 布鲁氏菌生长曲线的测定将培养至OD600nm≈0.6的 M5-90和 M5-90ΔDnaK稀释到 OD600nm≈0.1继续振荡培养。培养过程中每2 h取样 25 μL,直至细菌进入平台期,将菌液用终浓度为4%的甲醛灭活12 min,检测其OD600nm的变化,并绘制M5-90和M5-90ΔDnaK的生长曲线。
1.5 布鲁氏菌胞内存活试验将M5-90和M5-90ΔDnaK分别以 MOI为 100∶l比例感染 6孔板中形成单层的HPT-8细胞,37℃共孵育1.5 h,PBS洗除未感染的胞外细菌后,添加含有50 μg/mL庆大霉素的DMEM培养基以杀死胞外菌,PBS漂洗,更换无抗生素的细胞培养液,孵育0、6 h、12 h、24 h和36 h时用0.2%的TritonX-100裂解细胞,室温放置12 min以释放胞内菌,对裂解液倍比稀释,涂布固体平板,进行活菌计数,重复试验3次。
1.6 小鼠细胞因子及抗体水平的检测选取6周龄的BALB/c小鼠将其分为3组,每组各10只。对实验组小鼠分别接种M5-90ΔDnaK缺失株,阳性对照组接种M5-90疫苗株,对二者均采用腹腔注射方式接种(3.0×106cfu/0.2 mL);阴性对照组注射PBS,采集接种后7 d、14 d、28 d的小鼠血液分离血清,采用小鼠细胞因子ELISA检测试剂盒测定小鼠血清中IFN-γ细胞因子水平,采用小鼠IgG ELISA检测试剂盒检测其血清中IgG抗体OD450nm值。以时间为横坐标,细胞因子水平或者IgG抗体OD450nm值为纵坐标作图,绘制接种M5-90和M5-90ΔDnaK后小鼠血清中IFN-γ和IgG含量曲线图。
1.7 统计学分析采用SPSS17.0统计软件进行分析,数据用平均数±标准差(±SD)描述,多组样本间平均数用方差分析,两组间比较采用两样本平均数的t参数检验或q检验。
2 结果
2.1 重组质粒 pMD18-T-ΔDnaK-Kana的构建与鉴定以羊种布鲁氏菌M5-90株为模板,PCR扩增其DnaK基因的上下游同源臂,结果显示得到约1 300 bp和900 bp的基因片段(图 1),以pUC19K质粒为模板利用引物Kana-F/Kana-R扩增Kana抗性基因,得到约800 bp的DNA片段,与预期一致(图1A),表明获得了DnaK基因的上下游同源臂及Kana抗性基因。用融合PCR的方法将DnaK基因上、下游同源臂及Kana抗性基因融合。结果显示,得到约3 000 bp的基因融合片段,与预期相符(图1B)。测序后利用DANMAN软件将融合基因与各自相应基因进行同源性比对,结果显示融合基因序列与DnaK上下游同源臂K1、K2和Kana抗性基因的同源性均为100%。表明获得了DnaK上、下游同源臂及Kana抗性基因的融合片段。将获得的融合基因片段克隆至pMD18-T载体构建重组质粒pMD18-T-ΔDnaK-Kana。利用引物Kana-F/Kana-R PCR扩增该重组质粒Kana抗性基因并测序验证。结果显示,获得约800 bp的目的条带,与预期相符(图1C),表明构建了重组质粒pMD18-T-ΔDnaK-Kana。

图1 重组质粒 pMD18-T-ΔDnaK-Kana的构建与鉴定Fig.1 Construction and identification of pMD18-T-ΔDnaK-Kana recombinant plasmid
2.2 缺失株M5-90ΔDnaK的构建及遗传稳定性检测将重组质粒 pMD18-T-ΔDnaK-Kana电转化至布鲁氏菌感受态细胞中筛选获得M5-90ΔDnaK缺失株。用DnaK-F/DnaK-R引物对布鲁氏菌M5-90和M5-90ΔDnaK进行鉴定,结果显示M5-90扩增出约600 bp的DnaK部分基因,而 M5-90ΔDnaK的扩增结果为阴性(图2),表明筛选到了DnaK基因缺失株。将M5-90ΔDnaK缺失株连续传至20代,每一代用引物进行PCR检测,结果显示均无该600 bp的目的条带,表明获得能够稳定遗传的M5-90ΔDnaK株。

图2 缺失株M5-90ΔDnaK的PCR鉴定Fig.2 Identification of M5-90ΔDnaK mutant by PCR
2.3 M5-90ΔDnaK体外生长曲线测定取不同时间培养的 M5-90和 M5-90ΔDnaK菌液甲醛灭活后,检测其OD600nm值,绘制二者的体外生长曲线。结果显示,布鲁氏菌M5-90和M5-90ΔDnaK的生长曲线在不同时间虽存在微小差异但总体生长趋势一致(图3),大约在36 h细菌生长进入平台期。表明DnaK基因缺失不影响M5-90的体外生长。
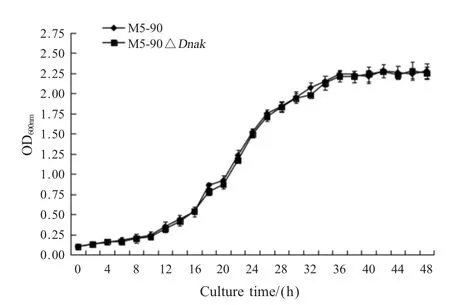
图3 M5-90ΔDnaK生长曲线Fig.3 Growth curves of M5-90ΔDnaK and M5-90
2.4 M5-90ΔDnaK胞内存活数量的检测布鲁氏菌 M5-90和 M5-90ΔDnaK以 MOI 100:l感染 HPT-8细胞,在不同的时间点对二者进行活菌计数。结果显示,胞内的M5-90和M5-90ΔDnaK活菌数量在感染 0和6 h时无显著差异(p>0.05),而在感染 12 h、24 h和 36 h时细胞内 M5-90ΔDnaK数量显著少于M5-90数量(p<0.05)(图 4)。表明缺失DnaK基因可降低布鲁氏菌在HPT-8细胞内的存活能力。
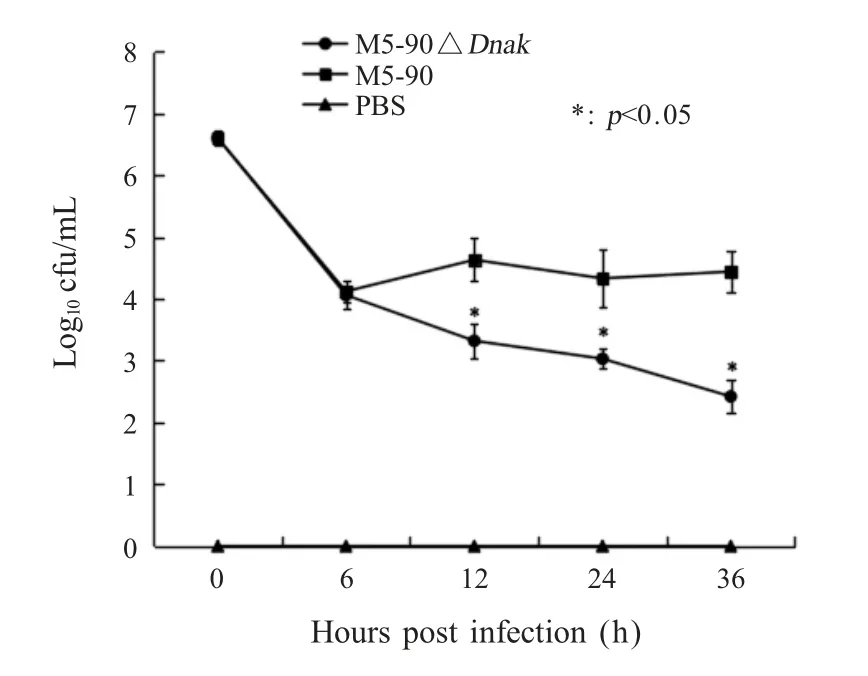
图4 M5-90ΔDnaK胞内存活数量检测Fig.4 Intracellular survival number of M5-90ΔDnaK
2.5 小鼠血清细胞因子IFN-γ水平变化利用ELISA试剂盒检测免疫后第7 d、14 d和 28 d时小鼠血清中IFN-γ含量,结果显示,布鲁氏菌M5-90组和 M5-90ΔDnaK组小鼠血清中 IFN-γ的含量随着免疫时间的延长而增加,且二者之间无显著差异(p>0.05),但均显著高于 PBS 组(p<0.01)(图 5)。表明缺失DnaK基因并不影响布鲁氏菌诱导小鼠产生抗布鲁氏菌的细胞免疫。

图5 免疫小鼠血清中IFN-γ水平Fig.5 The level of IFN-γ in the serum of the immunized mice
2.6 小鼠血清IgG抗体水平变化利用ELISA试剂盒检测免疫后第7 d、14 d、28 d时小鼠血清中IgG的含量,结果显示,布鲁氏菌M5-90组和M5-90ΔDnaK组小鼠血清中IgG水平随着免疫时间的延长而增加,且二者之间无显著差异(p>0.05),但均显著高于 PBS组(p<0.01)(图 6)。表明缺失DnaK基因并不影响布鲁氏菌诱导小鼠产生特异的IgG抗体。
3 讨论

图6 免疫小鼠血清中IgG抗体水平Fig.6 The level of IgG in the serum of the immunized mice
目前,针对布鲁氏菌病国际上多采用活疫苗免疫来防控,常用的有S19、RB51、Rev.1及S2疫苗等,但活疫苗存在一些问题;接种疫苗后产生的血清学反应与感染相似,造成诊断困难等[4-5];Rev.1疫苗带有链霉素抗性基因,导致链霉素治疗布鲁氏菌病的效果较差[6]。M5疫苗可以为接种动物提供良好的保护力[7],但该菌株毒力强,在小鼠体内存活期可超过35周,并且通常会出现从光滑型到粗糙型的变异,它是我国目前使用的疫苗中毒力最强的菌株[8]。因此,本研究所将M5在鸡成纤维细胞传 90代,培育出M5-90疫苗株。该菌株毒力相对降低,具有良好的免疫原性。但M5-90也有缺点[3]:疫苗免疫可导致部分怀孕母畜流产,因此仍需对M5-90疫苗进行改造。本研究构建的布鲁氏菌基因缺失株M5-90ΔDnaK在HPT-8细胞内的存活能力明显下降;接种小鼠后,其血清能够产生与M5-90相似的免疫反应,为布鲁氏菌病的防治和该菌致怀孕母畜流产的分子机制提供了新思路。
热休克蛋白主要包括HSP110、HSP90、HSP70、HSP60等分子[9-10]。HSP70家族是热休克蛋白抗病原微生物中免疫反应的重要调控子[11]。其在原核细胞中被称为DnaK,它的免疫优势与其特性和功能可能有关。DnaK在不同细菌种属间的序列高度保守,当机体受到细菌感染时,之前感染的病原微生物产生的记忆细胞能够识别其保守序列[12]。正常情况下DnaK在细菌体内的表达水平低,但却在正常的细胞生理活动中发挥关键作用。当细菌遇到恶劣环境的刺激,细胞内的蛋白合成翻译受到抑制,诱导其合成大量的DnaK并在数分钟内达到最高,因此增加了细菌的抗应激能力[13]。DnaK是在细菌的抗热应激、抗氧化应激、抗酸碱应激中发挥保护功能的毒力因子,还调控其它一些毒力因子的表达水平[14]。本研究结果显示,DnaK基因缺失不影响M5-90的体外生长,并且可降低其在HPT-8细胞内的存活能力。由于HPT-8细胞是布鲁氏菌侵染的靶细胞,HPT-8细胞受损伤是引起母畜流产的重要原因,因此DnaK基因缺失可以降低布鲁氏菌导致的HPT-8细胞的损伤。因此DnaK基因可能与M5-90导致怀孕母畜流产有关。INF-γ是抗布鲁氏菌免疫反应中关键性的细胞因子[15],主要由活化后的NK细胞、CD4+T和CD8+T细胞产生。血清中的抗体在抗布鲁氏菌感染的过程中起着重要的作用,抗体的滴度与机体抗布鲁氏菌的抵抗呈正相关,因此检测血清中特异性IgG抗体水平也是评价布鲁氏菌疫苗免疫原性的一个重要指标[16]。本研究显示缺失株M5-90ΔDnaK与亲本株M5-90诱导机体产生的INF-γ和IgG增长趋势相似,并且随着免疫时间的延长均呈上升趋势,表明布鲁氏菌缺失株M5-90ΔDnaK可使宿主产生良好的细胞免疫和体液免疫反应,进一步表明M5-90ΔDnaK可作为预防布鲁氏菌的候选疫苗。
综上所述,本研究显示DnaK基因缺失不影响布鲁氏菌菌落生长速度和小鼠体内的免疫反应,显著降低了其在HPT-8细胞内的复制能力,表明DnaK基因在布鲁氏菌中起着重要调控作用,为探究DnaK在布鲁氏菌中的功能和疫苗研制奠定了基础。
