应用PCR-RFLP技术检测短喙矮小综合征鹅细小病毒
2019-01-22肖世峰程晓霞江丹丹林锋强朱小丽陈仕龙陈少莺
王 劭,肖世峰,林 甦,程晓霞,俞 博,江丹丹,林锋强,朱小丽,陈仕龙,陈少莺*
(1.福建省农业科学院 畜牧兽医研究所,福建 福州 350013;2.福建省畜禽疫病防治工程技术研究中心,福建 福州 350013;3.福建农林大学 动物科学学院,福建 福州350002)
2015年以来,在中国大陆南方半番鸭与樱桃谷鸭群中暴发以生长障碍、短喙、舌头外露、易骨析为主要临床特征的鸭短喙矮小综合征(Short beak and dwarfism syndrome,SBDS)[1-2],该病最早由 Villatte报道在法国半番鸭群中流行,2009年Palya分离鉴定了一株鹅细小病毒(Goose parvovirus,GPV)变异株,命名为短喙矮小综合征鹅细小病毒(Short beak and dwarfism syndrome viruse,SBDS-GPV)[3]。SBDSGPV与德兹西氏病 GPV(Derzsy's disease virus,DD-GPV)以及番鸭细小病毒(Muscovy duck parvovirus,MDPV)均为细小病毒科依赖病毒属成员,是泛组织嗜性单链DNA病毒[3],病毒基因组中间为编码区存在两个开放阅读框,依次为Rep基因和VP基因,编码区两侧是包含有倒置末端重复序列的非编码区(UTR)。SBDS-GPV与DD-GPV分离株密切相关,全基因组核苷酸序列同源性达87%~94%,与MDPV分离株的序列同源性为83%~84%[4-7]。
GPV目前只有一个血清型,国内外已有樱桃谷鸭隐性感染SBDS-GPV造成病毒传播扩散以及北京鸭群中存在隐性感染水禽细小病毒个体的报道[6,8]。随着水禽养殖业的发展,番鸭“三周病”(MDPV感染)、德兹西氏病(俗称小鹅瘟)与短喙矮小综合征已经成为危害水禽养殖业的三大细小病毒病。目前,防控SBDS的疫苗研究尚停留在实验室阶段,因此加大对SBDS-GPV特异性的实验室诊断和分子流行病学监测,对于水禽SBDS的防控是十分重要的。
本研究根据SBDS-GPV、DD-GPV和MDPV的5'-UTR基因序列特征,建立仅需1对PCR引物并结合快速SspⅠ酶切即可对SBDS-GPV进行聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)鉴别检测,为进一步开展SBDS-GPV的流行病学调查提供新的实验室检测方法。
1 材料与方法
1.1 病毒株、病料样品及SPF鸭胚SBDS-GPV M15株、DD-GPV FJ株、MDPV P株、番鸭呼肠孤病毒(MDRV)、新型鸭呼肠孤病毒(NDRV)、鸭副黏病毒(DPMV)、禽流感病毒H9(AIV-H9)和鸭坦布苏病毒(DTMUV)的cDNA均由福建省农业科学院畜牧兽医研究所动物病毒室分离鉴定并保存;14份肝脏病料样品来自福建省福州、漳州、漳浦等地半番鸭以及樱桃谷鸭养殖场疑似SBDS病例。9日龄SPF鸭胚购自中国农业科学院哈尔滨兽医研究所实验动物中心,自行孵化。
1.2 主要试剂细胞、组织与血液DNA提取试剂盒购自德国QIAGEN公司;FastDigestSspⅠ购自美国Thermo Fisher Scientific公司;50 bp DNA Marker购自宝生物工程(大连)有限公司;Q5超保真2×Master Mix与PCR克隆试剂盒购自美国NEB公司;DNA回收纯化试剂盒E.Z.N.A.TMGel Extraction Kit购自美国Omega公司。
1.3 酶切位点的选择及引物设计根据GenBank中登录的水禽细小病毒代表株SBDS-GPV M15株(KU844283)与 DD-GPV FJ 株(KY511292)、MDPV P株(KU844282)全基因组序列,利用Webcuter 2.0软件(http://rna.lundberg.gu.se/cutter2)对其核苷酸序列中限制性内切酶图谱进行分析。结果显示,SBDSGPV在 5'-UTR基因382~387位核苷酸序列为AATATT,存在1处SspⅠ内切酶位点,而DD-GPV与MDPV在5'-UTR基因序列中不存在SspⅠ酶切位点。采用设计软件Oligo 6.0设计一对跨过SspⅠ限制性内切酶识别位点差异区的水禽细小病毒通用引物,序列分别为:SBDS-F1:5'-TCCCCTGATTGGC TGGCTCG-3'/SBDS-R1:5'-AAATCTGAAGAGGCCT AGAAAG-3',预期扩增片段大小为200 bp。
1.4 病毒核酸的提取取 200 μL SBDS-GPV(或MDPV、DD-GPV)的尿囊液,根据试剂盒操作说明书提取其DNA,-20℃保存备用。
1.5 PCR-RFLP方法的建立
1.5.1 PCR扩增及序列测定分别以SBDS-GPV M15、DD-GPV FJ与MDPV P株DNA为模板,采用25 μL 体系:Q5 High-Fidelity 2×Master Mix 12.5 μL,上、下游引物(20 μmol/L)各 0.5 μL,模板 2 μL,加灭菌双蒸水补足至 25 μL。PCR反应条件为 :98℃10 s;98℃ 10 s、53℃ 20 s、72℃ 30 s,共 30个循环,72℃ 5 min。PCR产物经3%琼脂糖凝胶电泳检测。回收纯化SBDS-GPV M15、DD-GPV FJ与MDPV P株的PCR产物,克隆至pMiniTM载体,克隆和测序由宝生物工程(大连)有限公司完成,并用DNAStar软件对测序结果进行比对分析。
1.5.2 RFLP分析利用FastDigestSspⅠ对SBDSGPV、DD-GPV与MDPV的PCR产物进行酶切,酶切产物经3%琼脂糖凝胶电泳检测。
1.5.3 特异性试验按1.5.1与1.5.2所述的SBDSGPV PCR-RFLP方法对 MDRV、NDRV、DPMV、AIV-H9、DTMUV以及正常番鸭胚成纤维细胞(MDEF)和正常番鸭胚尿囊液进行检测,以验证其特异性。
1.5.4 敏感性试验将已知含量的SBDS-GPV M15 DNA 进行 10-1~10-6倍比稀释成 50 ng/μL、5 ng/μL、500 pg/μL、 50 pg/μL、 5 pg/μL、 0.5 pg/μL, 进 行PCR-RFLP检测,观察结果,确定其最低检测量。
1.5.5 重复性试验按照已建立的SBDS-GPV PCR-RFLP反应条件,以SBDS-GPV M15分离株DNA为模板,重复3次PCR及RFLP,检测方法同1.5.1与 1.5.2。
1.6 临床样品的检测利用本研究建立的PCR-RFLP方法,对临床采集的14份疑似SBDS半番鸭、樱桃谷鸭肝脏病料样品进行检测,并对其感染的水禽细小病毒进行鉴别诊断,同时参照文献[7]方法对PCR-RFLP鉴定为SBDS-GPV阳性的肝脏样品进行病毒分离。
2 结果
2.1 病毒PC R产物的鉴定分别将SBDS-GPV M15、DD-GPV FJ与MDPV P分离株的PCR产物克隆至pMiniTM载体中。测序显示,扩增片段序列与SBDS-GPV M15、DD-GPV FJ与 MDPV P 5'UTR相应核苷酸序列100%相符,表明SBDS-F1/R1引物组扩增出的病毒PCR片段特异性良好。
2.2 SBDS-GPV M15、DD-GPV FJ和 MDPV P分离株的PCR-RFLP结果利用设计的特异性引物SBDS-F1/SBDS-R1对 SBDS-GPV M15、DD-GPV FJ和MDPV P PCR扩增后,得到的目的条带大小均为200 bp,与预期结果相符。经 FastDigestSspⅠ酶切后显示,SBDS-GPV M15 PCR产物被切为两段,大小为 140 bp和60 bp;而DD-GPV FJ和 MDPV P PCR产物不能被SspⅠ酶切(图 1)。PCR-RFLP分析结果表明水禽细小病毒基因组5'-UTR基因序列中SspⅠ酶切位点的差异可以做为鉴定SBDS-GPV的标志,在基因水平上能够将SBDS-GPV与DD-GPV、MDPV区分。

图1 SBDS-GPV、DD-GPV和MDPV 5'-UTR基因的PCR-RFLP分析Fig.1 Analysis of 5'-UTR genes of SBDS-GPV,DD-GPV and MDPV by PCR-RFLP
2.3 特异性试验结果对SBDS-GPV、MDRV、NDRV、DPMV、AIV-H9、DTMUV各病毒cDNA进行PCR-RFLP扩增及酶切,结果仅SBDS-GPV PCR扩增产物酶切出140 bp和60 bp的目的条带,其余病毒PCR扩增产物均无条带出现(图2)。表明该方法特异性良好。
2.4 敏感性试验结果采用建立的SBDS-GPV PCR-RFLP方法进行检测,结果显示,10-5倍稀释的SBDS-GPV核酸PCR扩增产物仍能出现两条酶切片段,且最低检测 DNA浓度为 2.28×107拷贝 /μL(图3)。表明该方法敏感性高。
2.5 重复性试验 SBDS-GPV PCR-RFLP重复3次,结果PCR产物在140 bp和60 bp处,均得到了清晰可见的目的条带。表明该方法的重复性好。

图2 SBDS-GPV PCR-RFLP的特异性分析Fig.2 The specific tests of the SBDS-GPV PCR-RFLP
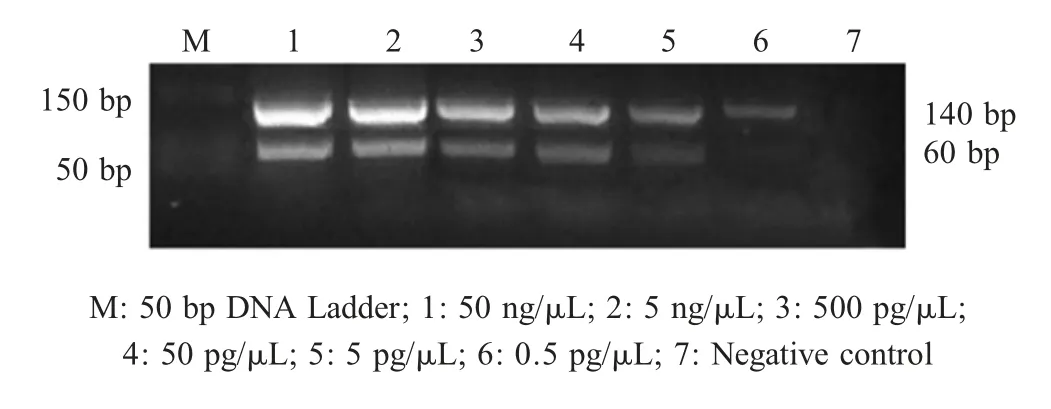
图3 SBDS-GPV PCR-RFLP敏感性分析Fig.3 The sensitivity test of the PCR-RFLP detection for SBDS-GPV
2.6 临床样本检测采用建立的PCR-RFLP方法对14例疑似SBDS的樱桃谷鸭、半番鸭肝脏样品进行了检测。经PCR-RFLP分析后发现,8份半番鸭病料(样品号 6、7、8、10、11、12、13 和 14)和 4 份樱桃谷北京鸭病料样品(样品15、17、18和19)确诊为 SBDS-GPV感染(图 4)。对 12份 PCR-RFLP检测为阳性的肝脏病料样品进行病毒分离,分离病毒在传至4代后能够引起SPF鸭胚死亡,死亡SPF鸭胚尿囊液经PCR-RFLP检测显示所含病毒均为SBDSGPV(图 5)。表明在临床调查分析疑似水禽细小病毒感染病例过程中,本研究建立的PCR-RFLP方法能够保证SBDS-GPV检测的准确性。

图4 部分临床样品的PCR-RFLP分析结果Fig.4 Analysis of clinical samples by the PCR-RFLP

图5 12份SBDS-GPV阳性病毒的PCR-RFLP分析结果Fig.5 Analysis of 12 SBDS-GPV isolates by the PCR-RFLP
3 讨论
SBDS在中国大陆暴发并流行以来,一直受到水禽养殖业者与科研人员的高度关注,在兽医临床中急需开展针对该病流行病学调查的技术规程。虽然目前国内外已经有多种关于GPV分子生物学检测方法的报道,如PCR、荧光定量PCR、PCR-LAMP等[9-10],但由于水禽细小病毒不同分离株基因组编码区核苷酸序列同源性高,PCR引物特异性不强,容易产生假阳性结果;因此鉴别SBDS-GPV基因特征的方法还是主要依据病毒结构蛋白基因的核苷酸序列测定分析,然而在基层日常检测工作中,针对大量临床感染样本的进行测序存在成本高、操作繁琐、耗时长等缺点,不适用于疫病的快速鉴别诊断。
RFLP是指由限制性酶切位点间的插入、缺失、重排或点突变所引起的基因型间限制性片段长度的变异。本研究在分析水禽细小病毒基因组序列的基础上,利用SBDS-GPV与DD-GPV、MDPV在5'-UTR基因SspⅠ酶切位点的差异,将PCR技术与RFLP技术组合起来,建立了可快速鉴别SBDS-GPV的PCR-RFLP方法,PCR产物预期片段为200 bp,SBDS-GPV的PCR产物能被SspⅠ酶切为140 bp和60 bp两个片段,而DD-GPV与MDPV的PCR产物不能被SspⅠ酶切;通过对14份疑似SBDS病料样品检测对建立的PCR-RFLP方法进行应用评价,结果显示该PCR-RFLP方法能够准确检测SBDS-GPV。本研究建立的SBDS-GPV PCR-RFLP方法不但有效避免了假阳性,而且检测出的最低SBDS-GPV DNA浓度为5 pg/μL,具有较高的特异性和敏感性。有利于基层实验室通过检测疑似SBDS水禽组织病料来评估SBDS-GPV感染状况,并及时掌握自然条件下水禽感染SBDS-GPV的分布情况,可以作为SBDS净化的实验室检测标准,也为开展GPV流行病学调查中研究SBDS-GPV传播途径提供了新的研究手段。
