戊型肝炎病毒一步法多重荧光定量PCR分型鉴定技术的建立及应用
2019-01-22李爱云帅江冰曾若雪鱼海琼朱道中朱宇宁张晓峰李肖梁
李爱云,帅江冰,曾若雪,孙 涛,鱼海琼,朱道中,朱宇宁,张晓峰,李肖梁
(1.浙江大学 医学院附属妇产科医院,浙江 杭州310006;2.浙江省检验检疫科学技术研究院,浙江 杭州 310016;3.山东出入境检验检疫局 检验检疫技术中心,山东 青岛 266500;4.广东出入境检验检疫局 检验检疫技术中心,广东 广州 510623;5.浙江大学 动物预防医学研究所,浙江 杭州310058)
戊型肝炎(Hepatitis E,HE)是一种经粪-口传播的急性传染病,由戊型肝炎病毒(HEV)引起[1],HEV广泛分布于多种畜禽体内,可通过水源、饮食等途径在动物和人之间传播[2],其也被认为是人畜共患性疾病[3-4]。种系进化研究显示不同地区来源的HEV基因组序列存在一定的差异,可被划分为4个主要的基因型[5],其中基因1型和2型仅分离于人类,大规模戊型肝炎暴发流行均为该类HEV引起,基因3型和4型见于小规模流行和临床散发,能够感染多种哺乳动物[6-7],该类HEV的主要天然宿主为猪。我国流行的 HEV主要为1型和4型[8]。近年来,在我国上海、浙江等地区的猪群中陆续发现了HEV3 感染[9]。
由于目前尚未发现适合HEV体外分离培养的细胞株,而且HEV感染血清学检测的窗口期较短,荧光定量PCR技术成为目前诊断人群或动物中HEV感染的首选方法[10]。但常规荧光定量PCR方法不能区分病原的基因型,需通过后期的PCR扩增加测序确定感染病原的基因型,费时费力。本研究基于HEV1、HEV3和HEV4的基因组的型特异性,设计一对保守扩增引物和3条型特异性探针,建立一步法多重荧光定量PCR方法用以鉴别检测不同型HEV感染,并以EGFP基因为内部质控,确保从核酸提取到PCR扩增整个过程的准确和有效。
1 材料与方法
1.1 临床样品及主要试剂32份人血清样本由浙江大学医学院附属妇产科医院和杭州市第六人民医院提供,均为HEV抗体弱阳性或可疑阳性样品,-20℃保存备用。89份猪粪便和54份猪血清样品采集自浙江、上海、江苏和安徽等地区的28个规模化猪场。即于不同猪舍中取1 g~2 g粪便样品,加入0.02 mol/L PBS,彻底混匀制成 20%的悬液(w/v),10 000 r/min离心20 min,吸取上清,-80℃保存备用。2×AgPath-IDTMOne-step RT-PCR Kit购自美国Applied Biosystems公司;DNA纯化试剂盒Wizard-PlusMinipreps DNA Purification System(Cat#A7100)、胶回收试剂盒Wizard PCR PrepsDNA Purification System(Cat#A7170)和体外转录试剂盒RiboprobeRSystem-SP6/T7均购自Promega公司;QIAamp Viral RNA mini Kit购自Qiagen公司。甲型肝炎病毒、乙型肝炎病毒和疱疹病毒核酸样品由浙江大学医学院附属妇产科医院保存。猪瘟病毒、猪流行性腹泻病毒株由浙江省检验检疫科学技术研究院保存。
1.2 引物、探针和目的基因合成参照并分析GenBank中 HEV1株(D11092)、HEV3株(AB074918)和HEV4株(AJ272108)基因组序列,针对HEV ORF3基因序列设计一对保守引物(表1),同时设计3条特异性针对不同基因型ORF3基因序列的探针,分别标记荧光基团ROX、CY5和FAM。EGFP质控引物和探针序列参考Hoffmann等[11]设计合成。参照HEV1株(D11092)、HEV3株(AB074918)和 HEV4株(AJ272108)序列,合成针对以上扩增引物的目的基因片段,用于标准质粒的构建。
1.3 HEV阳性标准RNA和EGFP质控RNA体外合成分别将 HEV1、HEV3、HEV4和 EGFP目的片段克隆入pGEM-T easy载体构建标准质粒pGTHEV-1-ROX、pGT-HEV-3-CY5和 pGT-HEV-4-FAM以及pGT-GFP-HEX,利用试剂盒提取质粒。将重组质粒用限制性内切酶PvuⅡ消化处理后制备末端为平端的DNA片段,纯化回收后进行体外转录。转录产物经无RNase的Dnase I(1 U/μg)消化除去其中的DNA模板后,按RNeasy Plus mini Kit说明书对RNA进行纯化。合成的HEV阳性RNA目的片段和EGFP质控RNA测定浓度,经换算后分别为6.5×1011拷贝 /μL、5.3×1012拷贝 /μL、7.9×1010拷贝 /μL和 1.3×1011拷贝 /μL,保存于 -70℃备用。

表1 HEV扩增引物、型特异性探针及EGFP质控引物、探针序列Table 1 The primer and probe sequences used in the study
1.4 多重荧光定量PCR反应条件的优化按照AgPath-IDTMOne-step RT-PCR试剂盒说明书,以合成的HEV阳性RNA为模板,采用方阵法对多重反应体系中各引物浓度(50 nmol/L~200 nmol/L)、探针浓度(5 nmol/L~500 nmol/L)及退火温度等主要参数进行优化分析,建立荧光定量PCR检测方法。荧光定量PCR反应过程中选取多通道扫描模式,反应结束后分别选择ROX、CY5和FAM通道进行结果分析,通过各S型扩增曲线来确定待测样品中HEV的基因型。
1.5 特异性试验分别以提取的甲型肝炎病毒、乙型肝炎病毒、疱疹病毒、猪瘟病毒、流行性腹泻病毒等基因组核酸和不同型HEV阳性RNA为模板,利用已优化的多重荧光定量PCR条件进行扩增,并设立无模板的阴性对照,验证该方法的特异性。
1.6 敏感性试验将不同型HEV标准阳性RNA 10倍倍比稀释至 1.5×106拷贝 /μL~1.5×101拷贝 /μL后作为模板,按照建立的多重荧光定量PCR进行检测,每个稀释度10个重复,分析该方法的敏感性。不同型HEV的最低检测限(LOD)定义为10个重复均能检出的最低拷贝数。
同时,将不同型HEV阳性RNA 10倍倍比稀释后两两混合,按棋盘滴定方法进行检测,用以分析多重荧光定量PCR体系在不同RNA模板存在的情况下对另一型HEV RNA的最低检测限的影响。试验分析中加入 EGFP RNA(2×104拷贝 /反应管)作为质控。
1.7 重复性和稳定性试验将不同基因型HEV标准阳性RNA分别进行4次检测,每次试验时将阳性标准 RNA 倍比稀释至 1.5×106~1.5×101拷贝 /μL,每个稀释度设置4个重复,计算不同型HEV各稀释度平均Ct值及4次独立试验的标准差,以评估该方法的重复性。
1.8 临床样品检测按照试剂盒说明提取人血清样本、猪血清样本和处理的猪粪便样品中RNA,以其为模板,利用建立的多重荧光定量PCR方法检测。同时利用套式PCR方法[3]检测上述样品,对二者实验结果进行对比分析。
1.9 统计学分析采用R-software计算重复性和稳定性试验的平均Ct值和标准差(SD)等对结果进行统计学分析。
2 结果
2.1 多重荧光定量PCR反应条件优化结果对反应体系各参数进行优化试验,结果显示HEV扩增引物浓度(HEV-uni-F/HEV-uni-R)为 800 nmol/L、特异性探针HEV-1-ROX、HEV-3-CY5和 HEV-4-FAM浓度分别为200 nmol/L以及退火温度为60℃时,多重荧光定量 PCR体系对 HEV1、HEV3和 HEV4均有很高的扩增效率,且不同型HEV的扩增效率基本一致(图1)。同时,在保证质控反应效率的基础上,确定多重荧光定量PCR体系中EGFP扩增引物和探针浓度为200 nmol/L和100 nmol/L,从而尽量减少了EGFP质控反应体系对HEV RT-PCR的影响。
2.2 特异性试验结果采用建立的多重荧光定量PCR方法对甲型肝炎病毒、乙型肝炎病毒、疱疹病毒、猪瘟病毒、流行性腹泻病等核酸及HEV阳性RNA进行检测。结果显示,ROX通道仅HEV1出现扩增曲线,其余病原及阴性对照均无扩增(图2),此外,CY5和FAM通道也分别仅有HEV3和HEV4阳性RNA出现扩增曲线(图略),表明所建立的方法具有良好的特异性。
2.3 敏感性试验结果由于多重荧光定量PCR体系不能从所有的10个重复反应管中检出5个拷贝的阳性HEV RNA,因此多重体系对HEV 1、HEV3和HEV 4的最低检测限(LOD)均为50个拷贝/反应(图3、表2),且多重体系对不同型HEV的检测灵敏度不受体系中EGFP质控反应的影响。
为进一步分析不同型HEV扩增反应间的互相干扰,将HEV阳性RNA倍比稀释后两两混合,按棋盘滴定方法进行组合反应。结果显示,在多重荧光定量PCR反应体系中,不同浓度HEV RNA不干扰另一基因型HEV基因组的高效扩增,其检测限也未受影响(部分结果见图4)。
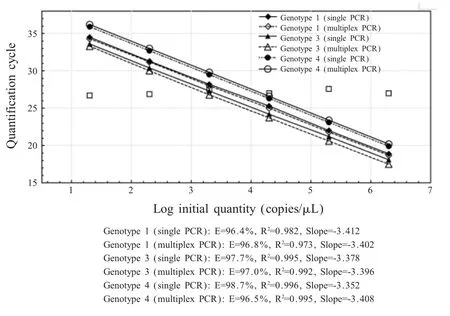
图1 多重荧光定量PCR方法对不同型HEV RNA扩增的标准曲线及扩增效率Fig.1 Standard curves for the real time PCR based on 10-fold dilution series of positive HEV RNA

图2 多重荧光定量PCR检测方法特异性分析(ROX通道)Fig.2 The specificitytest of the multiplex qPCR(ROX)
2.4 重复性和稳定性试验结果对倍比稀释的不同型HEV阳性标准RNA按多重荧光定量PCR分别进行10个重复检测,不同拷贝数 HEV1、HEV3和HEV4反应的Ct值标准差分别在 0.69~1.22、0.33~0.72和 0.46~0.81,变异系数均低于 4%(表 3)。此外,通过标准曲线计算得出的不同拷贝数HEV的重复管间实际检测基因组拷贝数无显著性差异(表3),表明多重荧光定量PCR具有很高的重复性。
多重荧光定量PCR方法的稳定性试验分析结果显示,该方法对HEV1、HEV3和HEV4具有良好的检测稳定性,其不同批次间检测Ct值标准差分别仅为 0.32~1.56、0.21~0.93 和 0.45~0.73(图 5)。表明该方法稳定性良好。

图3 多重荧光定量PCR检测敏感性分析(FAM通道)Fig.3 The sensitivity of the multiplex qPCR(FAM)
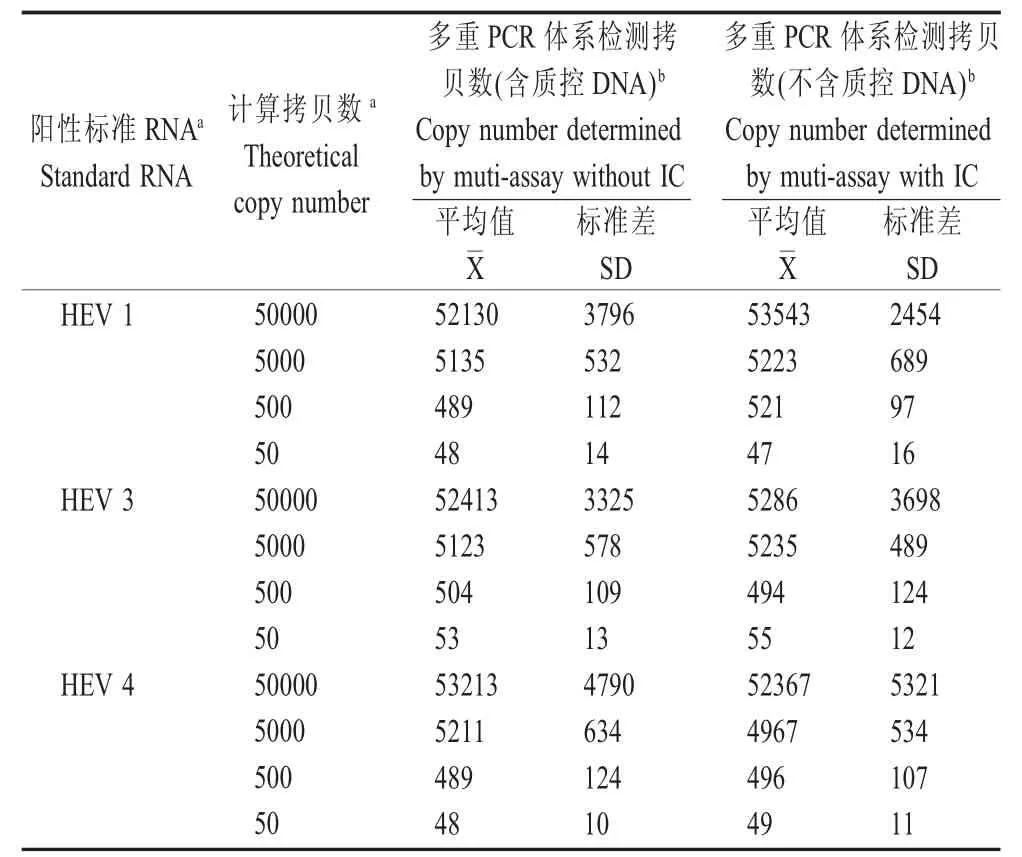
表2 不同型HEV的最低检测限Table 2 The sensitivity and reproducibility of the multiplex qRT-PCR
2.5 临床样品检测结果分别利用HEV多重荧光定量PCR和套式PCR[3]对采集的临床样品进行检测,结果显示HEV多重荧光定量PCR体系从猪粪便样品中检出阳性样品13份,其中10份为HEV4、3份为HEV3;猪血清和人血清中则分别检出3份和1份HEV4阳性,检测结果与套式PCR结果一致(表4),表明多重荧光定量PCR体系对于临床样品的检测具有很高的准确性。
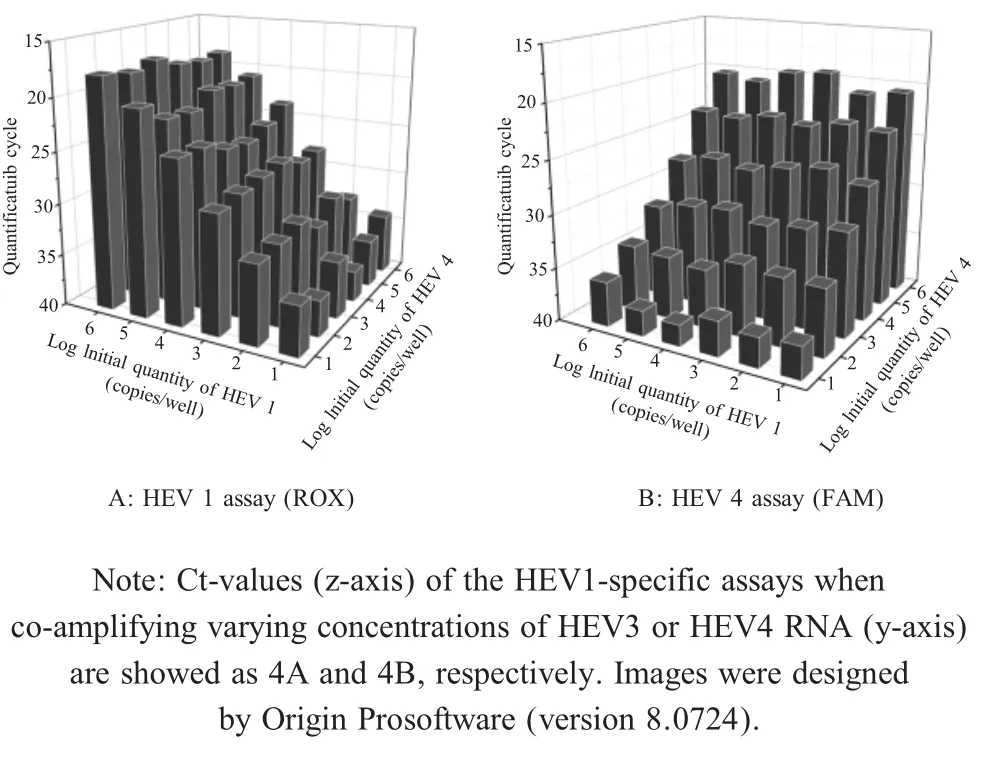
图4 多重荧光定量PCR体系中不同型HEV扩增效率和检测限受异源基因组的干扰性分析Fig.4 Checkerboard titration of HEV1,HEV3 and HEV4 assay

表3 重复性试验结果Table 3 Reproducibility of the multiplex RT-qPCR
3 讨论
HEV宿主范围广,动物自然宿主与人类HEV感染有密切关系,猪则是重要的HEV动物宿主。猪HEV不仅在形态、结构上与人HEV相似,而且基因结构也相似,序列同源性可在90%以上[12]。猪HEV在遗传进化上并不构成独立分支,而是与同一地区的人源HEV株共属同一分支[13]。已有报道证实HEV可能在自然状态下或通过食物等在动物和人之间传播[14-15]。因此,HEV在公共卫生和食品安全方面具有重要意义。
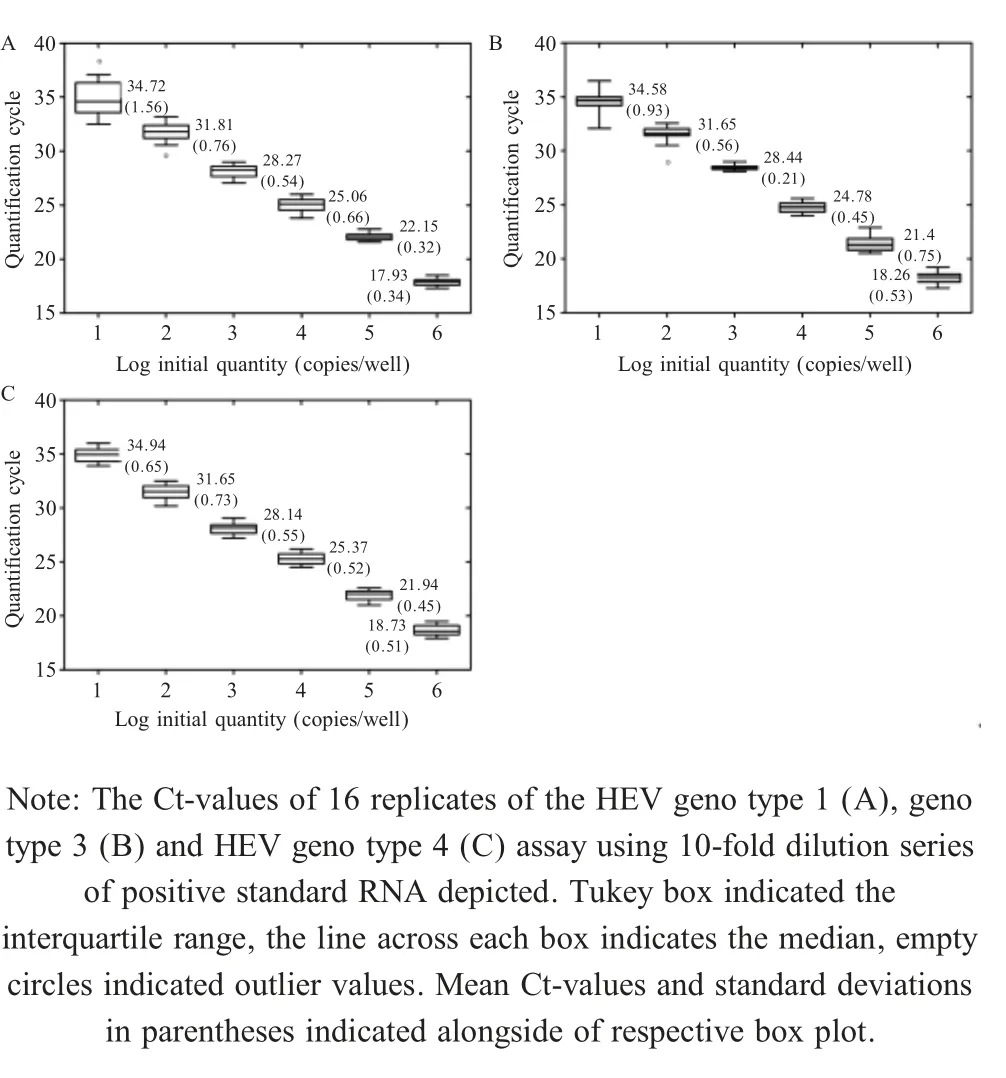
图5 多重荧光定量PCR稳定性试验结果Fig.5 Repeatability test of the multiplex assay

表4 临床样品检测结果Table 4 Detection of swine feces and sera samples with the multiplex real-time PCR and single real-time PCR
目前已有RT-PCR和荧光定量RT-PCR方法用于HEV感染检测的报道,但能达到同时检测并能鉴别不同型HEV感染的方法还未见报道[10]。研究显示,在同一区域、同一群体甚至同一个体中均可能存在不同基因型HEV的共感染,并可通过基因重组等方式产生新的HEV,目前的血清学诊断技术难以对不同基因型感染进行鉴别[16]。本研究中的HEV通用引物为HEV基因组保守序列,能与HEV1、HEV3和HEV4 3种基因型ORF3基因序列结合而扩增,3条型特异性探针则分别针对HEV1、HEV3和HEV4 ORF3基因序列中的特异性区域设计,从而达到有效鉴别不同HEV基因型的目的。通过对引物、探针浓度退火和温度等的优化,建立了一步法HEV多重荧光PCR鉴别体系,其最低检测限与传统套式RT-PCR方法[5]相当,但传统套式RT-PCR方法包含反转录、第一轮PCR和第二轮PCR三步,耗时至少需3 h,出现阳性扩增后还需更长时间的测序来确定基因型,且在反转录以及两轮PCR加样过程中极易造成交叉污染。而本研究的一步法多重RT-PCR方法实现快速闭管且能分型鉴定,耗时极大缩短,且具有更高的准确性和稳定性。同时,引入EGFP基因质控,可有效对核酸提取、反转录过程等影响多重荧光定量PCR体系检测质量和效率等的因素进行监控,从而保证鉴定结果的准确有效。对临床样本的检测结果表明了该多重荧光定量PCR方法可以用于临床HEV隐性感染或早期感染的快速诊断,为该病的有效防制提供方法。
