miR-29b介导的TGF-β/Smad信号通路对大鼠肝纤维化进程的影响*
2019-01-21朱庆曦
谭 洁, 田 霞, 韩 峥, 朱庆曦, 刘 蒙
(武汉大学同仁医院, 武汉市第三医院, 湖北 武汉 430060)
肝星状细胞(hepatic stellate cells,HSC)是存在于肝脏窦周狄氏间隙中的维生素A存储细胞。HSC和转化生长因子β(transforming growth factor-β,TGF-β)在肝纤维化发病过程中扮演重要的角色[1]。多种因素引起的肝损伤都可能激活HSC,而活化的HSC可释放多种促进纤维化进程的细胞因子,进而转变为肌成纤维细胞(myofibroblast,MFB)[2-5]。研究表明, TGF-β对肝纤维化的调控主要是通过TGF-β/Smad信号通路实现,活化的TGF-β可激活TGF-β/Smad信号通路,进而促进HSC合成胶原和纤维连接蛋白等细胞外基质(extracellular matrix,ECM),从而加速肝纤维化的发生。
微小RNA-29(microRNA-29,miR-29)是新近发现的一个与纤维化疾病密切相关的小分子RNA[6]。研究表明 miR-29b在肝纤维化小鼠和进展性肝纤维化患者肝脏组织中的表达明显下降[7-10],且可抑制多种胶原蛋白的表达[11],这提示miR-29b在肝纤维化的进程中发挥了重要作用,且很可能具有强大的抗纤维化潜能。此外miR-29还可通过抑制TGF-β/smad信号通路介导上皮-间充质转化(epithelial-mesenchymal transition,EMT)和致纤维化过程,在多种器官纤维化中起着重要的作用。
本研究通过检测活化的HSC及肝纤维化动物模型获取的HSC中miR-29b、TGF-β/Smad信号通路相关蛋白和肝纤维化标志蛋白的水平变化,研究它们与HSC活化程度和肝纤维化的关联性,后通过进一步鉴定miR-29b对TGF-β1的直接靶向结合,探讨肝纤维化过程中miR-29b对TGF-β/Smad信号通路的调控作用,为进一步研究抗肝纤维化提供新的思路。
材 料 和 方 法
1 实验动物和主要试剂
14~16月龄雄性Wistar 大鼠12只,体重400~600 g,购自湖北省医学动物实验中心,合格证编号为No.42000600016665。TRIzol RT RNA(MRC);Eastep RT Master Mix Kit(Promega);SYBR Premix Ex Taq(TaKaRa),引物由TaKaRa公司设计;天狼星红试剂盒(Bioswamp);抗I型胶原(collagen type I,Col I)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、TGF-β1、Smad2、Smad3、Smad4和Smad7抗体(Abcam);抗β-actin抗体(CST);羊抗兔 II 抗(Genetex)。
2 实验仪器
电泳仪及显影仪(Bio-Rad);酶标仪(Thermo);脱水机、包埋机、切片机和摊片烤片机(Leica);正置显微镜(Nikon);荧光定量PCR仪(ABI 7500);全自动生化分析仪(PUZS-300X)。
3 方法
3.1猪血清诱导免疫性大鼠肝纤维化模型的制备及鉴定 无菌条件下制备猪血清,连续8周腹腔注射(每次0.5 mL,每周2次)免疫雄性Wistar大鼠以制备大鼠免疫性肝纤维化模型[12]。8周后处死大鼠,分离大鼠肝脏HSC,进行体外培养,并使用全自动生化分析仪将获取的大鼠血清进行肝纤维化相关指标检测。
3.2HE染色及天狼星红染色观察胶原纤维 取肝纤维化模型大鼠肝脏用4%甲醛固定,按照组织制片的常规程序进行脱水和包埋,以4 μm厚度进行连续切片,将切片用二甲苯脱蜡,以不同浓度的乙醇进行梯度脱水,然后伊红染色(福州迈新生物技术开发有限公司),苏木素(福州迈新生物技术开发有限公司)复染,梯度脱水,二甲苯通透,中性树脂胶封片,显微镜下观察。同时取脱蜡后的组织切片用天狼星红饱和苦味酸液染色15~30 min,苏木素复染,梯度脱水,二甲苯通透,中性树脂胶封片,显微镜下观察。
3.3HSC的分离培养及实验分组 取雄性Wistar 大鼠,分离门静脉并插管,采用酶消化-密度梯度离心法分离HSC(依次灌注链酶蛋白酶-胶原酶,37 ℃原位消化,12% Nycodenz密度梯度离心获得HSC),并命名为初始HSC。所得HSC在含10%胎牛血清的DMEM 中培养,隔天更换培养液[13],体外培养2 d的作为静息状态HSC。取静息状态HSC与初始HSC进行鉴定,鉴定成功的继续培养7 d作为半活化状态HSC,培养14 d作为完全活化状态HSC,并取构建成功的纤维化大鼠模型体外培养的HSC作为纤维化模型细胞,将细胞分为初始HSC(HSC-1)、静息状态HSC(HSC-2)、半活化状态HSC(HSC-3)、完全活化状态HSC(HSC-4)和纤维化模型HSC(HSC-5),共5组。
3.4RT-qPCR检测miR-29b及mRNA的表达 提取细胞总RNA(TRIzol法),并按照逆转录试剂盒说明书使用一步法进行逆转录合成cDNA,然后按照RT-qPCR Master Mix试剂盒说明书进行PCR操作。检测mRNA的反应体系为:SYBR Premix Ex Taq II(2×) 10 μL;cDNA template 2 μL;引物10 μmol/L (F/R) 0.3 μL;RNase-free water 7.4 μL。检测miRNA的反应体系为: 5×MMLV RT buffer 4 μL; dNTP (10 mmol/L) 0.75 μL;miRNA/U6 snRNA RT Primer Mix(1 μmol/L)1.2 μL;RNasin (40 U/μL)0.5 μL;MMLV reverse transcriptase (200 U/μL) 0.2 μL;miRNA template 3 μg;RNase-free water 加至20 μL。按照2步法PCR标准程序扩增,扩增后RNA相对表达量计算公式为2-ΔΔCt。引物序列见表1。

表1 RT-qPCR的相关引物序列
F: forward; R: reverse.
3.5Western blot检测蛋白表达水平 提取各组细胞的总蛋白,用BCA蛋白浓度测定试剂盒(康为世纪公司)测定样品蛋白含量并稀释定量样品,加上样缓冲液煮沸变性后,配制10% Bio-Rad蛋白胶,以20 μg总蛋白量上样,电泳后将凝胶上的蛋白转移到PVDF膜上。用5%脱脂奶粉室温封闭2 h,洗膜,分别加 I 抗,4℃孵育过夜,TBST洗膜,加 II 抗,室温孵育1 h,TBST洗3次,采用ECL化学发光法显色,并使用Bio-Rad公司的ChemiDoc Touch系统采集图像及数据分析。
3.6双萤光素酶报告基因检测 依据GenBank中TGF-β1基因的序列,选取包含与miR-29b匹配的一段序列设计引物,然后进行PCR扩增,对扩增产物和载体pmirGLO进行双酶切,酶切后进行连接,连接产物转化后挑选阳性克隆进行验证。转染前 1 d将293T细胞接种于24孔板,质粒转染严格按照LipofectamineTM2000说明书进行,转染24 h后,PBS洗涤细胞,按照Dual-Luciferase Reporter Assay System说明书向每个孔中加入100 μL PLB,室温摇动20 min后加入20 μL LAR-II试剂,放入GloMax@96 Microplate Luminomter(Promega)分别读取萤火虫萤光素酶和海肾萤光素酶催化底物后的发光强度。
4 统计学处理
数据采用SPSS 16.0统计软件进行统计分析,所有数据均以均数±标准差(mean±SD)表示。两组间均数比较用t检验,多组间均数比较采用多因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 纤维化HSC的鉴定
对获取的HSC进行RT-qPCR及Western blot检测发现,静息状态HSC(HSC组)中肝纤维化标志蛋白Col I和α-SMA的mRNA表达水平是初始HSC(control 组)的4倍(P<0.01),同时蛋白表达水平在HSC组是control组的2倍(P<0.01),见图1。肝纤维化标志物Col I和α-SMA在mRNA及蛋白水平的表达均增加,初步判断纤维化HSC获取成功。
2 肝纤维化模型大鼠的鉴定
肝纤维化模型大鼠血清肝纤维化指标 III型前胶原(procollagen type III,PC Ⅲ)、 IV型胶原(collagen type IV,Col IV)、层粘连蛋白(laminin,LN)及透明质酸酶(hyaluromic acid,HA)均高于正常大鼠 (P<0.01),见表2。对2组大鼠肝脏石蜡切片进行HE染色和天狼星红染色观察发现,正常大鼠肝小叶结构正常,肝细胞排列规则,肝窦与汇管区成纤维细胞少;而纤维化模型组大鼠肝小叶结构紊乱,肝细胞体积增大,有大量炎性细胞浸润,部分肝细胞坏死,纤维组织增生明显,见图2。病理及血清肝纤维化指标表明,肝纤维化模型大鼠病情发展较为严重,大鼠纤维化模型构建成功。
3 不同活化状态的HSC及肝纤维化HSC中相关蛋白及miR-29b表达的检测
对不同活化状态下的HSC及肝纤维化HSC进行RT-qPCR检测发现,随着HSC活化程度的增加,直至转化为肝纤维化HSC的过程中,miR-29b的表达水平逐渐降低(P<0.05);同时与肝纤维化过程密切相关的TGF-β1、Col I、Smad2、Smad3、Smad4和α-SMA的mRNA水平随着纤维化程度的加深逐渐增加,而对纤维化有抑制作用的Smad7的mRNA含量明显减少(P<0.05),见图3。进一步通过Western blot检测发现,TGF-β1、Col I、Smad2、Smad3、Smad4和α-SMA的蛋白表达量同样随着HSC细胞的活化程度逐渐增加,而Smad7蛋白的含量逐渐减少(P<0.05),见图4。
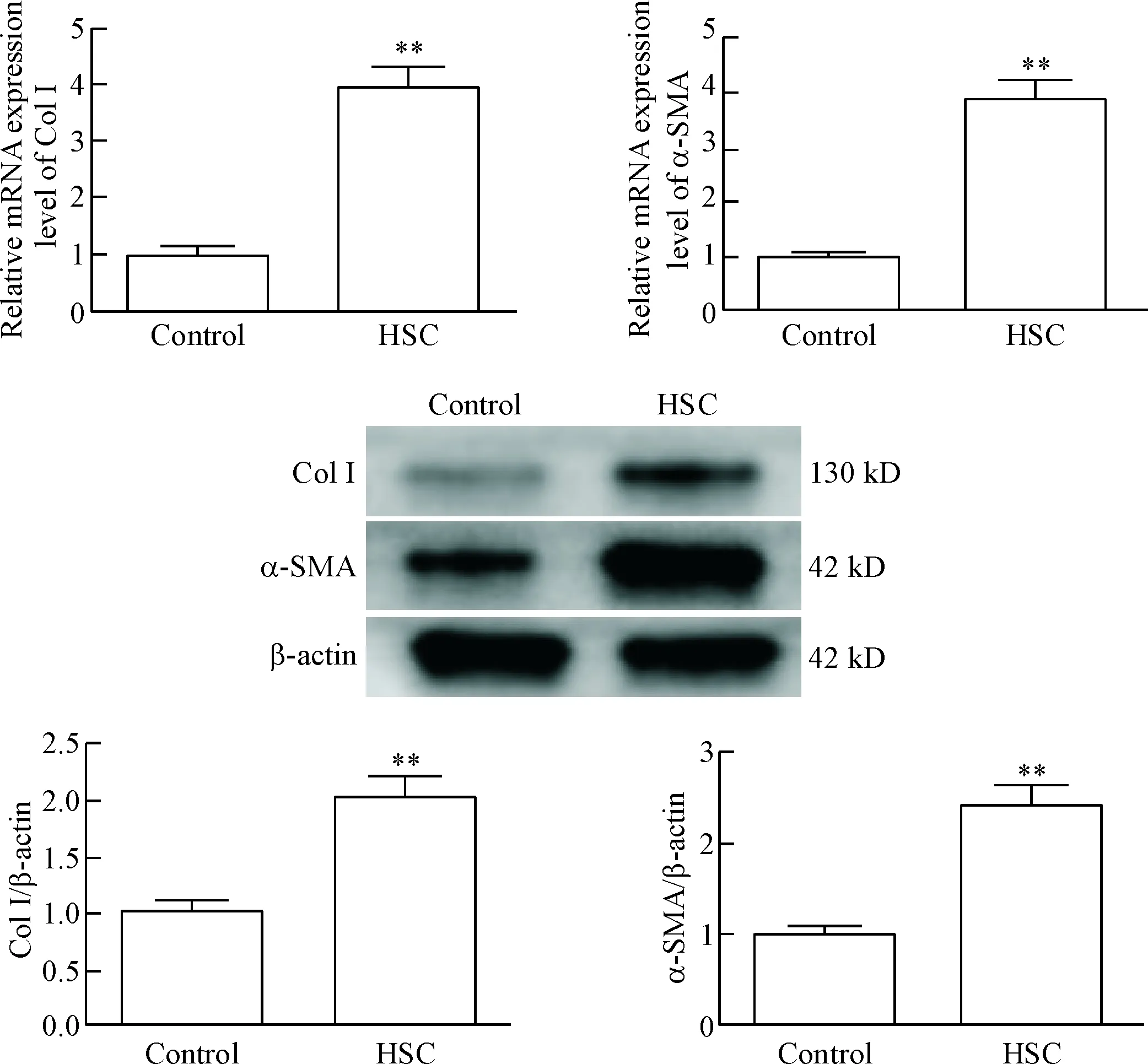
Figure 1. The mRNA and protein expression of fibrosis-related genes in hepatic fibrosis rat HSC culturedinvitro. Mean±SD.n=3.**P<0.01vscontrol group.
图1体外获取的纤维化HSC相关mRNA及蛋白表达水平的变化

表2 大鼠血清纤维化指标的比较
**P<0.01vsnormal group.

Figure 2. The pathological observation of the rat liver with HE and Sirius red staining (×200).
图2HE及天狼星红染色大鼠肝脏病理切片的观察

Figure 3.The expression of miR-296 and the mRNA expression of fibrosis-related genes in liver fibrosis process. Mean±SD.n=3.*P<0.05,**P<0.01vsHSC-1 group.
图3纤维化过程中miR-296及与纤维化密切相关的mRNA表达水平的变化

Figure 4.The protein expression of fibrosis-related genes in liver fibrosis process. Mean±SD.n=3.*P<0.05,**P<0.01vsHSC-1 group.
图4纤维化过程中与纤维化密切相关的蛋白表达水平的变化
4 双荧光素酶靶点预测
运用TaragetScan预测发现TGF-β1为miR-29b的下游靶基因之一,miR-29b与TGF-β1 mRNA的3’-UTR互补序列见图5A。双萤光素酶报告系统验证结果显示,在野生型(WT)组中miR-29b mimic与TGF-β1结合后的荧光强度明显低于对照(NC)组,差异具有统计学意义(P<0.01);而在Mut组中miR-29b组与NC组间的差异并没有统计学显著性,见图 5B。以上结果证实miR-29b可直接靶向于TGF-β1的3’-UTR。
讨 论
肝纤维化是各种慢性肝病发展的中心环节[14],近年来的研究发现HSC持续活化所导致的细胞外基质过度沉积是肝纤维发生、发展的关键因素。正常状况下,HSC处于静止状态,当肝脏受到外界刺激时HSC会被激活并持续增殖,导致细胞外基质合成与降解失衡,最终形成肝纤维化[15]。
TGF-β在肝纤维化的发生过程中具有重要的作用,其作为一种关键的促纤维化因子,可增强ECM的表达,而I型胶原蛋白和α-平滑肌动蛋白等是构成ECM的重要组成部分,通常作为肝星状细胞活化的标记物[16-17]。Smad4作为TGF-β/Smad信号通路的重要的下游分子,TGF-β受体二聚化后会激活Smad2/Smad3,进而使其形成复合物,随后Smad2/Smad3复合物与Smad4结合并进入细胞核,最后与特异的DNA连接蛋白结合,从而促进TGF-β的表达[18-19]形成稳定的异源多聚体,转入核內与各种转录因子相结合,进而启动纤维化相关基因的表达[20];而Smad7能通过与活化的TGF-β1结合从而抑制该信号通路的激活[21],进而抑制纤维化的进程。

Figure 5. Direct targeted binding of miR-29b to TGF-β1. A: prediction of the binding sites; B: relative luciferase activity. Mean±SD.n=3.**P<0.01vsNC group.
图5miR-29b与TGF-β1的直接靶向结合
本研究通过体外获取HSC及肝纤维化HSC,检测不同活化程度的HSC及肝纤维化HSC的miR-29b及相关蛋白的表达。结果表明,随着HSC活化程度的加深,miR-29b的表达量逐渐减少。且在HSC活化直至纤维化进程中,TGF-β/Smad信号通路中Smad2/3/4的表达逐渐增加,而Smad7的表达则随之下降。后通过双萤光素酶系统对miR-29b的靶位点进行初步验证,可发现TGF-β1为miR-29b的直接下游靶点。由此可判断miR-29b可能通过抑制TGF-β1进而调控TGF-β/Smad信号通路,最终抑制HSC的增殖和活化引起的肝纤维化。
综上所述,本研究证实在肝纤维化发展过程中,miR-29b随着HSC的活化逐渐降低,且其可能是通过调控TGF-β/Smad信号通路发挥其作用的。这初步揭示了miR-29b及TGF-β/Smad信号通路在肝纤维化发展中的作用,并为肝硬化的治疗提供了新的治疗靶点。
