原发性高血压患者血清脂蛋白a和胱抑素C及与高血压分级的相关性
2019-01-19侯义福陈莹莹
侯义福,陈莹莹
(六安市中医院检验科,安徽六安 237000)
原发性高血压为一种以血压升高为主要特征的慢性病、多发病。相关统计资料显示,我国有2.9~3.0亿高血压患者,多数患者具遗传背景[1-3]。临床研究表明,原发性高血压为心、脑血管疾病最主要的危险因子,近71%的脑卒中及54%的心肌梗死均与原发性高血压有关[4]。长期的高血压可促进动脉粥样硬化的形成和进展,并引发心、脑、肾等器官一系列严重并发症。高血压可防可控,关键在于早期诊断、对症治疗,并积极控制危险因素,减缓靶器官的损害,预防心、脑、肾并发症的发生,降低高血压致残率及病死率[5]。脂蛋白a由肝脏合成,与动脉粥样硬化形成关系密切,为冠心病的独立危险因子。胱抑素C为一种溶酶体蛋白酶抑制剂,近年来,有研究表明,其与新发及恶化的高血压相关[6-7]。本研究回顾性分析了本院2016年5月至2017年7月收治的342例原发性高血压患者的临床资料,旨在研究原发性高血压患者脂蛋白a和胱抑素C血清水平与高血压分级的相关性,探讨脂蛋白a和胱抑素C在高血压患者病情严重程度评估的临床应用价值。
1 资料与方法
1.1一般资料 342例经临床确诊的原发性高血压患者均来源于2016年5月至2017年7月本院心内科、肾病科门诊及住院患者,根据高血压分级标准分为低危组56例,其中男32例,女24例;年龄40~78岁,平均(55.2±8.3)岁;病程2~5年,平均(2.9±0.7)年。中危组78例,其中男42例,女36例;年龄41~75岁,平均(55.9±8.7)岁;病程2~7年,平均(3.6±0.9)年。高危组101例,其中男57例,女44例;年龄49~64岁,平均(55.6±8.4)岁;病程3~10年,平均(4.1±1.3)年。极高危组107例,其中男62例,女45例;年龄42~79岁,平均(56.2±8.8)岁;病程4~13年,平均(5.2±1.8)年。各组患者性别、年龄、病程等一般资料比较,差异无统计学意义(P>0.05),具有可比性,研究对象的选择注意排除妊娠妇女、继发性高血压、恶性肿瘤、结缔组织病、痛风、严重感染及免疫性疾病患者。本研究经医院伦理会批准开展执行,研究对象签署知情同意书,享有知情权。
1.2诊断及分级标准 原发性高血压诊断参照2010年版《中国高血压防治指南》[8]。分级标准:低危组患者为高血压1级,血压140~159/90~99 mm Hg(1 mm Hg=0.133 kPa),无高危因素;中危组患者为高血压2级,血压160~179/100~109 mm Hg;有1~2个高危因素;高危组患者为高血压2级,血压160~179/100~109 mm Hg,有靶器官损伤、糖尿病、夜尿增多或视物模糊;极高危组患者为高血压3级,收缩压≥180 mm Hg或舒张压≥110 mm Hg,血压控制不好,出现并发症。
1.3研究方法 询问病史,记录各组患者一般情况,并进行详细体格检查,了解其血压、高血压高危因素、并发症等基本情况等。比较各组患者脂蛋白a和胱抑素C血清水平的差异,分析脂蛋白a和胱抑素C与高血压分级的相关性。
1.4实验室检查 采集各组患者清晨空腹血5 mL,3 000 r/min离心分离血清检测脂蛋白a和胱抑素C,脂蛋白a和胱抑素C的检测均采用免疫透射比浊法,比色波长490 nm,试剂使用宁波美康生物有限公司产品,全自动生化分析仪器为HITACHI7600,当日室内质量控制保证结果的有效性,正常范围:脂蛋白a 0~300 mg/L;胱抑素C 0.00~1.03 mg/L。
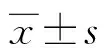
2 结 果
2.1各组患者脂蛋白a和胱抑素C血清水平比较 各组患者脂蛋白a和胱抑素C血清水平比较,差异均有统计学意义(P<0.05),任意两组患者脂蛋白a和胱抑素C血清水平比较,差异均有统计学意义(P<0.05)。脂蛋白a和胱抑素C血清水平在低危组、中危组、高危组及极高危组依次升高。见表1。
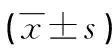
表1 各组患者脂蛋白a与胱抑素C血清水平比较
注:与低危组比较,*P<0.05;与中危组比较,#P<0.05;与高危组比较,▲P<0.05
2.2脂蛋白a和胱抑素C血清水平与高血压分级的相关性 脂蛋白a和胱抑素C血清水平与高血压分级均呈正相关,差异均有统计学意义(r=0.617、0.669,P<0.05)。见表2。

表2 脂蛋白a和胱抑素C血清水平与高血压分级的相关性
3 讨 论
随着我国人口老年化程度的加深,原发性高血压等老年病种已成为威胁广大老年人群生命健康的重要公共卫生问题。相关统计资料显示,在我国因高血压死亡的人数每年高达1 700万,且该数据一直呈增长趋势,发病年龄趋于年轻化[9-10]。有研究表明,原发性高血压为多种心、脑血管疾病的独立危险因子,在原发性高血压患者中脑卒中发生率增加2.6~2.8倍;心力衰竭发生率增加3.0~4.0倍;心绞痛发生概率增加2.0~2.2倍[11]。对原发性高血压的预防和控制的重要性逐渐得到医学界的高度重视,对原发性高血压的早期诊断,并采取必要的治疗措施控制血压,消除患者不良影响因子(减重、限盐、戒烟酒、增强锻炼等)在降低原发性高血压的危害性方面取得了良好的效果[12]。本研究着重探讨了原发性高血压患者脂蛋白a和胱抑素C变化与高血压分级的关联,旨在为原发性高血压的防控提供临床资料。
高血压以血管重构为主要病理特征。其病理表现为血管内膜增生肥厚,平滑肌胶原沉积导致血管中膜肥厚,血管中膜与内膜增厚使腔径、管腔与壁的比例减小。内膜增生的程度与高血压严重程度密切相关[13]。动脉粥样硬化与高血压发生机制相辅相成。一方面血管内膜变粗糙,形成粥样斑块,管腔变狭窄造成血压升高;另一方面动脉粥样硬化同时也是高血压发生、发展的病理基础。
脂蛋白a为肝脏合成的急性实相反应蛋白,也是一种特殊形式的低密度脂蛋白,其成分为低密度脂蛋白与载脂蛋白a通过二硫键连接。胱抑素C为半胱氨酸蛋白酶抑制物,由机体的有核细胞产生,为一种低相对分子质量、碱性非糖化蛋白质,存在于各种组织的有核细胞和体液中,相对分子质量为13.3×103,由122个氨基酸残基组成。本研究结果显示,脂蛋白a和胱抑素C血清水平在高血压低危组、中危组、高危组及极高危组依次升高,差异均有统计学意义(P<0.05)。相关性分析结果显示,脂蛋白a和胱抑素C血清水平与高血压分级均呈正相关,且胱抑素C与高血压分级的相关性优于脂蛋白a。
脂蛋白a在动脉粥样硬化斑块的形成具有重要作用,脂蛋白a可促进血管平滑肌增殖,对粥样斑块的形成具有重要的促进作用。有研究表明,脂蛋白a血清水平大于300 mg/L时动脉粥样硬化发生率成倍增加,其可促进细胞脂质增多而向泡沫细胞转化,并促进泡沫细胞在血管壁沉积,加快粥样硬化斑块形成进程[14]。UMOH等[15]认为,脂蛋白a通过促进内皮细胞、平滑肌细胞对其氧化修饰及巨噬细胞对氧化型脂蛋白a结合和摄取,促进泡沫细胞的形成等多种途径加速粥样硬化斑块形成。
胱抑素C则与高血压患者的血管重构关系密切。有研究表明,胱抑素C具有抗动脉硬化的作用[16]。缺乏胱抑素C可加速动脉粥样硬化进程。在血管重构中细胞外基质的降解主要受胱抑素C与组织蛋白酶(半胱氨酸蛋白酶、基质金属蛋白酶)的动态平衡调控,血管内皮细胞受损后引起巨噬细胞和平滑肌细胞激活并释放组织蛋白酶降解细胞外基质,胱抑素C对粒细胞的吞噬及驱化给予强烈的抑制作用,并参与粥样硬化斑块形成中的炎性过程。胱抑素C抑制组织蛋白酶表达过度消耗,粥样硬化斑块处胱抑素C水平下降,引起机体反馈性胱抑素C水平升高[17-18]。本研究结果符合上述观点。在高血压患者中脂蛋白a和胱抑素C血清水平与高血压分级均呈正相关。
4 结 论
脂蛋白a、胱抑素C参与了原发性高血压病理及生理过程,与高血压分级呈正相关,脂蛋白a、胱抑素C血清水平的监测有助于了解原发性高血压患者病情的危重程度,对高血压的防治具有重要的临床意义。
