PMA-qPCR快速检测畜禽肉类中沙门氏菌活菌方法的建立
2019-01-19刘光富付贤树俞晓平
刘光富,马 骉,付贤树,俞晓平
(中国计量大学 生命科学学院 浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018)
沙门氏菌是一种常见的食源性致病菌,属于革兰氏阴性(Gram-negative)肠道杆菌.在大多数的沙门氏菌污染食品中毒事件中,肠炎沙门氏菌(Salmonellaenteritidis)引起的占大部分.沙门氏菌会造成人类的各种疾病如伤寒、肠胃炎、感染性腹泻、发热及呕吐等.目前,对沙门氏菌的检测主要是按照国标规定进行,其检测程序复杂,检测周期较长,且对于疑似致病菌的菌落的筛选也存在不确定性.因此,为了保障食品行业的健康发展,满足食品安全检测的快速准确,亟需建立一种新的有效的快速检测方法,来检测和控制沙门氏菌的传播,维护人民群众的健康.
叠氮溴化丙锭(Propidium monoazide,PMA)是一种对核酸具有高度结合能力的光敏染料[1],它能够与细胞壁或细胞膜不完整的死菌的DNA相结合,而不会与具有完整细胞壁或细胞膜的活菌细胞的DNA结合,从而可实现对食品中活菌的快速检测[2-3].本文利用PMA的活细胞筛选功能,将PMA与荧光定量PCR(qPCR)技术相结合,旨在建立能够快速定量检测沙门氏菌活菌的检测方法,并避免检测过程中的假阳性和假阴性的出现.通过将PMA-qPCR应用于畜禽肉类样品的定量检测,以获得我国肉类食品中沙门氏菌污染程度的准确定量监测数据,为开展食品安全风险评估提供重要的科学依据.
1 材料与方法
1.1 材料
本文所用菌种为肠炎沙门菌(SalmonellaenteritidisCMCC 50335),PMA购于美国Biotium公司,二甲基亚砜、LB液体培养基和Taq酶购自Sangon Biotech公司,细菌DNA提取试剂盒购自Promega 公司,pMDTM18-T Vector Cloning Kit购自日本TaKaRa公司,荧光定量PCR仪购自BIO-RAD公司.
1.2 沙门氏菌活菌和死菌悬液的制备
取肠炎沙门菌标准菌株CMCC 50335接种于LB培养液,37 ℃,120 r/min下振荡培养至对数生长期,取适量菌液进行稀释,通过营养琼脂平皿培养计数得到含菌量为1.0×108CFU/mL的活菌悬液.将活菌悬液90 ℃水浴处理10 min灭活,冰上冷却5 min,得到热致死菌悬液.
1.3 PMA的配置
1.3.1 PMA储存液及工作液配制
将PMA溶解于20%的二甲基亚砜中,配制成质量浓度为5 mg/mL的PMA储存液,-20 ℃避光保存.将上述配好的储存液以二甲基亚砜稀释10倍即为工作液.
1.3.2 最适PMA浓度的确定
取200 μL制备好的活菌悬液和死菌悬液加入一定量的PMA工作液,使PMA最终浓度分别为0、3、6、12、15、20和25 μg/mL,避光10 min后将样品置于冰上,650 W卤素灯在距样品20 cm处照射10 min后,按照最佳曝光时间进行光反应,提取细菌DNA,进行PCR扩增和荧光定量PCR检测[4].
1.3.3 混合菌液最适暗培育时间的确定
取100 μL活菌/死菌混合菌悬液加入一定量的PMA工作液,使PMA终浓度为12 μg/mL,分别避光孵育5、10、15、20、25 min后置于冰上,650 W卤素灯在距样品20 cm处照射10 min,按照最佳曝光时间进行光反应,提取菌液DNA做模板,进行荧光定量PCR检测.
1.3.4 最适PMA曝光时间的确定
取活菌悬液及死菌悬液200 μL各5份,加入适量PMA工作液,使PMA终浓度为12 μg/mL,充分混匀,避光孵育10 min,使PMA与样品充分结合.然后置于冰上,650 W卤素灯下20 cm处分别照射2、4、6、8和10 min.将未经PMA处理的样品设为阳性对照.提取经PMA处理后的细菌DNA作为模板,进行荧光定量PCR检测,研究检测PMA处理的最佳曝光时间.
1.3.5 活菌/热致死菌混合菌悬液的PMA处理
分别按照活菌比例为0%、5%、10%、15%、30%、40%、60%、100%制备混合菌液,将未经任何处理的活菌悬液作为对照.向各组细菌悬液中加入适量PMA工作液,使PMA终质量浓度为12 μg/mL.用650 W的卤素灯在距样品20 cm处避光照射10 min,按照最佳曝光时间进行光反应,提取细菌DNA作模板,进行荧光定量PCR检测,观察PMA对死菌的影响.
1.4 引物设计
以沙门氏菌invA基因(GenBank:M90846.1)为特异性基因设计引物和探针,引物序列见表1.

表1 引物序列Table 1 Primer sequence
1.5 DNA提取
取0.6 mL菌液,用细菌DNA提取试剂盒提取细菌DNA,将提取好的细菌DNA保存于-20 ℃备用.
1.6 PCR反应体系
常规PCR:PCR Master mix 10 μL,上下游引物各0.5 μL,DNA模板2 μL,加水补足20 μL;荧光定量PCR: SYBR Green Realtime 13 μL,上游引物0.5 μL,下游引物0.5 μL,菌液DNA 5 μL,超纯水6 μL.反应程序:94 ℃ 1 min,94 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s,40个循环,每个样品重复3次,求出平均Ct值.
1.7 PMA-qPCR灵敏度分析
将含菌量为108CFU/mL的沙门氏菌活菌悬液依次进行10倍稀释,分别得到107至101CFU/mL 7个梯度的活菌悬液,利用上述获得的最适PMA浓度、最适曝光时间及最适暗孵育时间处理样品,然后将样品进行qPCR检测,分析PMA-qPCR检测方法的灵敏度.
1.8 市售畜禽样品的人工污染
取10 g市售猪肉(腿肉,约克夏猪),用FDA推荐的传统方法[9].证明不含沙门氏菌,研磨成无菌肉浆,分别加入上述含菌量为101~108CFU/mL的沙门氏菌活菌液.染菌样品采用最适PMA处理条件处理后,按照说明书提取细菌DNA,以此为模板进行荧光定量PCR检测,利用标准曲线得到各组菌液的拷贝数,将此拷贝数与传统的计数法所得结果比较分析.
1.9 数据处理
数据采用“平均值±标准差”表示.运用SPSS18.0统计软件进行方差分析,各处理平均数之间用Duncan’s方法比较差异显著性,显著性水平设置为P<0.05.
2 结果与分析
2.1 最适PMA浓度的确定
利用不同浓度PMA处理热致死菌悬液时,随着PMA浓度的增加,PMA对热致死菌悬液的扩增抑制率逐渐增大(图1),当PMA浓度为12 μg/mL时,扩增抑制率最大,达到97.5%;当PMA浓度低于15 μg/mL时,PMA对活菌的检出无影响,当PMA浓度超过20 μg/mL时,活菌的检出率明显受到抑制(P<0.05),且随着PMA浓度的升高,活菌抑制效果越明显,提示利用浓度超过20 μg/mL的PMA处理菌液时,会出现假阴性.
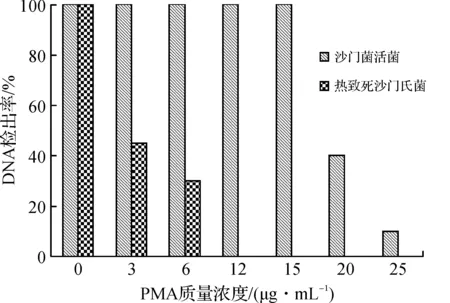
图1 最佳PMA浓度的选取Figure 1 Selection of the optimal concentration of PMA
2.2 最适培育时间及最适曝光时间的确定
利用12 μg/mL浓度PMA处理热致死菌悬液,设置不同的暗孵育时间与曝光时间,提取细菌DNA作模板,优化qPCR体系后进行荧光定量PCR扩增.从图2—3可以看出,当暗孵育时间为10 min时,PMA能与热致死菌DNA完全交联,扩增抑制率可达到98%(图2);PMA对热致死菌悬液的抑制率随着曝光时间的延长而上升,当曝光时间大于6 min时,对热致死菌悬液的抑制率可达到99%(图3).结果提示,样品加入PMA后,暗孵育10 min、曝光7 min为区分沙门氏菌活菌/死菌的最佳实验条件.
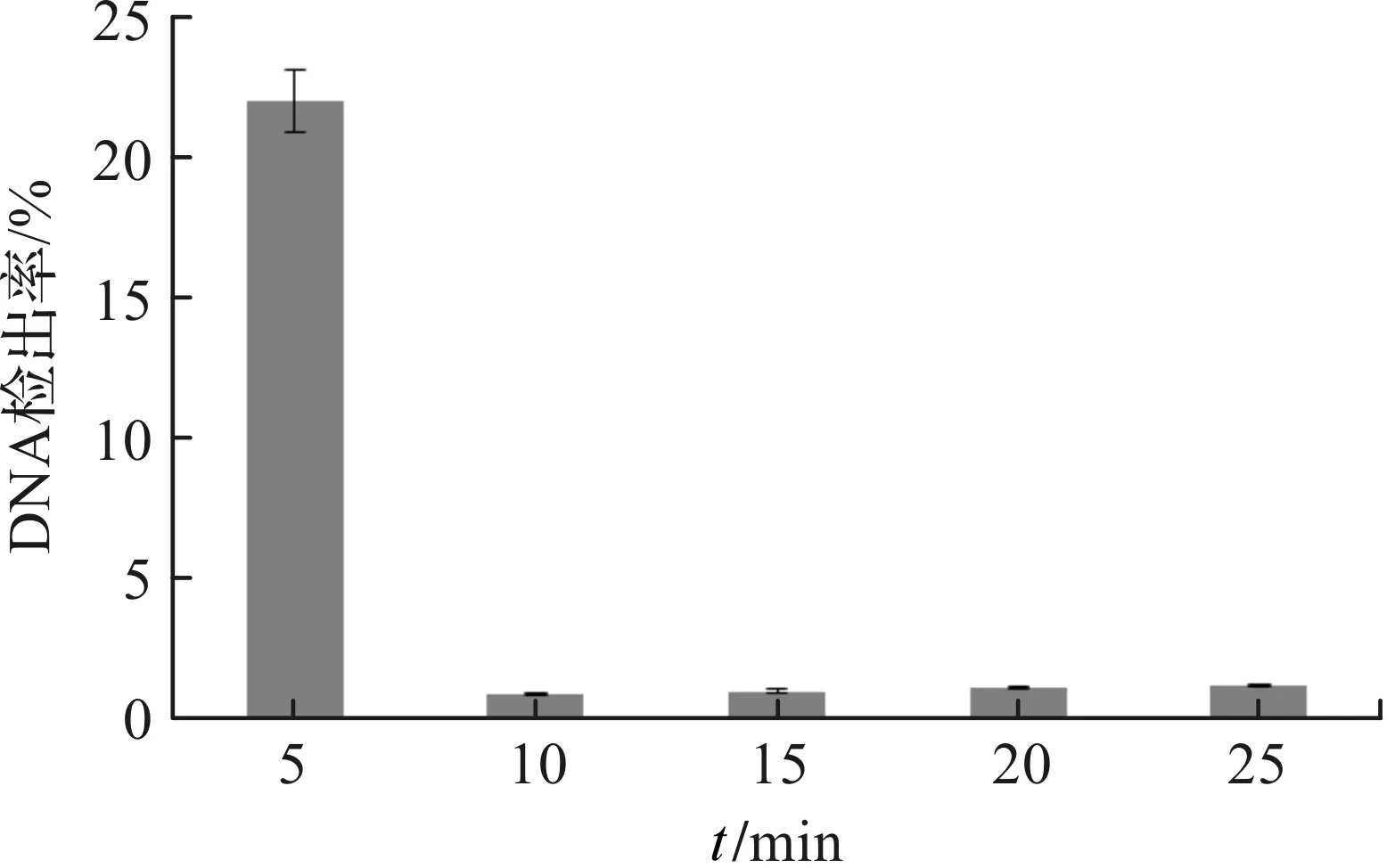
图2 不同暗孵育时间对PMA对菌悬液抑制率的影响Figure 2 Effect of dark incubation time on inhibition rate of PMA to bacterial suspension
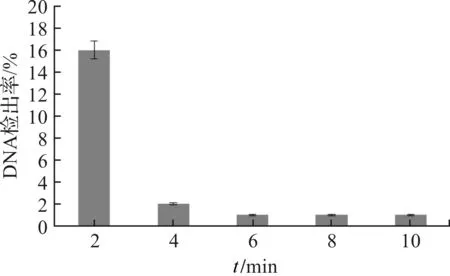
图3 不同曝光时间对PMA对菌悬液抑制率的影响Figure 3 Effect of exposure time on inhibition rate of PMA to bacterial suspension
2.3 PMA-qPCR方法的灵敏度检测
10倍梯度稀释沙门氏菌活菌悬液后,利用本文上述优化的PMA处理条件处理活菌悬液,然后进行荧光定量PCR检测,获得各个浓度菌液的Ct值,然后以Ct值为纵坐标,以各个菌液浓度的对数为横坐标绘制标准曲线(图4).结果显示,菌液拷贝数与Ct值之间存在线性关系,回归方程为y=-3.964 3x+39.857,相关系数(R2)为0.993 9.最低检测限为10 CFU/mL.
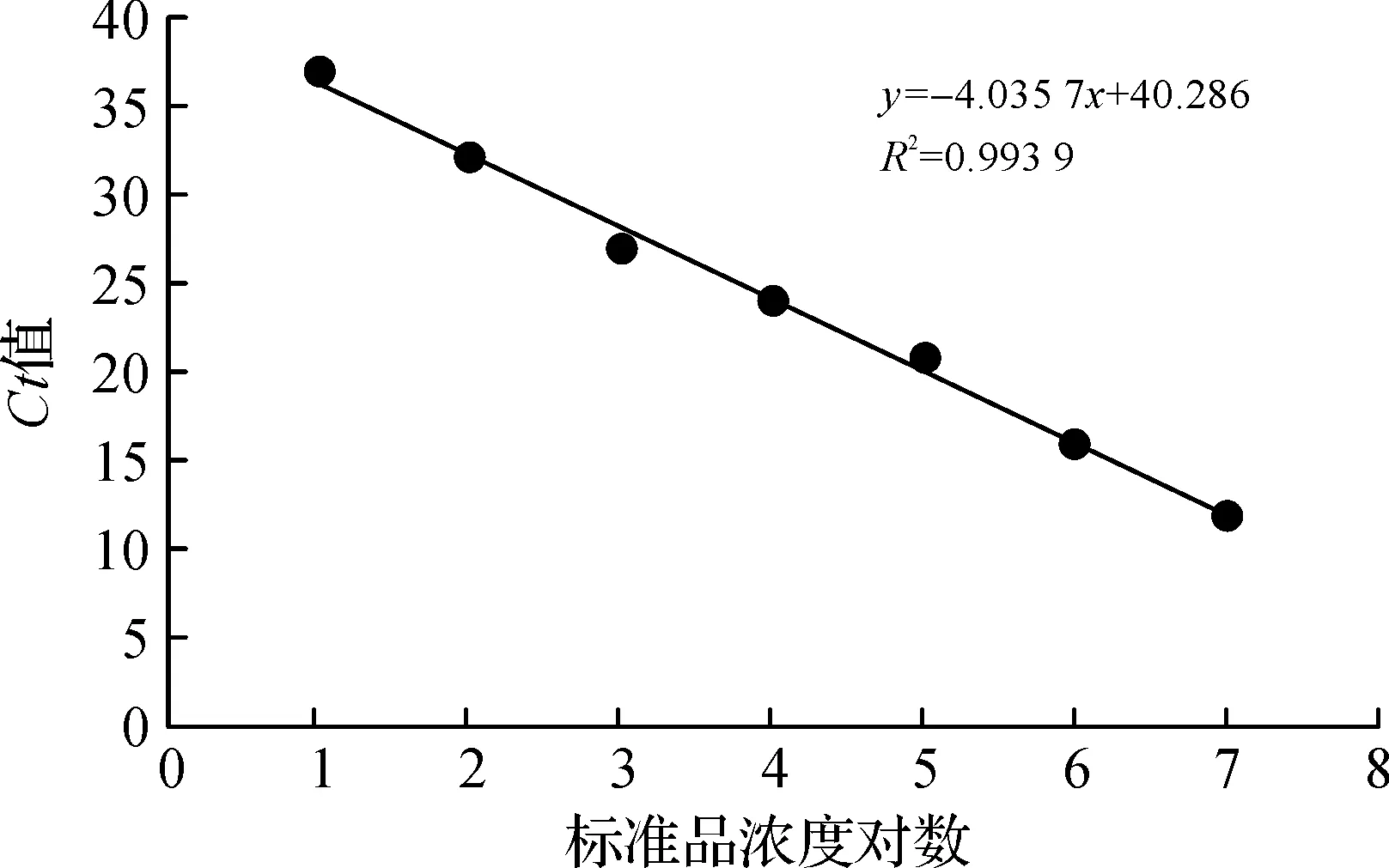
图4 PMA-qPCR灵敏度检测Figure 4 Detection of the sensitivity of PMA-qPCR
2.4 活菌/热致死菌细胞混合样品的PMA处理效果
结果显示(图5),当样品中全部为死菌时,未经PMA处理的样品仍能测得Ct值,说明样品中的死菌的扩增未被抑制,仍然有扩增信号;而经PMA处理的样品未测得Ct值,说明样品中死菌DNA被PMA交联,PCR扩增被抑制.Ct值随着活菌含菌量的增加逐渐降低,也即菌液经PMA处理后,用于扩增的细菌DNA模板数量变少.当样品中全部为活菌时,未经PMA处理的样品的Ct值与PMA处理的样品的Ct值比较,差异不显著(P>0.05),这表明PMA能有效抑制死菌的扩增而不影响活菌的检出.
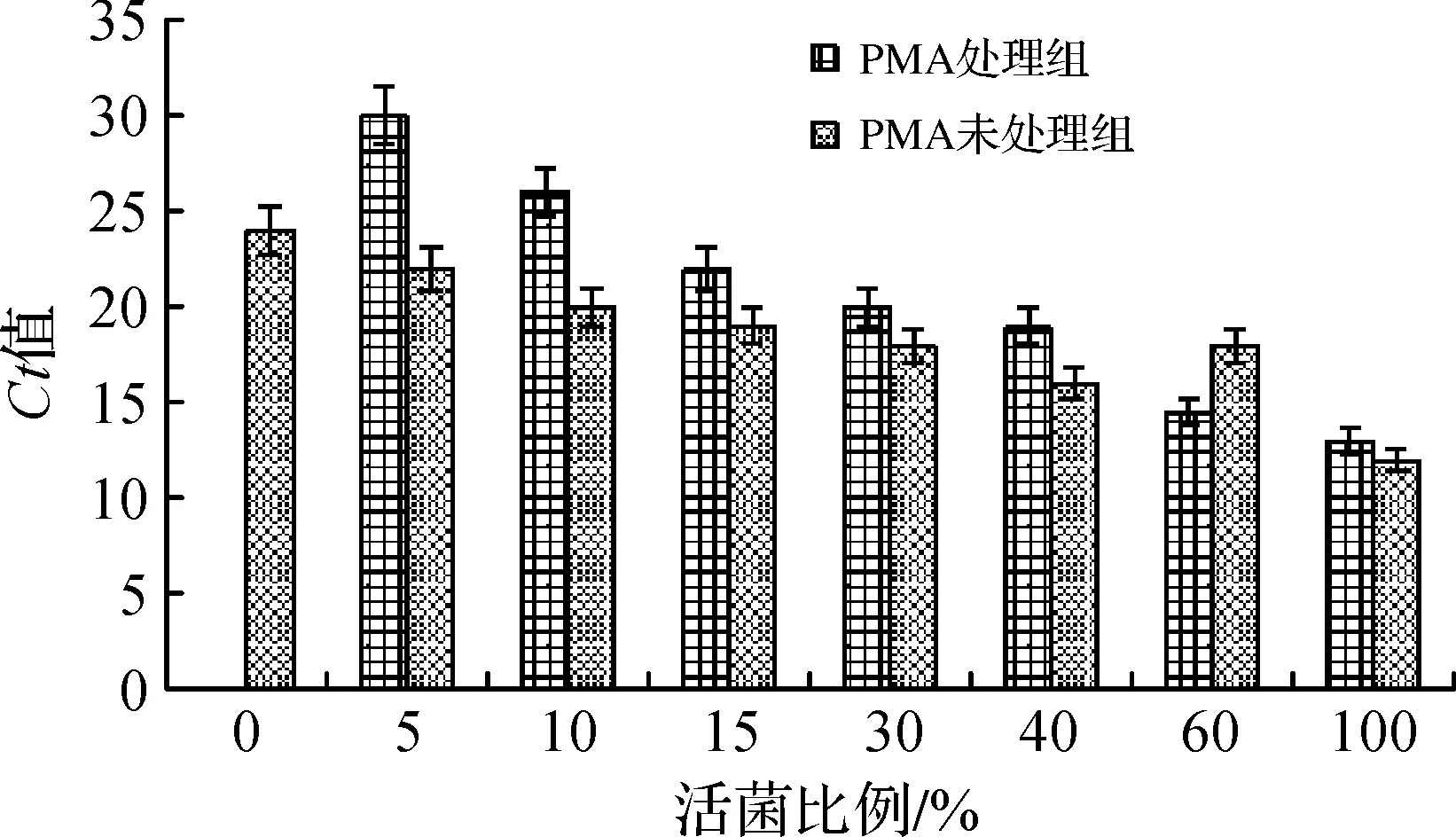
图5 不同比例菌悬液的PMA-qPCR检测结果Figure 5 Results of PMA-qPCR detection on the different proportion of live and dead bacteria
2.5 市售畜禽样品中沙门氏菌的检测
用不同含菌量的沙门氏菌液处理猪肉样品进行人工染菌,然后进行PMA-qPCR检测,利用所建立的标准曲线得到样品的拷贝数.结果显示,当菌液含菌量为101和102CFU/mL时均没有扩增信号出现.当菌液含菌量分别为103、104、105、106、107和108CFU/mL时可测得人工染菌样品的拷贝数.将PMA-qPCR结果与传统的培养计数法结果进行比较发现,在103~108CFU/mL范围内,沙门氏菌活菌的定量检测结果与平皿计数法结果在统计学上无显著性差异(P>0.05)(表2).
3 讨论
如何有效的将样品中的致病活菌检测出来是当前食品安全快速检测工作中的关键.活细胞和死细胞以及细胞膜损伤细胞的区别在于:在扩增的过程中,由于细胞壁的屏障作用,活细胞不会受到PMA的影响,在裂解过程中也不会与失活的PMA反应.通过这种方法,最终使死亡细胞中的DNA在核酸纯化中被选择性的剔除[8].随着PMA染料在食品安全快速检测领域的应用越来越广泛,许多学者研究发现,PMA的作用效果受PMA的浓度、菌液含菌量、暗孵育与曝光时间及微生物致死方法的影响[5-6].活菌和死菌的最主要的区别在于细胞膜的完整性、通透性.死细胞和膜损伤细胞由于膜的完整性被破坏,PMA染料可以和其DNA结合,从而可以抑制这些细胞的检出,活细胞具有完整的细胞膜结构,PMA不能与其DNA结合从而被扩增.
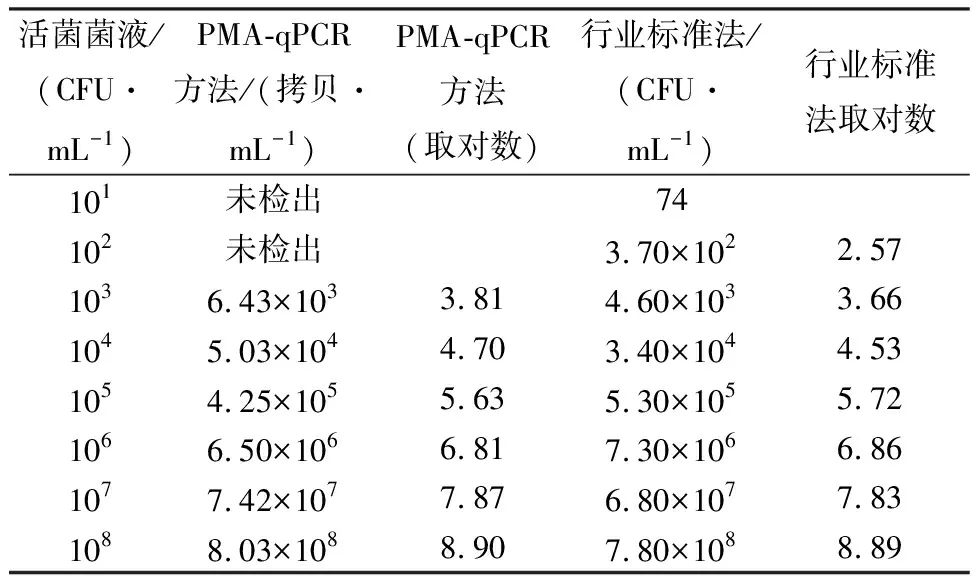
表2 人工染菌猪肉样品PMA-qPCR与平皿法计数检测结果比较Table 2 Comparitive detection of artificially infected pork by using PMA-qPCR and plate counting methods
本文研究显示,在最适PMA浓度和最适培育时间确定的条件下,曝光6 min,PMA就能够充分的与细菌DNA分子发生共价交联,不参与交联的PMA在光照下被钝化消解.结果显示,当PMA浓度≥12 μg/mL时,PMA可有效地与死菌或细胞膜损伤细胞的DNA结合,从而导致死菌或细胞膜损伤细胞的扩增被全面抑制.本研究进一步研究了可有效抑制死菌DNA扩增且对活菌DNA扩增不产生影响的PMA浓度,结果显示,当PMA浓度逐渐增加到20 μg/mL时,活菌细胞膜或细胞壁受到损伤,从而造成活菌数量的减少,影响扩增效果.因此,选取12 μg/mL的PMA浓度作为筛选活菌和死菌的最适浓度,可有效避免假阳性的干扰,同时也不影响活菌DNA的扩增.祝儒刚[10]推荐的PMA检测浓度为4 μg/mL,远低于本研究的12 μg/mL,但其需要的曝光时间为15 min,远远高于本研究曝光时间.本文研究结果也表明,曝光6 min后PMA可完全抑制样品中死菌DNA的扩增,同时也确保游离的PMA被全部钝化.利用本研究优化的条件,也即PMA浓度为12 μg/mL、光照6 min时,可有效排除检测样品中死菌或细胞膜损伤细胞DNA对扩增的干扰,避免检测过程中出现“假阳性”的情况,从而实现通过PMA-qPCR技术对沙门氏菌活菌的快速检测.
4 结语
本研究所建立的PMA-qPCR方法既能有效地抑制死菌的扩增,又不需要复杂的仪器即能完成反应,而且灵敏度较高,对沙门菌活菌的检出限为10 CFU/mL.此方法可为食源性致病菌的检测提供一种新思路.
