弱光胁迫下‘鄞红’葡萄光合特性及相关基因的表达
2019-01-18何静雯岳庆春吴月燕
何静雯,赵 晟,岳庆春,吴月燕*
(1.上海海洋大学 水产与生命学院,上海 201306;2.浙江万里学院 生物与环境学院,浙江 宁波 315100)
【研究意义】葡萄(Vitisvinifera)为多年生木质藤本植物,是世界上最广泛种植的果树树种之一,遍布于欧、亚及格陵兰[1]。‘鄞红’葡萄为宁波地区设施栽培特有品种,由优良变异单株选育而来,属欧美杂交种。该葡萄品种的栽培主要采用简易型日光温室,可抵御环境污染和台风等不良气候的影响,但室内环境通常具有透光量低、光质差等特点[2],所以部分葡萄会因采光不足进而产生弱光胁迫。大量研究证明,光照不足会严重影响植物的产量和品质,进而影响其生理生化过程及形态建成[3-4]。植物在长期进化过程中会形成一系列的自我保护机制以抵御胁迫环境的伤害[5],弱光环境下,植物净光合速率与CO2羧化效率均会受到影响, 叶绿体也会出现数目减少、色素含量降低等现象[6]。其次,植株电子传递受阻、光呼吸下降、碳同化酶活性降低也是植物对弱光胁迫的响应特征之一[7]。【前人研究进展】近年来,植物抗逆基因的研究也成为众多植物领域的热门,多酚氧化酶(polyphenol oxidase, PPO)是植物体内广泛存在的一种氧化还原酶[8],在植物的研究中发现PPO基因在胁迫环境下上调表达[9];光敏色素E(Phytochrome E,PhyE)是双子叶光敏色素家族中的一员,对逆境环境有很强的适应能力[10]。因此,弱光响应的分析与测定是植物生理生化研究的关键[11]。但是目前,国内外有关弱光的研究多是从弱光胁迫对植物的光合作用、同化力的形成等方面入手,且主要集中在茄子、番茄、辣椒等蔬菜作物上[12-13],对葡萄耐弱光机理、光合作用关键酶以及PPO与PhyE基因对弱光胁迫的影响研究相对较少。【本研究切入点】本研究阐述了不同弱光条件对葡萄的生长形态、光合作用指标、光合作用相关酶以及PPO与PhyE基因表达量的影响,【拟解决的关键问题】为今后葡萄相关品种的光照管理及品种推广提供理论依据。
1 材料与方法
1.1 供试材料
试验于2017年6-7月在浙江万里学院生物与环境学院植物培养室内进行,温度恒定在38℃左右,相对湿度65 %。供试品种为150株长势均匀的一年生盆栽‘鄞红’葡萄幼苗,植株修剪和肥水管理参照吴月燕等[14]的方法。以遮阳网和塑料薄膜为覆盖材料进行遮荫处理,遮荫程度设置5个水平,即 CK(遮光率为0、光照强度28 000 lx)、T1(遮光率25 %、光照强度约22 000 lx)、T2(遮光率40 %、光照强度约17 000 lx)、T3(遮光率70 %、光照强度约10 000 lx)、T4(遮光率85 %、光照强度约5000 lx)。在遮荫处理后的0、10、20、30 d观察并采样,进行各种理化指标的测定,每组指标均重复3次并取平均值。
1.2 试验方法
1.2.1 ‘鄞红’叶片生长指标及叶片色素含量的测定 每处理组随机选取5株,将根部和叶片完整剪下,采用LA-S全能植物图像分析系统(广州深华公司)测定根系长度、直径、表面积、叶面积。采用丙酮提取法[15]称取0.2 g叶片,加入少量石英砂、80 %丙酮研成匀浆,静置2~3 min后定容到25 mL。测定提取液在665、649、470 nm波长下的吸光度值并分别计算出叶绿素和类胡萝卜素含量。
1.2.2 光合气体交换参数及响应曲线的测定 采用GIRAS-3光合仪(美国PP Systems公司)于12:00-14:00左右充足阳光下测定叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)。仪器设定温度为25 ℃,相对湿度(RH)65 %~85 %,每个处理随机选取5片叶,重复3次取均值。光响应曲线用红蓝光源light-curve测定,CO2浓度设定为(400 ± 10) μmol·m-2s-1,光合有效辐射梯度设定为0、25、75、100、150、200、500、800、1000、1200、1500和2000 μmol·m-2s-1;CO2响应曲线测定选择A-CI Curve曲线测定,叶室CO2梯度设定为 50、100、150、300、400、500、600、800、1000、1200和1500 μmol·m-2s-1光强设定为为1000 μmol·m-2s-1。
1.2.3 乙醇酸氧化酶活性的测定 采用Solaribio公司试剂盒(BC2015)测定叶片中乙醇酸氧化酶(Glycolate oxidase,GO)活性,计算公式如下:GO(nmol/min/g)=ΔA/(ε×d)×V反总/(W×V样/样总)/T= 392×ΔA/W,其中:ε为乙醛酸苯腙毫摩尔消光系数,17 L/mmol/cm;d:比色皿光径,1 cm;V反总:反应总体积,mL;V样:反应中样本体积,mL;V样总:加入提取液体积,mL;W:样本质量g;T:反应时间,min。
1.2.4 核酮糖-1,5-二磷酸羧化酶/加氧酶(Ribulose bisphosphate carboxylase oxygenase, Rubisco)与Rubisco活化酶(RCA)活性的测定 按照GMS16015和GMS16016试剂盒(上海杰美基因医药科技有限公司)说明书提取叶片中Rubisco与RCA,并分别计算其活性值。
1.2.5 ‘鄞红’发育时期光合作用相关基因表达量测定 遮荫处理30 d后,测定葡萄叶片在不同遮荫程度下PPO与PhyE基因表达量的变化。按照植物总RNA提取试剂盒(OMEGA公司,R6827-01)说明书提取叶片总RNA。采用NanoDropTM 2000分光光度计(Thermo Fisher, USA)测定总RNA的质量和纯度,1.5 %琼脂糖凝胶电泳鉴定其完整性。吸光度OD260/280值在1.9~2.1之间、电泳有3条亮带且28s条带亮度大约是18s 2倍的总RNA为高质量RNA,可进行cDNA第一链合成实验。以提取的高质量总RNA为模版,使用SuperRT cDNA第一链合成试剂盒(SuperRT cDNA Kit CW0741, CWBIO,China)反转录合成cDNA第一链,具体操作步骤按说明书进行。

表1 弱光胁迫对‘鄞红’叶片生长特性的影响
注:字母代表差异显著(P<0.05)。
Notes: Letters indicate a significant difference at 0.05 level.
根据已报道的葡萄PPO(NW_003724172.1)和PhyE(NC_012016.3)基因序列,采用Primer软件分别设计荧光pcr引物:PPO-F:ATAACTTCCCCATCAGGACCTACCC和PPO-R:AAATACCGCCAAAGT CTAATGCTGC,PhyE-F:AACTTACCCTCTATTTTGGTGCCTT和PhyE-R:ATTTTGGTGCCTTTAGTGGGC CTAG。以葡萄β-Actin为内参基因设计引物,Actin-F:ATTGTGCTTAGTGGTGGGTGG,Actin-R:GATTTCCTTGCTCATTCTGTC。数据处理采用相对值2-△△Ct进行计算,用 GraphPrism7.0处理数据和作图,SPSS23.0软件对数据进行方差分析,LSD法进行多重比较。
2 结果与分析
2.1 弱光胁迫对‘鄞红’叶片生长特性的影响
由表1所示,试验过程中T1叶片生长状况良好,差异不显著(P>0.05),T2与T3生长状况下降明显,叶片出现少量黄斑和脱落,但仍然能够继续生长(P>0.05),其中叶面积会随着弱光胁迫的增加而变大。但随着遮荫程度进一步加强,T4叶片出现大量黄斑和脱落,生长严重受阻,各项指标均显著低于对照组(P<0.05)。因此,一定程度的遮荫有利于叶片生长。
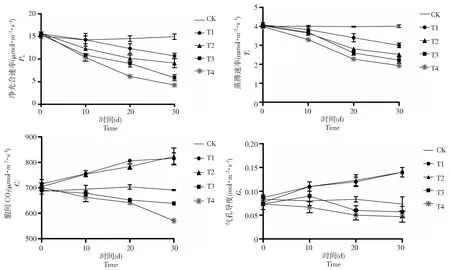
图1 弱光胁迫下‘鄞红’葡萄叶片光合气体交换参数含量的变化Fig.1 Changes of photosynthetic gas exchange parameters in ‘Yinhong’ grape leaves under weak light stress
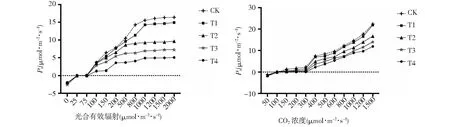
图2 弱光胁迫下‘鄞红’葡萄叶片净光合速率与光合-CO2响应曲线Fig.2 Static photosynthetic rate and photosynthetic-CO2 response curve of ‘Yinhong’ grape leaves under weak light stress
2.2 弱光胁迫对‘鄞红’叶片光合气体交换参数的影响
从图1可以看出,不同处理组间的光合特性随处理时间的增长变化显著,不同处理下葡萄叶片净光合速率变化总体表现为:CK>T1>T2>T3>T4。蒸腾速率与光合速率密切相关,是植物水分吸收和物质运输的主要动力[16]。本研究发现弱光胁迫下‘鄞红’葡萄叶片的净光合速率(Pn)与蒸腾速率(Tr)在处理期间持续下降,处理结束后分别下降了71.6 %和51.9 %,均显著低于对照组(P<0.05),由此证明,光合作用和蒸腾作用的变化呈正相关。弱光下植株叶片胞间CO2浓度(Ci)与气孔导度(Gs)在T1与T2下均显著增加(P<0.05),T1相比CK浓度(Ci)上升了18.0 %,T2比CK高出19.1 %;气孔导度(Gs)的变化则更加明显,处理结束后,T1与T2均上升了91.0 %(P<0.05),但光合特性也会随着遮荫强度的增大而显著降低,T3与T4的Ci与Gs含量分别下降了7.6 %、17.4 %和22.7 %、36.4 %。
2.3 弱光胁迫下‘鄞红’叶片片净光合速率与光合-CO2响应曲线
从图2可以看出,随着光合有效辐射(PAR)的增加,葡萄叶片的Pn值逐渐升高,当光合有效辐射达到1000 μmol·m-2s-1左右时,净光合速率的趋势逐渐趋于平缓。CK组的净光合速率最高,但同时与对照相比,T1相对于其它处理组对光的利用能力最强,适合在单层遮荫环境中生长。其次,‘鄞红’叶片光合-CO2响应曲线可以看出,CO2浓度达到400 μmol·m-2s-1左右时,叶片净光合速率迅速升高,当CO2浓度在50 μmol·m-2s-1以下时,植株光合产物的积累为负值;同时,CK与4个处理的Pn值随CO2浓度的升高持续增长。由此证明‘鄞红’葡萄是喜光植物,且对高浓度 CO2环境适应能力较强。
2.4 弱光胁迫对‘鄞红’叶片细胞色素的影响
由图3显示,弱光环境下T1与T2叶绿素含量均为先升高后维持在稳定状态,遮荫结束后分别比CK上升了63.5 %和70.6 %,均显著高于对照(P<0.05);但T3与T4的叶绿素含量却随着处理天数的增加而显著降低,试验结束后与对照相比分别下降了60.2 %和68.2 %,均显著低于对照(P<0.05)。在T1与T2处理下,‘鄞红’葡萄叶片的类胡萝卜素含量随着时间的变化积累,处理结束后相比对照上升62.5 %和89.4 %,但T3与T4相比对照组类胡萝卜素含量变化不显著(P>0.05)。
弱光胁迫下叶片Chl a/Chl b随胁迫天数的增加呈下降趋势,叶片中Chl b大于Chl a,通过增加 Chl b含量提高对蓝紫光的利用率以适应胁迫环境。与CK相比,遮荫结束后‘鄞红’叶片的Chl a/Chl b含量从T1~T4分别降低了4.4 %、4.1 %、10.4 %和14.1 %。

图3 弱光胁迫下‘鄞红’葡萄叶片细胞色素含量的变化Fig.3 Changes of cytochrome content of‘Yinhong’grape leaves under weak light stress
2.5 弱光胁迫对‘鄞红’乙醇酸氧化酶活性的影响
由图4显示,GO的活性随遮荫程度的增加呈逐渐上升的趋势,处理结束后T1相比CK略微下降0.7 %,处理前后差别甚微。T2处理后,GO值逐渐上升,相比CK增加了26.8 %,处于显著水平。随着遮荫程度的增加T3与T4乙醇酸氧化酶的活性显著升高,分别比对照组增加了51.8 %和55.4 %。由此得出,葡萄在重度遮荫下,光呼吸作用下降,但T1处理下,GO活性略有降低,适度遮荫有利于减少叶片内有害物质的累积,适宜植株生长。
2.6 弱光胁迫对‘鄞红’Rubisco与RCA活性的影响
由图5显示,遮荫结束后,‘鄞红’葡萄叶片Rubisco活性与净光合速率的变化趋势一致,弱光胁迫下Rubisco活力逐渐下降,T1~T4相比CK分别下降了41.6 %、47.0 %、50.6 %和57.2 %,均达到显著水平(P<0.05),同时RCA活性变化同Rubisco变化趋势基本一致,处理结束后分别比对照组下降了24.3 %、32.4 %、40.5 %和48.6 %(P<0.05)。Rubisco是光合碳同化的关键酶,直接影响光合速率的大小[17]。本研究表明,Rubisco活性的大小与净光合速率(Pn)具有高度一致性,弱光影响Rubisco活性,继而严重影响光合速率,这与烟草Rubisco活性对光合速率的响应研究结果一致[18]。
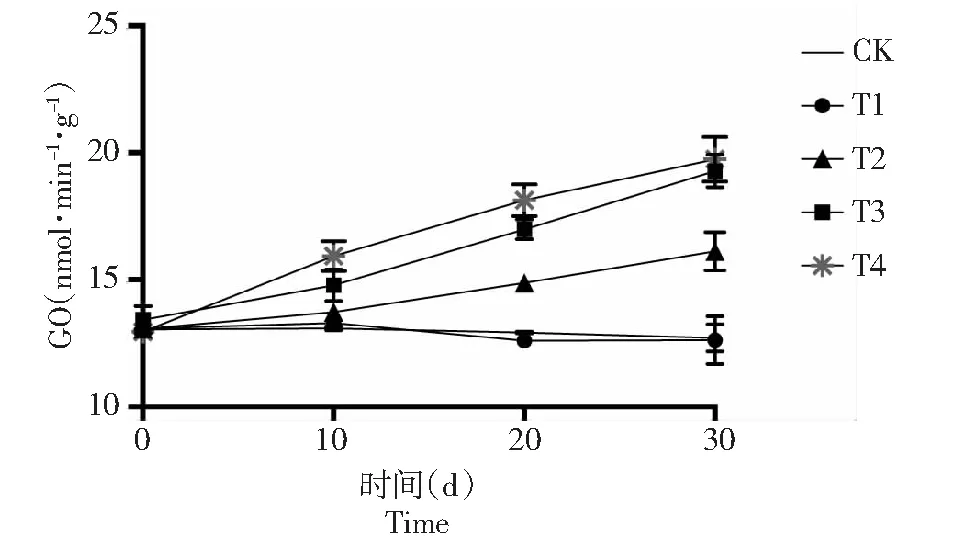
图4 弱光胁迫下‘鄞红’葡萄叶片乙醇酸氧化酶(GO)活性的变化Fig.4 Changes of glycolic acid oxidase (GO) activity in ‘Yinhong’ grape leaves under weak light stress
2.7 PPO与PhyE基因表达量分析
由图6表明,通过遮荫处理对‘鄞红’葡萄叶片PPO与PhyE基因表达发现,与CK相比,PPO基因的表达量呈先升高后降低的趋势,处理结束后对照组与组间差异显(P<0.05),T1处理下PPO基因表达量上升,说明适度遮荫会通过PPO基因上调表达来抵御胁迫环境,但随着遮荫程度的增强基因表达量也逐渐降低。另一基因PhyE表达量随遮荫程度的增加而下降,与对照组相比,4个处理组中PhyE基因表达量依次降低,差异均显著(P<0.05)。这与上述中净光合速率的变化一致,由此证明植物细胞会因弱光胁迫的增强而受损,导致无法合成PhyE。
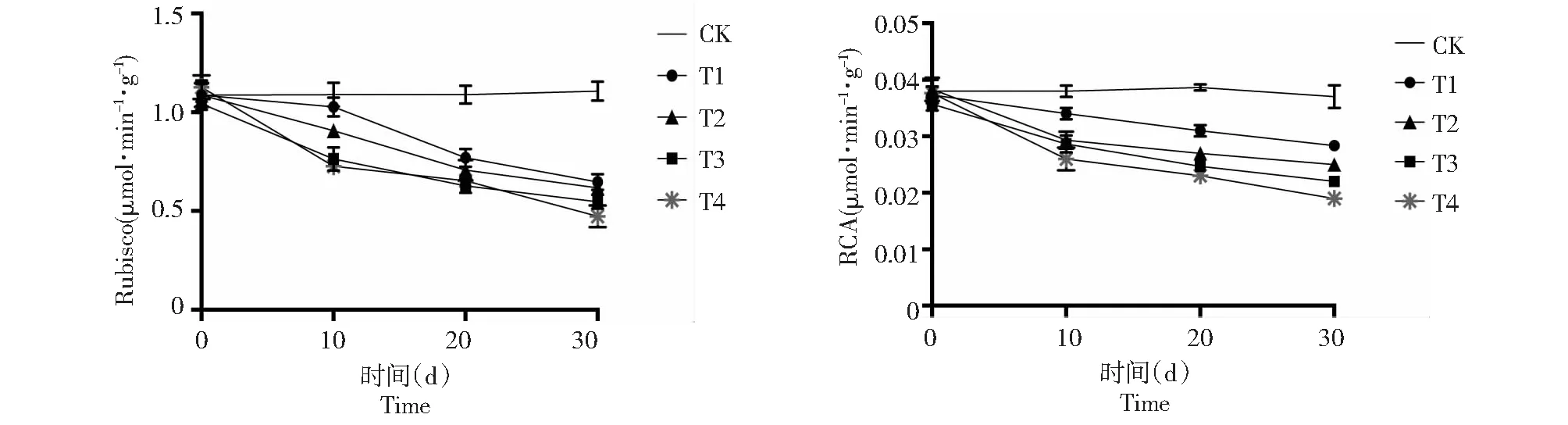
图5 弱光胁迫下‘鄞红’葡萄叶片Rubisco与RCA活性的变化Fig.5 Changes of Rubisco and RCA activity in ‘Yinhong’ grape leaves under weak light stress
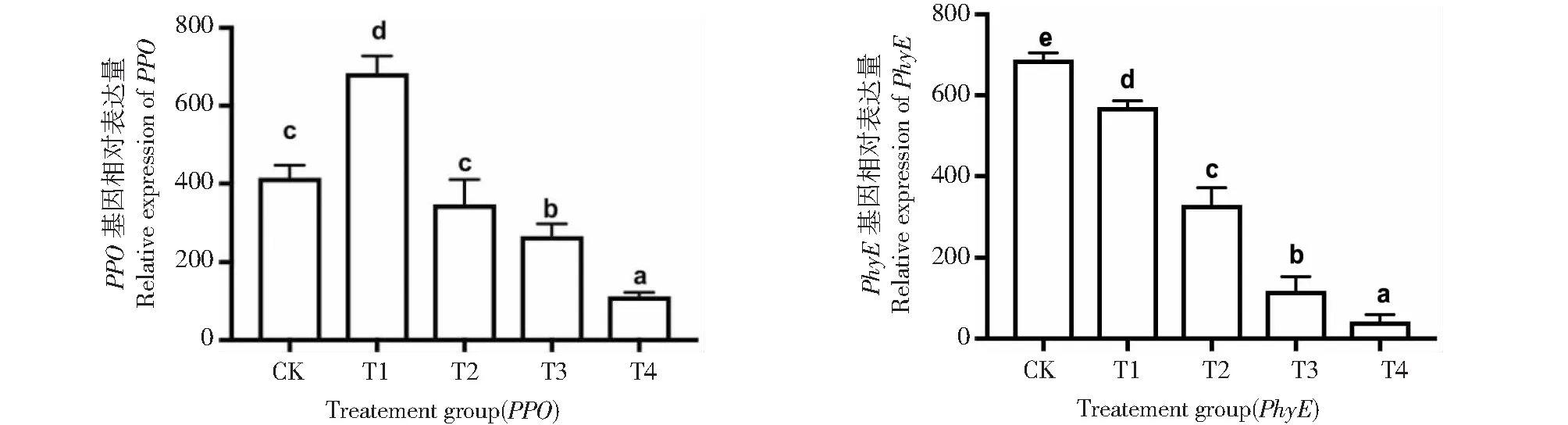
图6 弱光胁迫下PPO与PhyE基因表达量的变化Fig.6 Relative expression of PPO and PhyE under weak light stress
3 讨 论
光是植物生长发育过程中的重要因子,通常弱光处理下的植物会出现叶片变薄、叶色变浅、叶面积增加、细胞色素含量降低等现象[6]。在‘鄞红’幼株的研究中发现,胁迫环境下会使植株根系生长受阻,发育迟缓、叶面积转而减小[14]。葡萄的成熟期在每年8月期间,易受到高温、高湿、CO2浓度等气候条件的影响,光合速率的大小、净光合速率与CO2植物对弱光的利用能力直接体现出光合作用的强弱[19],例如在高温下同时增加CO2的浓度,会效促进黄瓜叶片的光合作用,增加黄瓜的产量[20]。而光合速率降低的原因可分为气孔限制因素和非气孔限制因素[21]。叶绿素在光合作用中起着吸收和转换光能的作用,类胡萝卜素可以稳定叶绿素分子[22]。Chl a/Chl b比值的降低有利于吸收环境中的红光而维持PSI和PSII之间的平衡[23]。本研究表明,‘鄞红’在弱光下通过使植株叶面积增加抵御弱光胁迫对叶片的伤害,弱光下光补偿点较低,光饱和、CO2补偿点及饱和点较高,这同时与种培芳对甜瓜的研究结果一致[24]。处理中Pn、Gs、Tr随胁迫程度的升高而减弱,这可能是由于弱光胁迫下叶片气孔器变短、气孔开度变小限制光合作用的进行,气孔限制是植株光合速率降低的主导因素。但后期Ci随Pn的降低转而升高,光合速率下降又是由非气孔因素限制,这与孙建磊等对黄瓜的研究大致相当[25]。另外,T1与T2处理下,葡萄叶片叶绿素与类胡萝卜素的含量上升,重度胁迫下又会导致叶绿体受损,这与弱光胁迫下颉建明等对辣椒的研究结果一致[26]。综上所述,该葡萄品种对轻微弱光环境有良好的抗性,能够适宜种植的范围较广。
乙醇酸氧化酶(GO)与Rubisco都是植物光合作用过程中的关键酶,Rubisco 活化酶(RCA)更是与 Rubisco 活性关系紧密,它们之间协同作用使光合速率保持平衡[27]。光呼吸的下降会造成有毒物质(如乙醇酸、H2O2)的积累[28],光对于乙醇酸氧化酶活性的影响存在诸多假说,但由于试验材料、品种间的差异、环境因子等不同,结果并不一致。乙醇酸氧化酶活性会受到温度、湿度、光照等共同作用的影响。前人对葡萄的研究证明净光合速率的下降并不等同于光呼吸的增加[14];另外,外源施入甲醇会影响棉花乙醇酸氧化酶的活性,净光合速率升高[29]。此外,光合作用过程中 Rubisco与Rubisco活化酶(RCA)呈正相关,RCA能够降低氨基甲酰化所需要的CO2浓度并提高Rubisco活性。对于水稻的研究发现,胞间 CO2浓度很低时RCA的升高并不能提高水稻的光合速率;随着CO2浓度的提高,光合速率才会随RCA的上升而增大,所以只有当胞间 CO2浓度和RCA活性都很高时才能有效提高光合效率[30]。在本研究中发现净光合速率持续下降,但乙醇酸氧化酶活性在T2处理后显著上升,Rubisco与RCA活性均随遮荫程度的降低持续下降,说明二者协同作用,遮荫不利于Rubisco与RCA的同时生成。由此可见,影响光合作用相关酶活的因素并不是单一的,对于其机制今后还需进一步深入研究。
通过对PPO和PhyE在‘鄞红’葡萄中基因表达量测定中发现,低度弱光胁迫下,植物会通过合成PPO来抵御弱光胁迫,PhyE基因表达量随胁迫程度的升高而降低。但目前对于PPO的研究机理还不够深入,有学者认为PPO参与叶绿体能量转移,通过调节光氧化反来抵御逆境胁迫[31]。双子叶植物家族中PhyE与PhyB有很高的相似性,PhyB调节红光照射下的大多数反应[32]。拟南芥的研究中发现,PhyB会通过调节转录因子的表达调控气孔开闭[10];Liu等对水稻的研究表明,PhyB超表达会使水稻叶面积变小、蒸腾速率降低[33]。这可能是植物通过控制PhyE的含量调节气孔开闭从而适应胁迫环境,但重度弱光胁迫下植物会因细胞受损而无法合成PhyE[34]。因此这2个基因与‘鄞红’弱光抗逆性、气孔导度、蒸腾速率、叶绿素含量存在着密切联系。本课题组验证了葡萄遮光结束后,各个处理组之间基因含量的变化,而关于整个生长期间PPO和PhyE在弱光胁迫下的表达量,以及PhyB与PhyE基因家族之间的关系,需后续进一步验证。
4 结 论
宁波地区夏季光照充足、温度恒定,遮荫T1(25 %、22 000l x)处理下比较有利于‘鄞红’葡萄的生长,抗性较高。但弱光并不是影响葡萄光和特性的唯一因素,叶片的光和特性及相关酶活性在整个试验处理中还会受到多重的影响。今后的研究可以从以下几个方面进行拓展:①对‘鄞红’光合速率的研究要可以具体到T1处理下,光和日变化的某一时间段,以便最大限度提高光能利用率。②进一步分析光敏色素家族在葡萄中的表达量以及各个基因之间的同源相似性。③在弱光胁迫的基础上,可以加入高温、高湿、盐胁迫、重金属胁迫等双重或三重影响因子,为多抗葡萄品种的选育提供有力支持。
