贵州2种砧木对甜樱桃嫁接口解剖结构及幼苗生长特性的影响
2019-01-18郭凯斌文晓鹏
文 壮,洪 怡,郭凯斌,文晓鹏
(贵州大学 农业生物工程研究院/生命科学学院,山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳 550025)
【研究意义】甜樱桃(PrunusaviumLinn.)又称大樱桃,属蔷薇科李属樱桃亚属果树,原产欧洲黑海沿岸和亚洲西部,结果较早,果实较大,色彩鲜艳且营养丰富,具有较高的经济价值。近年来,甜樱桃在中国南方的种植面积迅速增大。在长期的生产实践中发现甜樱桃砧木的选择尤为重要,砧木对甜樱桃植株生长、结果及果实品质有重要影响[1]。【前人研究进展】目前国内常见的甜樱桃砧木有“马哈利”、“大青叶”、“Colt”、“吉塞拉5号”等,以及东北山樱桃、毛樱桃、莱阳矮樱等中国樱桃[2]。这些砧木在北方表现较好,但不适应贵州的气候土壤条件,主要表现为不耐涝、根瘤病严重、产量低、品质差等缺点。【本研究切入点】贵州具有丰富的野生樱桃资源,在前期工作中,课题组发掘了野生樱桃(Prunuspseudocerasus)的“红皮”新种质,与“青皮”樱桃相比,“红皮”樱桃表现为与甜樱桃嫁接亲和性好、抗根瘤、早果、丰产、耐涝等优点。为探讨“红皮”樱桃对接穗的作用机制,以“红皮”樱桃及“青皮”樱桃为砧木嫁接甜樱桃,比较其对嫁接口解剖结构特征及幼苗生长特性的影响。【拟解决的关键问题】以期为贵州本地甜樱桃砧木的选育提供参考。
1 材料与方法
1.1 试验材料
选取生长势基本一致的“红皮”樱桃及“青皮”樱桃为砧木,嫁接本课题组选育的大樱桃芽变新种质“曙光”。
Olympus CX41RF显微镜(日本Olympus公司生产),游标卡尺,Li-6400 型便携式光合测定系统(美国 Li-COR公司生产)。
1.2 试验方法
1.2.1 嫁接口解剖结构观测 嫁接20和120 d后,分别取6个嫁接组合接口,剪成0.5 cm左右的枝段,经FAA固定液固定,采用石蜡切片法制片,观察嫁接口愈合情况,并测定砧穗间薄壁细胞大小及密度、导管大小及密度。具体方法:材料固定(FAA 固定液)→软化(70 %甘油∶50 %酒精=1∶1,15 d)→乙醇梯度脱水(4级,每级1.5 h)→透明(二甲苯2 h)→浸蜡(1/2二甲苯+1/2石蜡混合液中浸12 h,纯蜡中浸2 h,重复4次)→包埋→切片(10 μm厚)→染色(番红-固绿)→封片→镜检→用Olympus显微镜进行测定分析。细胞大小测定10个细胞,导管测定10个,观察5个视野统计导管数量。
1.2.2 嫁接成活率及新梢生长量测定 采用芽接法嫁接,砧木选取长势一致,直径约1.5 cm(距地面2 cm处)的一年生实生苗,接穗选取饱满的‘曙光’樱桃侧芽,分别嫁接40株。120 d后统计嫁接成活率,并使用游标卡尺测定新梢长度及距嫁接口3 cm处的粗度,每个砧穗组合随机测量6株,每15 d测定1次,共测量 7次。
1.2.3 可溶性糖及叶绿素含量测定 嫁接 240 d后,分别选取2种嫁接苗接穗中部成熟功能叶(从下至上第9~10片)测定可溶性糖、叶绿素含量,每个处理重复3次。叶片可溶性糖含量采用蒽酮比色法测定;叶绿素a、叶绿素b含量采用Arnon改良法测定[3]。
1.2.4 净光合速率测定 嫁接250 d后,选择晴朗天气的09:00-11:00,采用Li-6400 型便携式光合测定系统进行测定。光合测定系统工作参数:CO2浓度400 μmol/mol,光照强度梯度设置为2000,1500,1200,1000,750,500,250,150,100,80,50,20,0 μmol·m-2·s-1。光响应曲线采用二次方程拟合,计算光饱和点及最大净光合速率。光照强度低于250 μmol·m-2·s-1以下的曲线采用线性拟合,计算光补偿点及表观量子效率。
1.2.5 数据分析 采用Excle 2016、origin 8 软件作图;利用SPSS 20.0 软件进行差异显著性分析。
2 结果与分析
2.1 砧木嫁接口解剖结构
嫁接20 d后,2种砧木的嫁接口均无愈伤组织形成,砧穗易分离。嫁接120 d后,“红皮”砧离层基本消失,维管束桥形成;“青皮”砧愈合面隔离层仍然存在,愈合面两侧细胞较少,少见维管束桥连通(图1)。从愈合处砧木导管密度及面积的情况看,单个视野中“红皮”砧导管数量为53个,显著高于青皮(36个),但砧穗间导管面积的差值无显著差异。从嫁接口愈合处薄壁细胞数目及大小看,“红皮”砧嫁接口愈合处单个视野中薄壁细胞数目(437个)高于“青皮”砧(292个),2种砧木嫁接口愈合处薄壁细胞的大小差异未达显著水平。
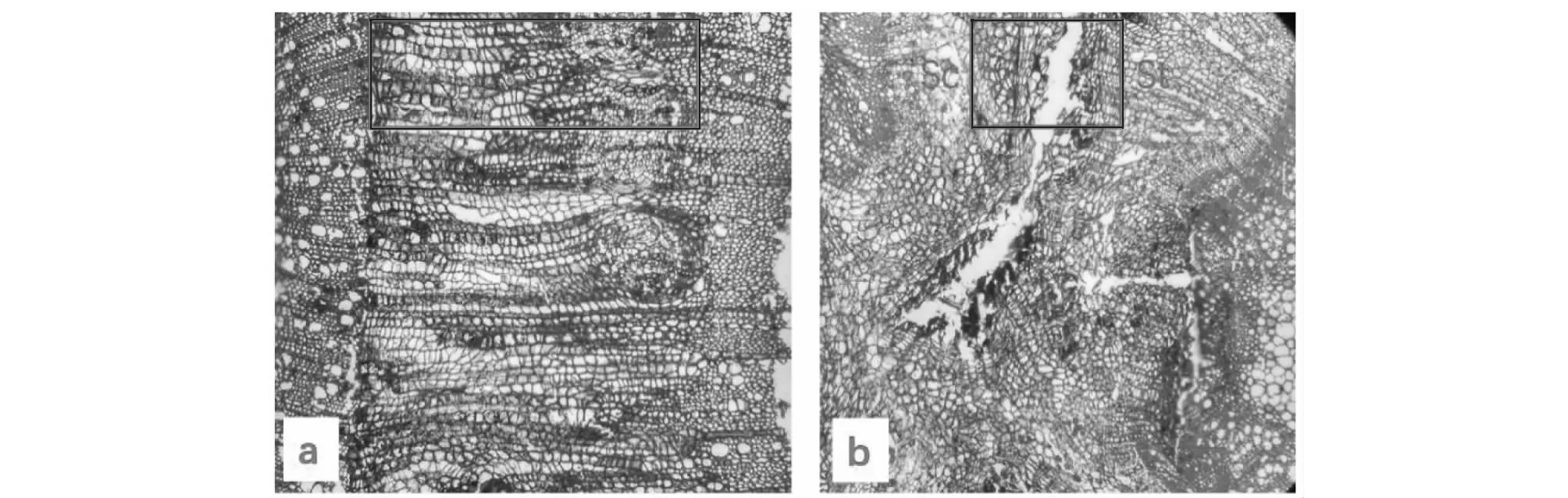
St和Sc分别表示砧木和接穗;方框内为砧穗间愈合区St and Sc represent stock and scion respectively. Red square represents the healing field between stock and scion图1 嫁接120 d后红皮(a)和青皮(b)嫁接口解剖结构Fig.1 The graft union’s anatomical structure of two sweet cherry varieties in 120 days after grafting

图2 砧木对嫁接苗株高和茎粗的影响Fig.2 Effects of two stocks on height and stem diameter of grafting seedlings
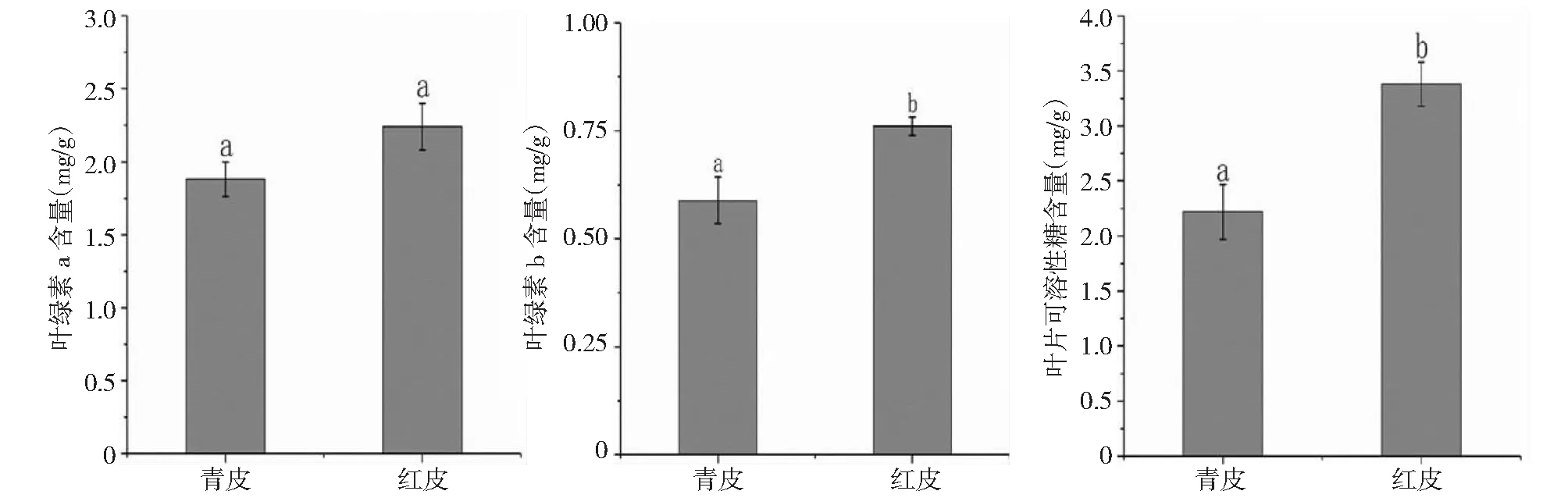
图中不同小写字母表示差异达显著水平(P<0.05)Different lowercase letters indicate significance of difference at P<0.05 level图3 砧木对叶片叶绿素及可溶性糖含量的影响Fig.3 Effect of two stocks on chlorophyll and soluble sugar content in leaves of grafting seedlings
2.2 砧木对嫁接成活率与营养生长的影响
“曙光”甜樱桃与“红皮”砧木嫁接成活率为83 %,略高于“青皮”处理(78 %),两者差异未达显著水平。从图2看出,嫁接苗于嫁接165 d后生长出现显著差异,“红皮”砧嫁接苗株高、茎粗显著高于“青皮”砧嫁接苗;嫁接 180 d 后,“青皮”砧嫁接苗生长迟缓,接穗基本停止生长。综合来看,嫁接苗长势“红皮”砧处理明显优于“青皮”砧处理。
2.3 砧木对接穗叶片叶绿素及可溶性糖含量的影响
由图3看出,“红皮”砧嫁接苗叶绿素a含量略高于“青皮”砧;叶绿素b含量为0.76 mg/g,显著高于“青皮”砧(0.58 mg/g)。“红皮”砧接穗叶片的可溶性糖含量为3.38 mg/g,显著高于“青皮”砧(2.22 mg/g)。
2.4 砧木对嫁接苗光合特性的影响
从图4看出,随着光强逐渐增大,2种砧木嫁接苗的光合速率都逐渐升高,“红皮”嫁接苗升高速率高于“青皮”嫁接苗,在光强超过1200 μmol·m-2·s-1后,光合速率增加缓慢。“红皮”处理饱和光强为1544 μmol·m-2·s-1,高于“青皮”砧饱和光强(1381 μmol·m-2·s-1);“红皮”和“青皮”处理的光补偿点分别为40.67和38.66 μmol·m-2·s-1,差异不显著。“红皮”处理曙光的最大光合速率(21.43 μmolCO2·m-2·s-1) 高于“青皮”处理(15.87 μmolCO2·m-2·s-1)。从2种砧木嫁接苗气孔导度看,光照强度低于500 μmol·m-2·s-1时气孔导度两者间无显著差异;高于500 μmol·m-2·s-1时,“红皮”砧嫁接苗气孔导度最大值为0.74 mmolH2O·m-2·s-1,显著高于“青皮”砧嫁接苗(0.39 mmolH2O·m-2·s-1),有利于叶片吸收更多的CO2。
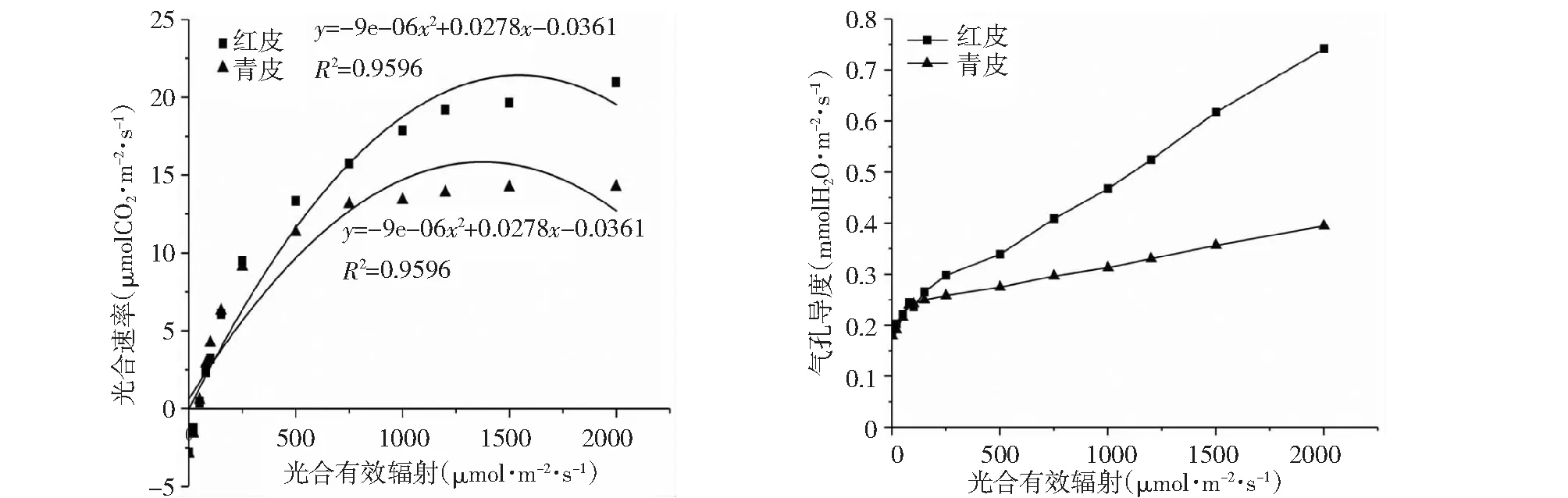
图4 砧木对嫁接苗光合速率及叶片气孔导度的影响Fig.4 Effects of two stocks on photosynthetic rate and stomatal conductance of grafting seedlings
3 讨 论
砧穗间嫁接亲和性可以从嫁接成活率、嫁接口解剖结构、生理及光合特性等多方面来反映。砧穗间组织结构的相似度与嫁接亲和性有直接关系,因此对砧木与接穗的内部组织结构进行解剖观察,有助于研究嫁接亲和性[4]。关于果树嫁接体愈合的过程研究较多,虽然不同砧穗组合愈合所需时间不同,但愈合过程大致相同,先后经历隔离层的形成、愈伤组织的形成、形成层的分化、输导组织的分化与连接4个阶段[5]。初庆刚等[6]研究发现,梨树嫁接20 d形成维管束;“秋富1”苹果嫁接在八棱海棠等砧木上7 d后已经形成愈伤组织[7];油茶嫁接35 d后维管束桥已完全形成[8]。因此,不同种类的植物其嫁接口愈合时间存在一定差异。本研究中,由于采取冬季芽接的方式,温度较低,嫁接20 d后,2种砧穗组合都没有形成愈伤组织;嫁接150 d后,“曙光”樱桃与“红皮”砧的愈合状况较好,砧穗间能形成良好的疏导组织,而“曙光”樱桃嫁接在“青皮”砧上,隔离层未完全消失,从而影响到愈伤组织以及输导组织的形成。同时比较2种砧木导管的数量及面积,尽管导管面积无显著差异,但“红皮”砧导管数目显著高于“青皮”砧,结合砧穗间愈合情况表明“红皮”砧矿物质运输能力优于“青皮”,便于接穗矿质营养的吸收。
解剖结构可以直接反映砧穗间嫁接亲和性,同时结合嫁接成活率和接穗的生长势,则可对砧穗嫁接亲和性更准确的判断。本研究中,尽管“曙光”樱桃嫁接在2种砧木上均能成活,成活率无显著差异。但从新梢长势及形态表现看,嫁接在“红皮”砧上的新梢长势好,嫁接芽萌发后,当年生幼苗株高可达160 cm。结合嫁接口的愈合度观察结果可认为“红皮”砧木的亲和性更好。
嫁接体成功愈合后,接穗与砧木的互相作用,使砧穗间组织结构趋于相同化[9]。由于不同砧木的根系对营养吸收能力的不同,且不同砧穗组合营养物质的运输也存在差异,从而影响了不同嫁接体接穗的生长发育。关于果树砧穗互作的相关研究中,学者的关注点多集中于砧木对接穗营养生长的影响,如对苹果[10-11]、桃[12]、樱桃[13]、柠檬[14]等的研究表明,砧木能够通过调控根部无机盐的吸收和地上部位的运输,从而影响地上部分矿质营养及有机物合成。光合作用作为植物生长发育的重要生理活动,而光响应曲线反映出净光合速率与光强变化间的规律,其光合速率、光饱和点、光补偿点是植物重要的生态生理参数[15]。光补偿点及饱和点体现植物利用弱光和强光的能力。叶绿素作为光合作用的主要色素,植物的光合能力随着叶绿素含量的增加而不断加强[16]。杨江山等[17]认为,叶绿素a作为光合作用中能量传递的最终受体,叶绿素a含量较高时,激活态的分子越多,参与光合作用的分子也越多,因此光合效率增高。本研究中,“红皮”砧嫁接苗的叶绿素a含量略高于“青皮”砧嫁接苗,叶绿素b含量及总叶绿素含量显著高于“青皮”砧嫁接苗。同时,叶绿素a作为弱光条件下吸收光能的主要色素,测定嫁接苗光补偿点及光饱和点发现:两者光补偿点差异不大,但“红皮”砧嫁接苗光饱和点显著升高,证明其利用强光的能力较强。这一结果与叶绿素含量测定结果一致。
CO2作为光合作用的原料,气孔是植物与外界环境进行物质交换的主要通道,控制CO2进入植物体内[18]。气孔的开闭程度通常以气孔导度来表示,它是决定植物光合强度的重要因素[19]。本研究中,弱光条件下气孔导度无显著差异,随着光强的增高,气孔导度呈线性上升且“红皮”砧嫁接苗升高速率显著高于“青皮”砧嫁接苗,这一结果与叶子飘等[20]的研究结果较为一致。叶片可溶性糖作为光合作用的直接产物,是光合效率的最终体现。由此,可推测由于2种砧穗组合嫁接苗叶片叶绿素含量以及气孔导度的差异,导致“红皮”砧幼苗最大光合效率显著高于“青皮”砧幼苗,进而影响叶片碳水化合物的积累。
4 结 论
综合“红皮”砧嫁接口愈合较好、幼苗生长迅速、叶片叶绿素和可溶性糖含量及光合速率较高等表现,认为“红皮”砧木适宜在贵州地区作为甜樱桃砧木进行应用。
